芍药苷对糖尿病大鼠视网膜Müller细胞的保护作用
张 博,李凤君,左中夫
糖尿病视网膜病变 (diabetic retinopathy,DR)人群不断增加,晚期易导致失明,对患者的生活带来沉重的负担[1]。近年来研究证实神经退行性变亦是DR的重要发病机制,且早于微血管病变[2]。因此,有效预防和治疗DR神经病变亦尤为重要。中医中药在防治糖尿病中扮演重要的角色[3]。芍药苷为芍药的主要成分,被证实具有降低血糖及神经保护等作用[4],近期研究发现,芍药苷可通过HSP70/TLR4/NF-κB通路抑制小胶质细胞基质金属蛋白酶9(matrix metallopeptidase-9,MMP-9)活化,从而改善 DR[5],但 对Müller细胞的影响还未见报道。因此,本研究通过芍药苷对糖尿病大鼠灌胃治疗,探讨芍药苷对糖尿病大鼠视网膜Müller细胞的影响,期望为DR治疗策略的探讨提供更全面的认识。
1 材料与方法
1.1 材料
1.1.1 实验动物分组及模型制备 SPF级雄性SD大鼠40只,体质量220~240 g(购自锦州医科大学,编号:SCXK(辽)2014-16)。动物饲养室温 25℃,湿度43%,自由摄食饮水。将动物随机分成对照组、糖尿病组、芍药苷组及二甲双胍组,每组各10只。后3组大鼠采用单次腹腔注射STZ (50 mg·kg-1),72 h后检测尾静脉血糖,将血糖浓度>16.7 mmol·L-1的大鼠作为糖尿病模型。模型诱导成功后,依据文献,芍药苷组给予芍药苷(20 mg·kg-1)灌胃治疗[6],每日2次。二甲双胍组给予二甲双胍(20 mg·kg-1)作为阳性对照[7],溶于2 ml生理盐水灌胃治疗,每日1次。对照组、糖尿病组给予等剂量生理盐水。实验期间动态监测大鼠血糖、体重变化。12 w后,进行各项指标检测,实验遵循国家《实验动物管理条例》。
1.1.2 试剂及仪器 盐酸二甲双胍、链脲佐菌素(Streptozotocin,STZ)(美国 Sigma公司);芍药苷(98.78%,南京格伦生物科技有限公司);神经胶质酸性蛋白(Glial fibrillary acidic protein,GFAP)、胶质细胞谷氨酸转运体(Glial glutamate transporter,GLAST)、谷氨酰胺合成酶(Glutamine synthetase,GS)抗体(英国Abcam公司);谷氨酸含量检测试剂盒、荧光二抗及Western blot二抗(北京碧云天生物公司);荧光倒置显微镜(日本Olympus公司);冰冻切片机(德国SLEE公司);水平电泳仪(美国BIO-RAD公司)。
1.2 方法
1.2.1 样本制备 12周后,每组取4只大鼠,水合氯醛麻醉后经心脏灌注4%多聚甲醛固定。固定完成后将大鼠眼球取出于固定液中,4℃保存,用于免疫荧光。每组取6只大鼠水合氯醛深度麻醉,取新鲜视网膜(左眼)于2.5 ml EP管中,依据重量加蛋白裂解液,冰上剪碎,4℃离心机25 min后取上清,-20℃保存用于Western blot;右眼视网膜称重匀浆后加无水乙醇1 mL,离心20 min后取上清-20℃保存用于视网膜谷氨酸含量检测。
1.2.2 视网膜谷氨酸含量检测 视网膜谷氨酸含量检测应用可见分光光度法,操作严格按照说明书进行,按照蛋白浓度计算处视网膜谷氨酸浓度。
1.2.3 免疫荧光检测大鼠视网膜GFAP、GLAST表达 将固定液中的眼球取出后用20%蔗糖溶液脱水,OCT包埋后切片,厚度为12 μm。载玻片于PBS洗涤3次,每次5 min;5%山羊血清+0.1%Triton-100室温孵育30 min;不洗,滴加兔抗大鼠GFAP(1:700)、兔抗大鼠 GLAST(1:600),4 ℃过夜;PBS 洗涤 3次,每次5 min;滴加山羊抗兔二抗,室温避光2 h;PBS洗涤3次,每次5 min;封片后荧光显微镜观察。
1.2.4 Western blot检查大鼠视网膜GFAP、GLAST、GS相对表达量:BCA法测定蛋白浓度,确定电泳时加入15 μL样品;开始电泳,调整电压为90 V,待电泳条带成一条直线时,调整电压为120 V;半干转转膜膜后取目的条带,1%BSA室温封闭2 h;加入一抗(兔抗大鼠 GFAP,1:10000;兔抗大鼠 GLAST,1:8000; 兔抗大鼠 GS,1:8000),4 ℃孵育过夜;TBST洗涤4次,每次5min;加入HRP标记的二抗室温2h,孵育后TBST洗涤4次,每次5 min;ECL试剂盒显影,Image J软件分析灰度值。
1.3 统计学方法
采用SPSS 22.0统计软件分析,所有数值以均数±标准差s)表示,计量数据进行单因素方差分析及LSD检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 造模前后血糖体重变化
大鼠造模前,4组体重之间比较 (F=0.59,P>0.05),血糖之间比较(F=1.38,P>0.05),两者均无统计学差异。造模12周后,4组之间相比,体重(F=2.42,P<0.01)、血糖(F=26.63,P<0.01),均具有统计学意义。与对照组相比,糖尿病组、芍药苷组及二甲双胍组大鼠体重明显降低,比较有统计学差异(P<0.01),而3组之间比较,无统计学差异(P>0.05)。
与对照组相比,糖尿病组血糖均>16.7mmol·L-1,与糖尿病组比较,芍药苷组血糖有所下降但仍高于正常,差异有统计学意义(P<0.01),二甲双胍组与对照组之间未见明显差异(P>0.05)。(表1、图1)
表1 各组大鼠血糖、体重(s,n=10)
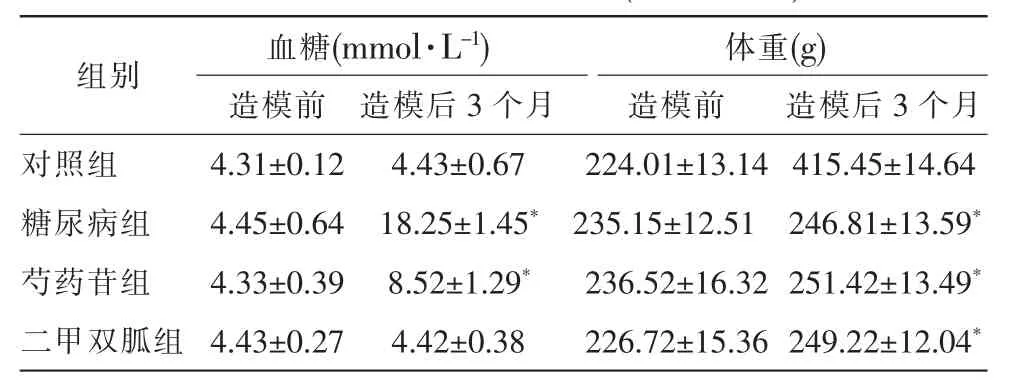
表1 各组大鼠血糖、体重(s,n=10)
注:*与对照组相比,P<0.01
?
2.1 视网膜谷氨酸含量检测
4组之间视网膜谷氨酸含量比较,有统计学差异(F=720.05,P<0.01)。同对照组比较,糖尿病组谷氨酸含量明显升高(P<0.01)。同糖尿病组比较,芍药苷组及二甲双胍组谷氨酸含量明显下降(P<0.01)。见表2
表2 各组大鼠视网膜谷氨酸含量(s,n=6)及免疫荧光检测各蛋白表达 s,n=4)

表2 各组大鼠视网膜谷氨酸含量(s,n=6)及免疫荧光检测各蛋白表达 s,n=4)
注:*与对照组相比,P<0.01;#与糖尿病组相比,P<0.01。GFAP:视网膜神经胶质酸性蛋白;GLAST:胶质细胞谷氨酸转运体
?
2.2 免疫荧光检测结果
GFAP在对照组主要微量表达于视网膜节细胞层,将对照组GFAP蛋白免疫荧光强度设定为100.00%,荧光强度分析结果,4组之间比较,有统计学意义(F=3226.47,P<0.01)。同对照组比较,糖尿病组荧光强度明显升高(P<0.01)。同糖尿病组比较,芍药苷组及二甲双胍组荧光强度均不同程度下降且二甲双胍组下降更明显(P<0.01)。 (表 2、图 1)
GLAST在视网膜各层均有表达,将对照组GLAST蛋白免疫荧光强度设定为100.00%,荧光强度分析结果:4组之间比较,有统计学意义 (F=587.19,P<0.01)。 同对照组相比,糖尿病组 GLAST 荧光强度明显下降(P<0.01),同糖尿病组比较,芍药苷组及二甲双胍组荧光强度明显升高且二甲双胍组升高更明显(P<0.01)。 (表 2、图 1)
2.3 Western bolt检测 GFAP、GLAST、GS 蛋白相对表达量
GFAP蛋白相对表达量:4组之间比较,有统计学意义(F=423.02,P<0.01)。同对照组比较,糖尿病组GFAP表达明显增加(P<0.01),同糖尿病组比较,芍药苷组及二甲双胍组GFAP均显下降(P<0.01)。(见表3、图 2)
GLAST蛋白相对表达量:4组之间比较,有统计学意义(F=129.56,P<0.01)。同对照组比较,糖尿病组GLAST表达明显减少(P<0.01),而同糖尿病组比较,芍药苷组及二甲双胍组GLAST表达明显增加(P<0.01)。 (表 3、图 2)
表3 各组大鼠视网膜蛋白相对表达量s,n=6)

表3 各组大鼠视网膜蛋白相对表达量s,n=6)
注:* 与对照组相比,P< 0.01;# 与糖尿病组相比,P< 0.01。GFAP:视网膜神经胶质酸性蛋白;GLAST:胶质细胞谷氨酸转运体;GS:谷氨酰胺合成酶
?
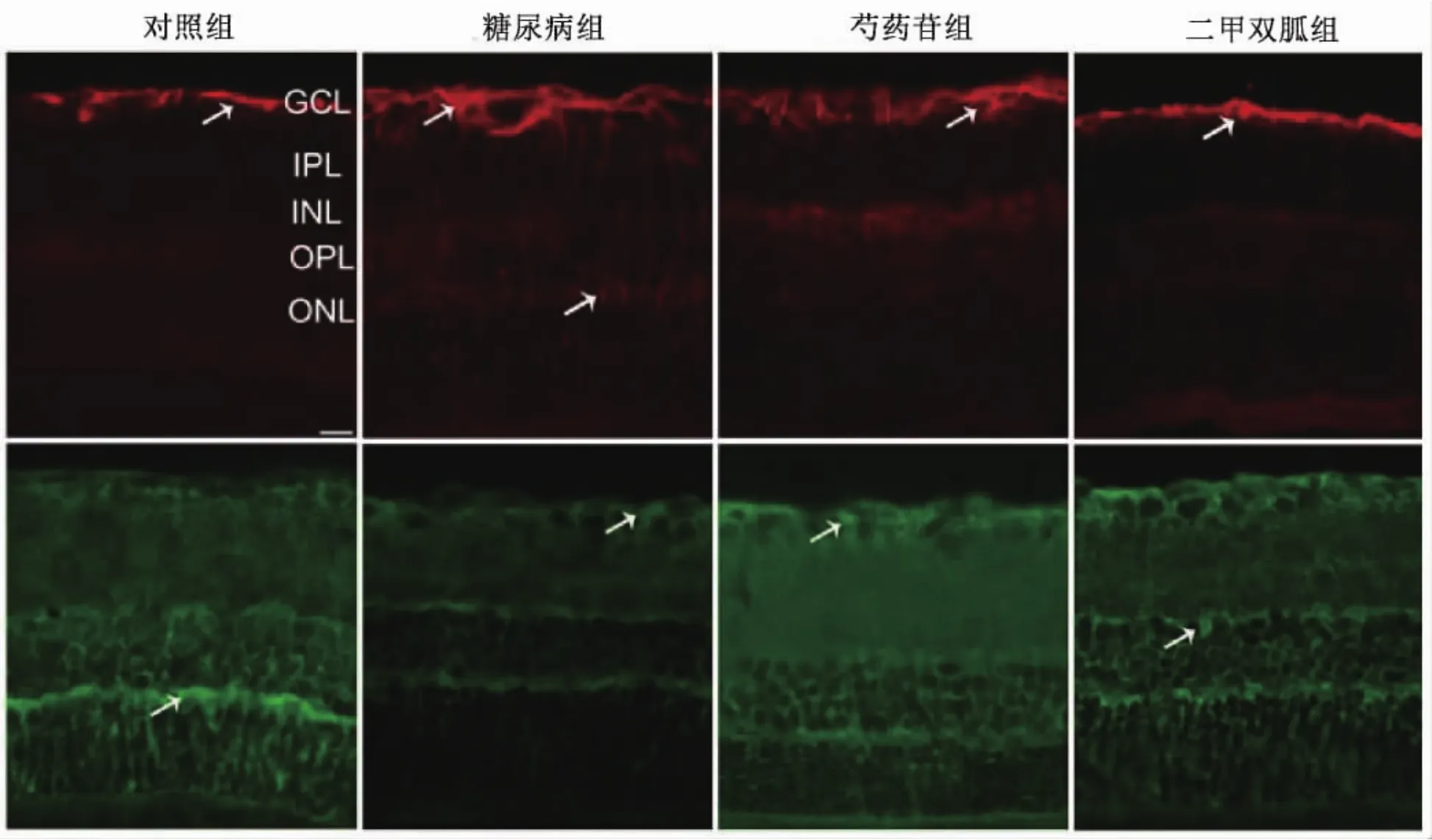
图1 免疫荧光检测各组大鼠视网膜GFAP(红色)、GLAST(绿色)的表达(箭头示阳性表达,×200)。对照组:GFAP主要微量表达于节细胞层,GLAST在视网膜各层均有表达;糖尿病组:GFAP表达明显增强,贯穿于视网膜全层,而GLAST表达较对照组明显减少;芍药苷组:与糖尿病组相比,GFAP表达有所减少,但仍高于对照组,而GLAST表达高于糖尿病组但低于对照组。二甲双胍组:与对照组相比,GFAP与GLAST表达无明显差别。 GCL:节细胞层;IPL:内丛状层;INL:内核层;OPL:外丛状层;ONL:外核层
GS蛋白相对表达量:4组之间比较,有统计学意义(F=2.84,P<0.01)。同对照组比较,糖尿病组GS表达明显减少(P<0.01),而同糖尿病组比较,芍药苷组与二甲双胍组GS表达明显增加(P<0.01)。(表3、图2)

图2 Western blot检测GFAP、GLAST、GS蛋白相对表达量。A对照组;B糖尿病组;C芍药苷组;D二甲双胍组。GFAP:视网膜神经胶质酸性蛋白;GLAST:胶质细胞谷氨酸转运体;GS:谷氨酰胺合成酶;GAPDH:甘油醛-3-磷酸脱氢酶(内参)
3 讨论
近年研究显示DR发病率逐年攀升,已经成为发达国家成年人视力失明最主要的原因[8-9]。DR在我国的发病率也极高,最新发布的《中国2型糖尿病防治指南》就明确指出,DR在我国已经成为成年人致盲的首要因素。DR的高致盲率增加了患者心理及生理负担。神经病变为微血管病变之外参与DR的重要原因。因此,有效预防和治疗DR神经病变亦尤为重要。
中医中药在防治糖尿病中扮演重要的角色[3]。芍药苷为芍药的主要成分,具有降低血糖及神经保护等作用[4],本研究证实芍药苷可以降低糖尿病大鼠的血糖,但效果低于二甲双胍。近期研究发现,芍药苷可通过HSP70/TLR4/NF-κB信号通路抑制小胶质细胞MMP-9激活,从而改善DR[5],但对Müller细胞的影响还未见报道。Müller细胞占视网膜胶质细胞的90%左右,在视网膜贯穿全层。Müller细胞具有支持及营养神经元的作用,Müller细胞结构和功能异常与DR发病关系密切[10]。GFAP是胶质细胞特有的标志性蛋白,特异性表达于胶质细胞,但Müller细胞几乎不表达GFAP,仅当Müller细胞结构和功能异常时可见GFAP表达[11]。本研究发现,正常情况下仅在视网膜的神经节细胞层中有少量的GFAP蛋白表达,但DR状态下视网膜不仅神经节细胞层GFAP表达明显增加,而且免疫荧光观察到视网膜GFAP阳性染色纤维分布空间范围广泛,几乎贯穿视网膜神经组织全层,其分布范围与Müller细胞空间位置相同。而应用芍药苷后可见糖尿病大鼠视网膜内GFAP表达明显减少。该结果提示,芍药苷可能通过有效抑制DR状态下视网膜胶质细胞活化,可能对视网膜Müller细胞起到保护作用。
GLAST为Müller细胞中最主要的谷氨酸转运体,主要表达于Müller细胞胞体和突起。GLAST可对视网膜突触间隙内过多的谷氨酸给予清除,从而大大减少其兴奋毒性。Müller细胞是视网膜中唯一能合成GS的细胞,GS是Müller细胞的功能酶,能将转入细胞内的谷氨酸转化为无毒谷氨酰胺[12],从而降低谷氨酸的细胞毒性,保护视网膜[13]。糖尿病状态下,视网膜中谷氨酸堆积,能产生神经毒性,诱发并加重DR[14]。本研究显示,糖尿病状态下GFAP表达显著增加,说明大Müller细胞已受损,而GFAP表达增加时GLAST、GS表达减少,谷氨酸含量增加,在给予芍药苷后GFAP表达减少同时GLAST、GS在Müller细胞中的表达增加,谷氨酸含量降低。该结果进一步提示,芍药苷可能通过抑制视网膜胶质细胞活化进而改善了糖尿病大鼠视网膜Müller细胞的功能。这提示芍药苷可能对于改善DR具有重要的意义。
综上所述,本研究发现芍药苷可通过抑制DR状态下视网膜胶质细胞活化,上调视网膜GLAST、GS表达,降低视网膜谷氨酸含量,提示芍药苷对糖尿病大鼠视网膜病Müller细胞具有保护作用。这一发现对研究DR的治疗策略提供了新的方向。但因DR发病机制复杂,芍药苷对DR的作用可能涉及众多途径,因此芍药苷对糖尿病视网膜病变的影响及机制仍待深入探讨。

