高效液相色谱-串联质谱法测定人血清中万古霉素的浓度
苗娜 张占英 刘纪松
万古霉素(vancomycin)为三环糖肽类抗菌药物,是目前治疗耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)感染的一线用药[1-2]。Ye等[3]采用系统评价和Meta分析的方法评价了万古霉素治疗药物监测(therapeutic drug monitoring,TDM)的必要性。结果显示,万古霉素TDM能显著增加临床有效率〔优势比(odds ratio,OR)=2.62,95% 可信区间(95%confidence interval,95%CI)=1.34~5.11〕和降低肾毒性发生率(OR=0.25,95%CI=0.13~0.48)。因此,有必要开展万古霉素TDM。本实验旨在建立快速、准确、灵敏的高效液相色谱-串联质谱法(high performance liquid chromatography-tandem mass spectrum,HPLC-MS/MS)测定人血清中万古霉素的浓度。
1 材料与方法
1.1 药品与仪器 万古霉素标准品(纯度:98%,批号:130360-201302,中国食品药品检定研究院提供);万古霉素杂质C标准品(纯度:95%,美国Standardpharm Chemical Technology公司提供;质控品,杭州佰勤医疗器械有限公司提供)。Waters Xevo TQ-S质谱仪(美国Waters公司产品);Waters Acquity UPLCI -Class液相系统(美国Waters公司产品);MassLynx V4.1数据采集系统;MS3旋涡混匀器(德国IKA公司产品);TGL-16离心机(湖南湘仪离心机仪器有限公司产品);BY-320A离心机(北京白洋医疗器械有限公司产品)。
1.2 测定条件
1.2.1 色谱条件 色谱柱:Acquity UPLC-C18 1.7 μm IVD 2.1 mm×50.0 mm,流动相A:含0.1%甲酸的水溶液,流动相B:含0.1%甲酸的甲醇溶液,流速0.5 mL/min,柱温为 45 ℃,进样量 2 μL。梯度洗脱程序(A:B):95:5(0~0.6 min),50:50(0.6~1.5 min),5:95(1.6~2.1 min),95:5(2.1~2.5 min)。
1.2.2 质谱条件 电喷雾离子源(electrospray ionization,ESI),正离子多反应监测(multiple-reaction monitoring,MRM)模式;毛细管电压:3 kV;锥孔电压:35 V;偏转电压:30 V;雾化气温度:500 ℃;雾化气流量:1 000 L/Hr;反吹气:150 L/Hr;碰撞气流量:0.15 mL/min;各化合物监测条件:m/z 725.6→144.1(万古霉素)和m/z 1 145.0→100.2(万古霉素杂质C);碰撞能量:12 V(万古霉素)和43 V(万古霉素杂质C)。
1.3 溶液配制与样品处理
1.3.1 万古霉素溶液配制 取50 mg万古霉素标准品于5 mL容量瓶,用50%甲醇水溶液溶解并定容,配置成浓度为10 g/L的万古霉素储备液。用空白血清依次稀释万古霉素储备液,得到浓度分别为60.00、30.00、15.00、6.00、3.00和1.50 mg/L的万古霉素血清标准溶液。另用空白血清依次稀释万古霉素储备液,分装每管100 μL,得到浓度分别为45.00、20.00和5.00 mg/L的万古霉素血清质控品,置于-80 ℃冰箱保存。
1.3.2 内标溶液配制 取10 mg万古霉素杂质C标准品于10 mL容量瓶,用50%甲醇水溶解并定容,配置成浓度为1.0 g/L的万古霉素杂质C储备液。取40 μL万古霉素杂质C储备液,加入20 mL乙腈,得到万古霉素内标工作液,置于-80 ℃冰箱保存。
1.3.3 血清样品处理 血清样本在室温下解冻,吸取 100 μL至 1.5 mL的 EP管中,加入 300 μL内标工作溶液,涡旋混匀5 min,于4 ℃以11 000 r/min(离心半径5.5 cm)离心5 min,吸取上清液50 μL至1.5 mL洁净聚丙烯塑料管中,加入450 μL纯化水,涡旋混匀5 min,于4 ℃以11 000 r/min(离心半径5.5 cm)离心5 min,吸取上清液100 μL于96深孔板中,进样分析。
1.4 方法学考察
1.4.1 专属性 分别取6份不同空白血清、万古霉素血清标准品和血清质控品,按“血清样品处理”项方法处理,进样HPLC-MS/MS分析。
1.4.2 标准曲线与定量下限 分别取万古霉素血清标准品,按“血清样品处理”项方法处理,最低浓度标准品平行10个样本,其余浓度标准品各平行3个样本,进行HPLC-MS/MS分析。以待测物浓度为横坐标(X),以待测物与内标峰面积比值为纵坐标(Y),用加权最小二乘法(Y=1/X)进行回归计算。
1.4.3 精密度 分别取5.00、20.00和45.00 mg/L的万古霉素血清质控品,按“血清样品处理”项方法处理,每种浓度设6个平行样本,在不同天数内连续制备并测定3批标本,进行HPLC-MS/MS分析,计算日内精密度和日间精密度。
1.4.4 回收率 同时分别取万古霉素血清质控品,按“血清样品处理”项方法处理,每种浓度平行6个样本,进行HPLC-MS/MS分析,样品实测浓度与理论浓度的比值即为回收率。
1.4.5 携带污染 分别取60 mg/L的万古霉素血清标准品和空白血清各6个样本,按“血清样品处理”项方法处理,最高浓度万古霉素血清标准品与空白血清间隔进样,进行HPLC-MS/MS分析。空白血清中待测物峰面积与定量下限待测物峰面积相比计算待测物携带污染率,空白血清中内标峰面积与定量下限内标峰面积相比计算内标携带污染率。
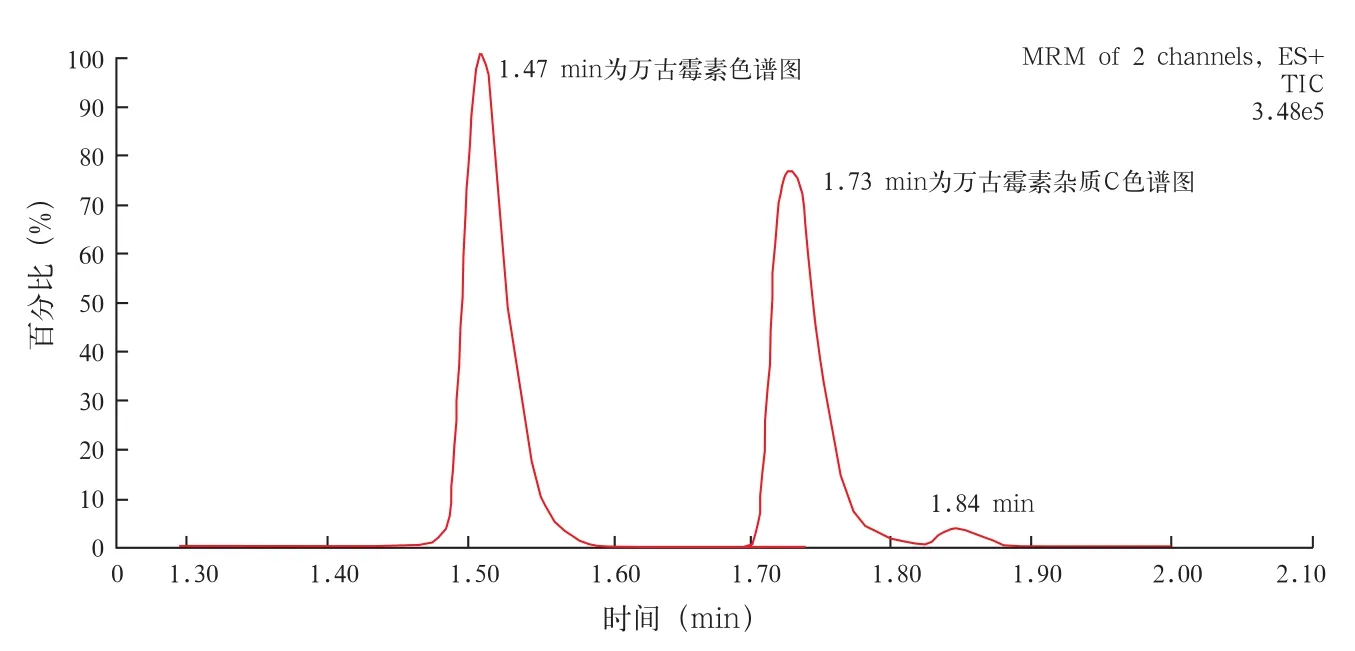
图1 人血清中万古霉素的色谱图

表1 人血清中万古霉素的精密度及回收率
1.4.6 稳定性 分别取20.00 mg/L和45.00 mg/L的万古霉素血清质控品各5份,分别考察血清样本在室温下放置12 h和24 h、经3次反复冻融、-80 ℃冰箱保存30 d的稳定性。
2 结果
2.1 方法学评价
2.1.1 专属性 万古霉素及内标的保留时间为1.47 min和1.73 min。见图1。
2.1.2 标准曲线与定量下限 求得直线回归方程A=2.12×10-1C+2.29×10-3(r=0.999 2)。万古霉素的血清浓度在1.5~60.0 mg/L内线性关系良好,定量下限为1.5 mg/L。
2.1.3 精密度与回收率 万古霉素高、中、低3个浓度的日内标准偏差和日间标准偏差均小于10%,回收率均达到80%以上。见表1。
2.1.4 携带污染 空白样本万古霉素峰面积残留小于定量下限万古霉素峰面积的20%,每个空白样本万古霉素杂质C内标峰面积残留小于定量下限内标峰面积的5%。
2.1.5 稳定性 万古霉素在室温放置12 h和24 h、经3次反复冻融、-80 ℃冰箱保存30 d的稳定性良好,精密度均小于15%。
2.2 方法学应用 测定本院住院接受万古霉素治疗至少4个剂量以上的5例患者稳态血药谷浓度(下一剂量前0.5 h非输液侧采静脉血2 mL)。万古霉素血药谷浓度应控制在10~20 mg/L,对复杂性感染(包括由MRSA引起的心内膜炎、骨髓炎、脑膜炎、医院获得性肺炎等),万古霉素血药谷浓度应达到15~20 mg/L,以保证达到治疗目标和提高临床有效率[4]。5例患者万古霉素血药谷浓度分别为 10.98、10.07、4.16、14.43和13.62 mg/L。
3 讨论
本试验在血清蛋白沉淀剂方面比较了乙腈和甲醇沉淀蛋白对万古霉素峰形和响应的影响,结果显示,甲醇沉淀蛋白后采用等比纯水稀释会发生高浓度离子抑制现象,故选定乙腈作为蛋白沉淀剂用纯水稀释后进样,这与胡伟等[5]研究结果较为一致。万古霉素的内标选择万古霉素医药中间体杂质C,内标专属性强于用其他抗菌药物作为内标,大大降低了检测的假阳性率[6]。本研究建立了一种灵敏度高、简便快速和选择性好的HPLC-MS/MS分析方法,极大简化了操作流程,适用于万古霉素的大批量血药浓度监测。从临床样本万古霉素血药浓度监测的结果看,万古霉素的谷浓度存在显著的个体差异,因此基于谷浓度调整万古霉素给药方案具有显著的临床意义。

