钾和镁离子对大西洋鲑卵孵化及仔鱼开口的影响❋
韩 萃, 孙雪倩, 李 丽,2❋❋, 董双林,2, 魏发奕
(1.海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003; 2.青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266235)
鲑鳟鱼类肉质鲜美,富含优质蛋白和人体所需多不饱和脂肪酸(DHA、EPA等),具有较高的经济价值[1],是世界上重要的养殖种类。据联合国粮农组织(FAO)统计,2017年世界鲑鳟鱼的养殖产量超过了3×106t[2],但是,我国鲑鳟鱼养殖产量却不及世界总产量的1%[3-4]。目前养殖的鲑鳟鱼类中,大西洋鲑(Salmosalar)的产量居首位,占世界鲑鳟鱼总产量的60%左右[4]。近几年,我国为了发展鲑鳟鱼养殖产业,开展了黄海冷水团绿色养殖项目。我国黄海西北部有一个面积达数万平方公里的(黄海)冷水团,其夏季底层水温低于10℃。黄海冷水团绿色养殖项目旨在开发利用这一独特的冷水资源规模化地开展鲑鳟鱼类海水养殖。
鲑鳟鱼鱼卵孵化和仔鱼开口仍需在淡水中进行,并且对水质要求较高。因此,地下水是鲑鳟鱼早期发育的首选水源[5-7]。但采用地下水进行养殖时,时常会出现受精卵孵化率低,鱼苗成活率低,幼、成鱼发病率高等问题[5-7],这可能与地下水中某些离子缺乏或比例失衡有关。研究表明,黑鲷(Sparusmacrocephalus)在缺乏Mg2+的海水中孵化会出现畸形[9]。王广军等[10]研究发现,随着水中Mg2+含量由912 mg/L增加至1 216 mg/L,日本鳗鲡(Anguillajaponica)的孵化率升高,畸形率降低,此外,Mg2+/Ca2+在2.6~3.4之间,适宜日本鳗鲡孵化。王树海等[11]研究指出,提高水中K+浓度会显著提高虾苗成活率。另外,Luke A等[12]研究发现,水中Mg2+、K+浓度偏低,会造成南美白对虾仔虾的成活率降低。还有研究指出[13],适当增加水中K+浓度,会使鳗鲡受精卵的孵化率升高,畸形率降低,仔鱼存活时间延长。
黄海冷水团绿色养殖项目组在日照建立了鲑鳟鱼苗孵化基地,为该项目提供优质鱼苗。但经测定发现日照地下水中K+和Mg2+含量偏低,这可能会影响鲑鳟鱼的早期发育。因此,本文以大西洋鲑为实验对象。研究增加地下水中钾和镁离子的含量是否有利于大西洋鲑的早期发育,以期为黄海冷水团绿色养殖工程的顺利进行奠定基础,为我国冷水鱼养殖提供基础资料和参考。
1 材料与方法
1.1 实验材料
无机元素混合标准液(购自中国计量科学研究院)、硝酸溶液(1∶1)、氯化钾(国药,优级纯)、氯化镁(国药,优级纯)、调温电炉、电感耦合等离子体发射光谱仪(Thermo)、光照培养箱(宁波江南)、YSI pH100A、YSI EC300A及848 Titrino plus(瑞士万通)等。
实验用水为日照地下水,取自万泽丰渔业有限公司,钾和镁离子的浓度梯度通过直接添加氯化钾和氯化镁至日照地下水实现。实验所用大西洋鲑发眼卵购自冰岛,在-4 ℃条件下运回实验室,缓慢升温至8 ℃,稳定3 d后开始实验。
1.2 水质检测
氨氮采用靛酚蓝法测得[14],氯离子和硫酸根离子分别用硫氰酸汞分光光度法[15]和铬酸钡光度法测得[16]。采集50 mL水样,加入1 mL HNO3于-20 ℃冰箱中保存[17],金属离子由电感耦合等离子体发射光谱仪测得[18]。pH、盐度及碱度分别由YSI pH100A、YSI EC300A及848 Titrino plus测得。
1.3 实验设计
本文以日照地下水为空白对照组(C),在日照地下水中添加不同浓度梯度的钾离子(0、2、4、6、8 mg/L)和镁离子(0、5、10 mg/L),2种离子不同添加量采用完全正交组合设计,共15个处理,每个处理3个平行。KxMy,x和y分别为钾和镁离子的添加量(mg/L),每个处理中K+、Mg2+的添加量见表1。
挑选30粒健康的鱼卵至直径为12 cm的玻璃培养皿中,加入提前曝气24 h以上的地下水200 mL。待鱼卵孵化(破膜孵出),记录时间、孵化个数以及死亡个数,计算孵化率、孵化时间以及鱼卵存活率。鱼卵孵化后,剔除卵壳,将孵出的仔鱼全部转至对应浓度的30孔板(4.2×2.8×4.5 cm3/孔)中继续培养至开口。每孔加入30 mL水。实验期间,每天虹吸式换水2次,每次换水量为100%(水吸出后立刻加入新鲜水体,时间不宜过长)。整个实验在光照培养箱中进行(光照强度为0),连续进行7周。前4周,培养箱内温度为8 ℃,第5周,缓慢升至10 ℃(0.5 ℃/d),第7周升至12 ℃(0.5 ℃/d)[19]。记录死亡个数、畸形个数、开口时间以及开口个数,计算仔鱼存活率、畸形率以及开口率。
其中,鱼卵破膜后,仔鱼孵出,视为完成孵化。仔鱼发生脊柱弯曲定义为畸形。开口至仔鱼开始摄食并正常排泄。孵化时间是指从鱼卵发育至仔鱼孵出的时间。开口时间为从鱼卵发育至第一次排泄的时间。
鱼卵存活率(%)=(N-M)/N×100;
(1)
仔鱼存活率(%)=(Ni-Mi)/Ni×100;
(2)
畸形率(%)=D/Ni×100;
(3)
开口率(%)=F/Ni×100。
(4)
其中:M为死亡鱼卵数;N为发眼卵总数;Mi为死亡仔鱼数;Ni为测定仔鱼总数;D为畸形仔鱼数;F为正常排泄仔鱼数。
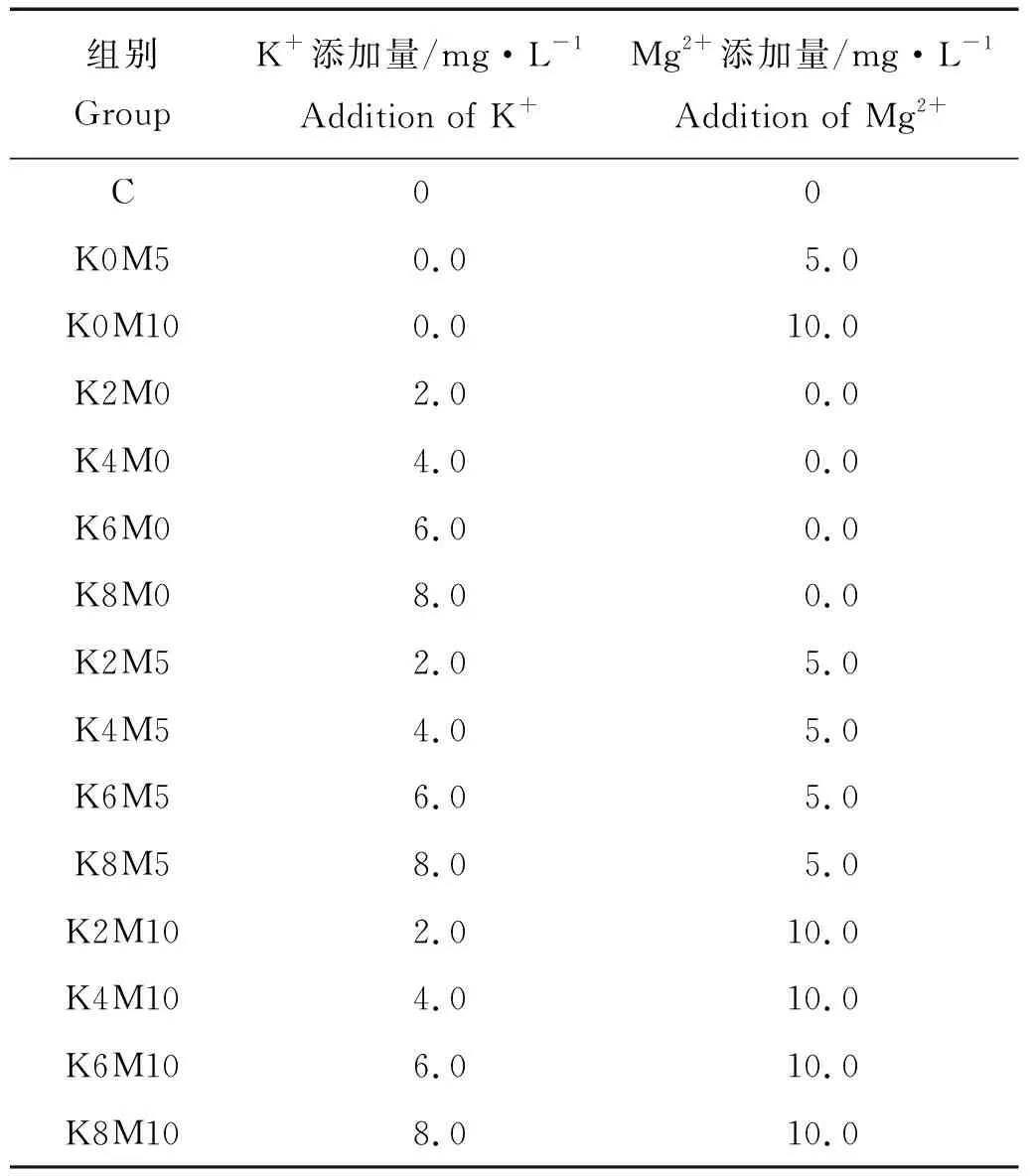
表1 各处理中K+、Mg2+的含量Table 1 the concentration of K+, Mg2+in different treatments
1.4 统计分析
采用Kolmogorov-Smirnov检验和Levene检验方法分别进行数据的正态分布检验、方差齐性检验。若符合正态分布且方差齐,用双因素方差分析进行钾和镁对大西洋鲑死亡率、孵化率、孵化时间、畸形率、开口率、开口时间影响的显著性分析。差异显著时,再通过LSD检验进行组间多重比较分析。显著性水平P= 0.05。统计分析由SPSS 19.0软件实现。
2 结果
2.1 地下水水质检测结果
地下水水质指标见表2,氨氮、Al、Cd、Cr、Cu、Fe、Mn、Pb、Se及Zn含量都很低。pH、盐度、碱度及硬度都符合鲑鳟鱼养殖用水要求(见讨论)。地下水中K+、Ca2+、Na+和Mg2+含量分别为(1.05±0.09)、(41.96±7.23)、(18.64±2.63)和(10.54±1.66)mg/L。

表2 日照地下水水质Table 2 The water quality of underground water in Rizhao
2.2 大西洋鲑卵存活率、孵化率、孵化时间
对不同处理中大西洋鲑卵的存活率(见表3)比较发现,K+和 Mg2+同时添加时,在添加5 mg/L Mg2+条件下,随K+浓度升高,存活率的变化趋势同不添加Mg2+条件,K6M5组存活率最高,组间差异不显著(P>0.05);在添加10 mg/L Mg2+条件下,随K+浓度升高,存活率的变化呈现逐渐降低趋势(见表3);在添加6~8 mg/L K+条件下,存活率均是添加5 mg/L Mg2+组的高于添加10 mg/L Mg2+组的;在添加2 mg/L K+情况下,刚好相反。分析结果显示,K+和Mg2+对大西洋鲑卵存活率的影响不存在显著的交互作用(见表4,P>0.05),但是K+和Mg2+对大西洋鲑卵存活率的影响显著。只添加K+的组中,大西洋鲑卵的存活率随着K+浓度的升高呈现先上升后降低趋势,K6组存活率最高;分析结果显示,K+对大西洋鲑卵的存活率有显著影响(见表4,P=0.024)。K+各组间差异分析见表5,添加8 mg/L K+与其他组间均有显著差异,其余组间差异不显著。只添加Mg2+的组鱼卵存活率显著高于对照组C(见表6,P<0.05),添加5 mg/L Mg2+组存活率最高。添加5 和10 mg/L Mg2+组间差异不显著(见表6,P> 0.05)。分析结果显示Mg2+对孵化前大西洋鲑卵的存活率影响极其显著(见表4,P=0.009)。
大西洋鲑卵的孵化率变化趋势与存活率的相似(见表3),孵化率较高的组分别是K6M0、K6M5、K2M10和M5组。添加10 mg/L Mg2+,孵化率随K+浓度降低而升高;添加5 mg/L Mg2+或不添加,孵化率均在K+为6 mg/L时达到最大。但分析结果显示,K+和Mg2+及其交互作用对孵化率影响均不显著(见表4,P> 0.05)。
所有组大西洋鲑卵在4.86~6.23 d内完成孵化,如表3,孵化时间无显著差异,分析结果显示,K+和Mg2+及其交互作用对孵化时间的影响均不显著(见表4,P> 0.05)。
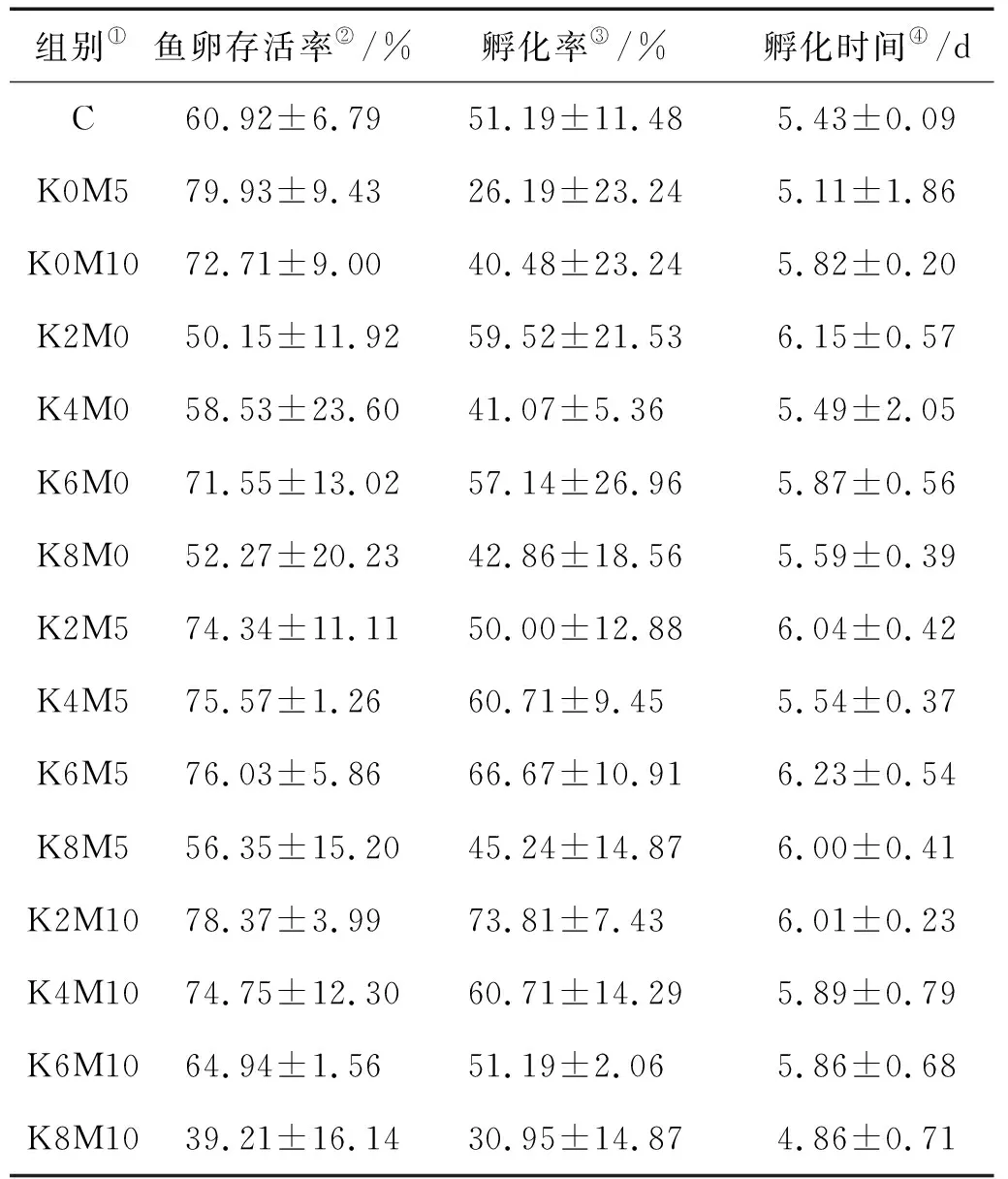
表3 不同处理大西洋鲑卵的存活率、孵化率、孵化时间Table 3 The survival rate, hatching rate and hatching time of S. salar eggs in different treatments
Note: ①Group;②Survival rate ofS.salaregg;③Hatching rate ofS.salaregg;④Hatching time ofS.salaregg
2.3 大西洋鲑仔鱼存活率、开口率、开口时间
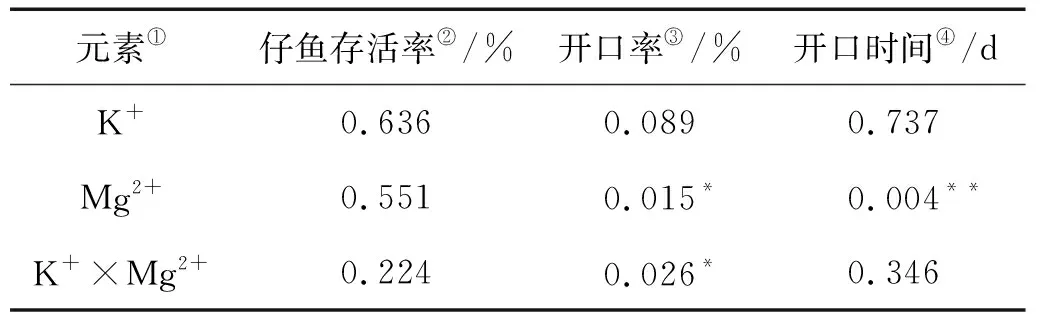
2.3.1 存活率 地下水中添加K+和Mg2+并不会对大西洋鲑仔鱼存活率产生显著影响(见图1),所有组中仔鱼存活率均高于84%,双因素方差分析结果显示K+、Mg2+及其两者交互作用对仔鱼存活率的影响并不显著(见表7,P>0.05)。

表4 K+、Mg2+对大西洋鲑卵的存活率、 孵化率、孵化时间影响的双因素方差分析Table 4 Two-way ANOVA of the effect of K+ and Mg2+on the survival, hatching rate and hatching time of S. salar eggs
注:*表示组间差异显著P<0.05;**表示组间差异极显著P<0.01。
Note:*represent significant differences between groupsP<0.05;**represent extremely significant differences between groupsP<0.01.
①Elements;②Survival rate ofS.salaregg;③Hatching rate ofS.salaregg;④Hatching time ofS.salaregg
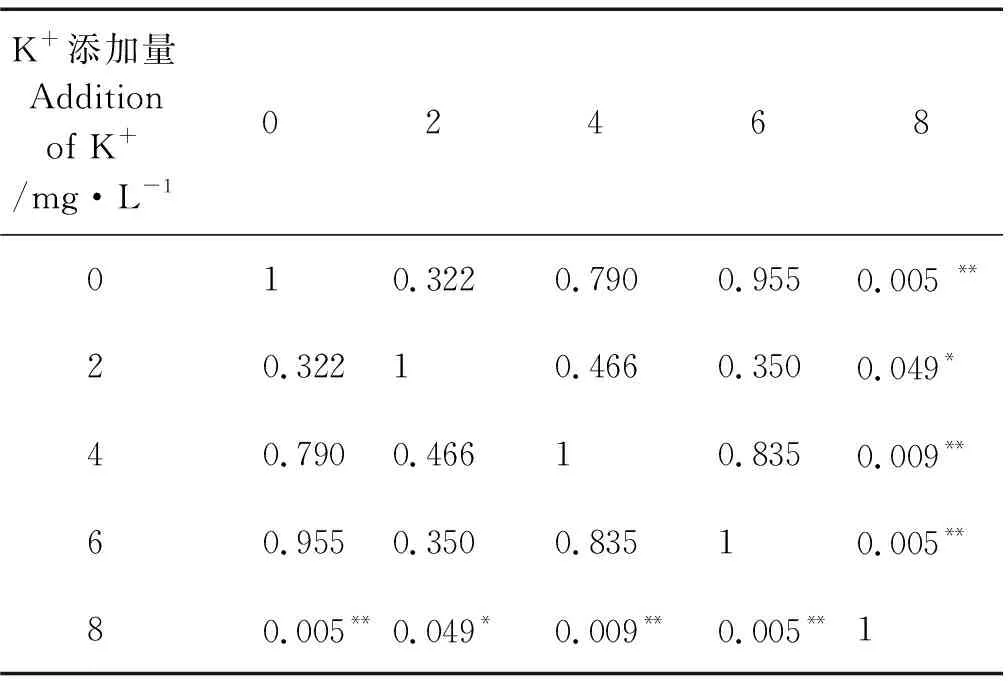
表5 K+对大西洋鲑卵存活率影响的双因素方差分析结果Table 5 Two-way ANOVA of the effect of K+on the survival rate of S. salar eggs
注:*表示组间差异显著P<0.05;**表示组间差异极其显P<0.01。
Note:*represent significant differences between groupsP<0.05;
**represent extremely significant differences between groupsP<0.01.

表6 Mg2+对大西洋鲑卵存活率影响的双因素方差分析结果Table 6 Two-way ANOVA of the effect of Mg2+on the survival rate of S. salar eggs
注:*表示组间差异显著P<0.05;**表示组间差异极其显P<0.01。
Note:*represent significant differences between groupsP<0.05;**represent extremely significant differences between groupsP<0.01.
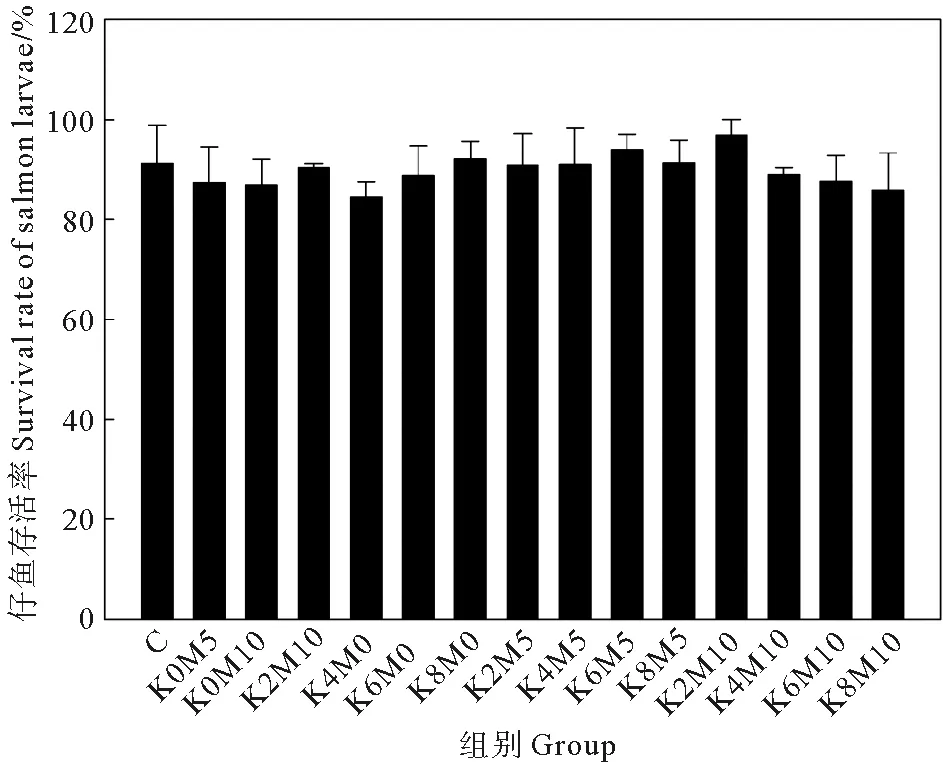
图1 不同处理下的大西洋鲑仔鱼存活率Fig. 1 The survival rate of S. salar larvae in different treatments
元素①仔鱼存活率②/%开口率③/%开口时间④/dK+0.6360.0890.737Mg2+0.5510.015*0.004**K+×Mg2+0.2240.026*0.346
注:*表示组间差异显著P<0.05;**表示组间差异极其显P<0.01。
Note:*represent significant differences between groupsP<0.05;**represent extremely significant differences between groupsP<0.01.
①Elements;②Survival rate ofS.salarlarvae;③First feeding rate ofS.salarlarvae;④First feedingtime ofS.salarlarvae
2.3.2 开口率 大西洋鲑仔鱼的开口率均大于60%(见图2),K+和Mg2+同时添加时,K2M5、K4M5和K6M5组的开口率分别比K2M0、K4M0和K6M0组高出24.7%、11.0%和6.1%。K2M10、K4M10和K6M10组的开口率分别比K2M0、K4M0和K6M0组高出19.5%、5.85%和3.9%。而K8M0组开口率要略高于K8M5和K8M10组。可见,在K+浓度≤6 mg/L时,添加5~10 mg/L的Mg2+能提高大西洋鲑的开口率。而在K+浓度为8 mg/L时,Mg2+的添加反而降低了大西洋鲑的开口率,尤其是添加了10 mg/L Mg2+后,开口率降至63%。经分析,K+和Mg2+对大西洋鲑仔鱼开口率的交互影响显著(见表7,P<0.05)。
在考虑交互作用的基础上,分析了K+和Mg2+对大西洋鲑仔鱼的开口率的影响。K2M0、K4M0、K6M0和K8M0组的开口率分别为67.9%、73.5%、89%和98%,开口率随K+浓度升高而升高,但与对照组相比差异不显著(P>0.05);另外,分别添加了5和10 mg/L Mg2+的K0M5、K0M10组的开口率均高于对照组,双因素方差分析结果显示,Mg2+对大西洋鲑仔鱼的开口率影响显著(见表7,P<0.05),添加5 mg/L Mg2+能显著提高大西洋鲑仔鱼的开口率(见表8,P<0.01)。

图2 不同处理下的大西洋鲑仔鱼开口率Fig. 2 The first feeding rate of S. salar larvae in different treatments

Mg2+添加量Addition of Mg2+/mg·L-105 10 010.006 **0.4515 0.006 **10.034*10 0.4510.034*1
注:*表示组间差异显著P<0.05;**表示组间差异极其显P<0.01。
Note:*represent significant differences between groupsP<0.05;**represent extremely significant differences between groupsP<0.01.
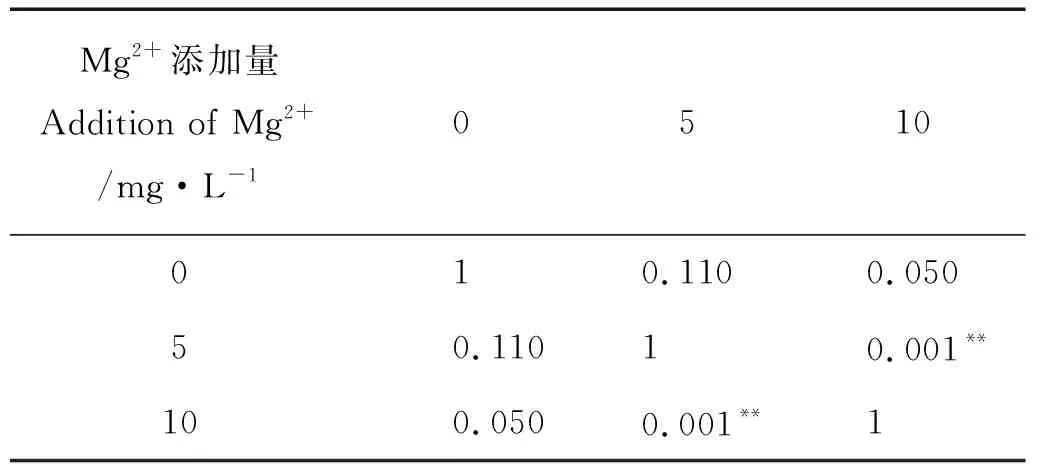
2.3.3 开口时间 如图3所示,大西洋鲑仔鱼在50 d内完成开口,不添加Mg2+条件下,大西洋鲑的开口时间随K+浓度升高呈现缩短趋势,但组间差异不显著(P>0.05);不添加K+条件下,大西洋鲑的开口时间在5 mg/L Mg2+组最短,但与对照组差异不显著;在添加相同浓度K+条件下,添加5 mg/L Mg2+组大西洋鲑仔鱼的开口时间要短于添加10 mg/L Mg2+组大西洋鲑仔鱼的开口时间。经分析,Mg2+对大西洋鲑的开口时间有显著影响(见表7,P<0.05)。添加10 mg/L Mg2+与添加5 mg/L Mg2+组间差异极其显著(见表9,P<0.05),Mg2+和K+间的交互作用不显著(见表7,P>0.05)。

图3 不同处理下的大西洋鲑仔鱼的开口时间Fig. 3 The first feeding time of S. salar larvae in different treatments
Mg2+添加量Addition of Mg2+/mg·L-105 10 010.1100.0505 0.11010.001**10 0.0500.001**1
注:*表示组间差异显著P<0.05;**表示组间差异极其显著P<0.01。
Note:*represent significant differences between groupsP<0.05;**represent extremely significant differences between groupsP<0.01.
3 讨论
3.1 地下水水质分析

在阳离子对水生生物影响的研究中,Mg2+、Ca2+和K+研究较多且对水生生物影响较重要。本文地下水中Ca2+含量为(41.96±7.23)mg/L,对于淡水中鱼卵孵化,Ca2+并不缺乏。对于Mg2+,施兆鸿等[9]发现黑鲷受精卵能够在缺镁海水中发育到孵化阶段,但不能孵出仔鱼或孵出的仔鱼会立即死亡。黑鲷育苗需要870~1 000 mg/L Mg2+。王广军等[10]实验发现在 Ca2+含量不变的情况下,日本鳗鲡的孵化率随着水中Mg2+含量的增加而升高。日本鳗鲡胚胎孵化需要990~1 300 mg/L Mg2+。黑鲷孵化盐度为26,本文测得地下水盐度为0.3~0.4,海水稀释至同盐度(0.4)时水中Mg2+含量为15.38 mg/L,因此,Mg2+可能对于大西洋鲑的孵化来说偏低。Roy等[12]研究发现,水中K+浓度在5~40 mg/L范围内,南美白对虾仔虾的成活率、特定生长率都随K+浓度的升高而升高。还有研究指出[13],在盐度为34~35,Na+保持稳定,水中K+浓度增加到538 mg/L时,鳗鲡受精卵的孵化率达到最高。本文测得地下水盐度为0.3~0.4,孵化鳗鲡的海水稀释至同盐度(0.4)时水中K+含量6.15 mg/L,本文测得地下水中K+含量为(1.05±0.09)mg/L,可能对于大西洋鲑的孵化来说偏低。
3.2 K+和Mg2+对大西洋鲑鱼卵的影响
已有研究表明水体中K+和Mg2+的含量能影响水生生物的孵化和幼苗的存活[9-10,13]。王树海等[11]研究发现日本对虾虾苗成活率随着K+添加量的上升而上升。Roy等[12]研究指出南美白对虾养殖水体中添加5、10、20和40 mg/L K+时,存活率呈现升高趋势。相似的是,本实验中大西洋鲑孵化前鱼卵的存活率也是随K+添加量逐渐增加至6 mg/L时呈现升高趋势。不同的是本研究中K+添加至8 mg/L时鱼卵存活率降低。王树海等[11]和Roy等[12]研究中养殖水体中K+浓度最高组均接近于海水稀释至同盐度时水中K+含量,而本文实验用水盐度为0.3~0.4,添加8 mg/L K+后,K+含量远超过了海水(盐度35)稀释至同盐度时水中K+含量(4.34 mg/L),可能对鱼卵的存活产生胁迫。朱文欢指出,当草鱼幼鱼摄入过多的K+时,会导致鱼鳃上Na-K-ATPase酶活性会受到抑制[22]。鱼类早期发育中,Na-K-ATPase酶存在于体表和卵黄囊膜上的氯细胞中进行渗透压及酸钾平衡调节[23]。K+过高可能会导致降低鱼卵的Na-K-ATPase酶的活性,进而失去调节体内渗透压能力,导致死亡。另外,鱼类摄入K+过高时会增加机体新陈代谢的负担从而导致肝细胞的受损[22]。因此,高浓度的K+也可能破坏了机体新陈代谢平衡,导致大西洋鲑鱼卵的死亡,大西洋鲑鱼卵孵化水体中K+含量不能超过9 mg/L。
Mg2+作为鱼类生长发育的必需元素,对水生生物幼苗的存活有重要影响。本文中添加5 mg/L Mg2+能显著提高大西洋鲑卵存活率。而Calta等[24]研究也得出水体中Mg2+含量从0.05 mg/L增加至0.2和2 mg/L,镜鲤受精卵的存活率升高84%。Mg2+含量低于556.67 mg/L时,花鲈受精仔鱼的生存活力会降低[26]。有研究表明,镁与鱼类的渗透压调节、抗应激能力和免疫功能等息息相关[25]。缺镁会降低大西洋鲑鳃Na-K-ATPase酶活性,过氧化物歧化酶(SOD)、过氧化氢酶的活性降低。El-Mowafi等指出,饲料中添加镁能明显提高大西洋鲑的血清溶菌酶含量和自发免疫溶血活性,提高免疫力[27]。因此,为了保证大西洋鲑卵的存活率,养殖水体中Mg2+含量要添加至15.54 mg/L。
另外,K+和Mg2+对大西洋鲑卵死亡率交互作用虽不显著,但是同时添加2种离子,会对鱼卵的存活产生不利影响,例如,本研究中同时添加了8 mg/L K+和10 mg/L Mg2+的组大西洋鲑卵死亡率最高。因此,通过添加K+和Mg2+含量提高鱼卵存活率时,要考虑到离子总含量对其影响。
对于鱼卵的孵化,王倩等[13]研究指出K+浓度为538 mg/L时,鳗鲡孵化率最高,超过或低于此浓度均会降低鳗鲡的孵化率。对于Mg2+,孙少起等[20]研究表明,水体中Mg2+浓度为25、100、200、300和400 mg/L时,鲫鱼孵化率在Mg2+为100 mg/L时最高。但本研究中添加K+和Mg2+对大西洋鲑卵孵化率的影响并不显著,可能是因为实验时间过短或是实验开始前鱼卵已具备孵化条件等原因。
3.3 K+和Mg2+对大西洋鲑仔鱼开口的影响
鲑科鱼类哲罗鱼与大麻哈鱼在发育至开口阶段之前,消化道尚未充分发育,通过内源性营养方式从卵黄囊中吸收营养(蛋白质、脂肪等)[28-30]。本实验发现添加5 mg/L Mg2+能加快大西洋鲑卵对卵黄的吸收,显著缩短发育至开口阶段的时间,并且提高了开口率。Mg2+可能在鱼卵吸收卵黄囊营养物质过程中发挥着关键作用。关海红等[28]研究了4种鱼类的卵黄吸收方式,认为肝脏参与了卵黄物质的吸收和转运。而Mg2+能够通过增强肝胰脏组织中苹果酸脱氢酶活性,降低脂蛋白酯酶活性,促进草鱼肝胰脏的脂肪合成能力,此外Mg2+还可能通过JAK-STAT和AMPK信号通路调控鱼类脂肪合成和分解代谢[31-32]。
另外,大量研究表明[28],Mg2+可能通过影响细胞膜的通透性、细胞内外渗透压、Na+/ K+-ATP 酶的活性以及其他离子的转运载体,间接地对鱼体渗透压调节产生影响。大西洋鲑鱼卵发育至开口阶段,主要由通过体表和卵黄囊膜中的氯细胞进行调节[23]。因此,Mg2+对鱼卵卵黄吸收的影响是否与渗透调节过程直接相关,还需进一步深入研究。
本文中K+对大西洋鲑仔鱼开口率和开口时间的影响并不显著,但对于开口率,K+和Mg2+存在显著的交互作用。K+也是鱼类生长发育过程中的必需元素,参与维持机体内渗透压和酸碱平衡、控制营养物质进入细胞和水代谢[33]、影响Na+/K+-ATP酶活性[34]。因此,K+和Mg2+在某些生命活动中发挥着同样重要的功能,2种离子浓度总和太高会影响鱼类的孵化和开口。
4 结语
K+添加量超过8 mg/L,可能会降低鱼卵的Na-K-ATPase酶的活性,失去调节体内渗透压能力,而且还会破坏了机体新陈代谢平衡,从而导致死亡率升高。Mg2+对大西洋鲑的早期发育存在显著影响。在大西洋鲑鱼卵阶段,添加5~10 mg/L Mg2+能显著提高大西洋鲑卵的存活率;在大西洋鲑仔鱼阶段,Mg2+可能参与了卵黄吸收过程以及渗透调节,其对大西洋鲑仔鱼的开口时间和开口率均有显著影响。因此,日照地下水中Mg2+含量偏低,不利于大西洋鲑卵的孵化,Mg2+添加至15.54 mg/L比较有利于大西洋鲑卵的发育。K+与Mg2+存在显著的交互作用,K+应适量添加,不宜超过8 mg/L。

