2型糖尿病患者促甲状腺激素与骨质疏松关系的研究
张利红 杨文娟 田竹芳 李恒*
1.西安市中心医院内分泌科,陕西 西安 710003 2. 延安大学医学院,陕西 延安 716000
随着社会的发展,人口老龄化的到来,2型糖尿病的发病率逐年提高,2型糖尿病合并骨质疏松也也越来越受到关注[1-2]。多项研究表明,糖尿病是骨质疏松的独立危险因素之一[3-5]。 2型糖尿病对骨质疏松的影响是多因素的,糖尿病患者的内分泌系统和代谢发生诸多变换,代谢产物或其他局部发生改变的物质通过多种信号途径直接或间接影响骨质疏松的发生和发展。而促甲状腺激素(TSH)作为一种激素参与了多种内分泌疾病的发生及发展,多项研究表明,TSH水平与骨代谢有非常密切的关系[6-8]。而在2型糖尿病患者中,关于TSH对骨代谢影响的研究却鲜有报道,本研究以此为出发点,试图探索2型糖尿病中骨质疏松与TSH的关系,为患者临床治疗提供可能的证据。
1 对象与方法
1.1 对象
选取2017年1月至2018年5月于我院内分泌科收住的甲状腺功能正常的2型糖尿病患者151例(男性79例、女性72例),年龄52-84岁,女性均已绝经。其中骨质疏松58例(其中男性26例,女性32例),非骨质疏松93例。患者基本资料见表1。
1.2 方法
1.2.1临床资料:入组者测量身高(m)、体重(kg),计算体重指数体重/身高2(BMI)。
1.2.2生化指标测定:入组者于清晨6时抽取空腹静脉血。糖化血红蛋白(HbA1c):使用色谱法测定(美国伯乐公司D10);游离T3(FT3)、游离T4(FT4)、促甲状腺素(TSH)、甲状旁腺素(PTH)、维生素D(VitD)使用电化学发光法测定(德国西门子公司电化学发光仪E601),甲状腺功能正常值:FT3 3.1-6.8pmol/L,FT4 12-22pmol/L,TSH 0.27-4.7μIU/mL,维生素D正常值:≥30ng/mL;PTH正常值:15-65pg/mL。血脂(总胆固醇TC,甘油三酯TG,高密度脂蛋白HDL、低密度脂蛋白LDL)、肾功(血尿素氮BUN,肌酐Cr)采用美国Beckman AU5800全自动生化分析仪测定;骨代谢指标(I型前胶原N端肽P1NP、血I型胶原羧基端降解产物β-cross)试剂盒购自美国RD公司,使用ELISA法测定。以上仪器均由具备资质的固定人员操作并定期对仪器进行质检。
1.2.3骨密度测定:美国HOLOGIC公司生产的Discovery双能X射线骨密度仪(DEXA),腰椎(L1-L4)及股骨颈的骨密度值,以骨矿面密度(g/cm2)表示,软件自动分析得出T值。仪器由专业人员操控,每日进行质控。
1.3 诊断标准
糖尿病的诊断标准参照1999年WHO糖尿病诊断标准;症状+随机血糖≥11.1 mmol/L,或空腹血糖≥7.0 mmol/L,或OGTT中2 h 血浆葡萄糖≥11.1 mmol/L;症状不典型者,需另一天再次证实。
骨质疏松的诊断标准:参照2011年世界卫生组织推荐的骨质疏松诊断标准:骨密度(BMD)用T值表示,腰椎(L1-L4)及股骨颈任一部位T值≤-2.5为骨质疏松,T值>-2.5为非骨质疏松,包括正常骨密度和骨量减少。
排除标准:1型糖尿病、既往甲状腺疾病及服用影响甲状腺功能药物史、孕妇及哺乳期患者及近期有严重感染、手术、外伤及严重心、肝、肾功能不全的患者,严重脑血管疾病后遗症者,合并甲状旁腺疾病者,恶性肿瘤患者,长期卧床者,服用影响骨代谢的药物者(如糖皮质激素、维生素D及其衍生物、钙、双膦酸盐等)。
1.4 统计学方法

2 结果
2.1 不同性别组中骨质疏松组与非骨质疏松组相关临床指标及骨代谢相关指标的差异
不同性别的2型糖尿病患者,根据有无骨质疏松分组,比较两组间的年龄、病程、BMI、甲功、肾功、血脂、HbA1C、PTH、β-Cross、P1NP、VitD等指标之间的差异,如表1所示,在男性患者中,FT3在骨质疏松中与非骨质疏松组存在差异(P<0.05),而在女性中,发现在两组间BMI、TG、TSH存在显著性差异(P<0.05)。
2.2 2型糖尿病患者中股骨颈及腰椎骨密度与各临床指标之间的相关性
Pearson相关分析结果提示,男性组股骨颈BMD与年龄呈负相关、与BMI、β-cross呈正相关(P<0.05),腰椎BMD与各临床指标间无明显相关性;女性组腰椎及股骨颈BMD均与TSH呈负相关,股骨颈BMD与年龄呈负相关,与BMI正相关(P<0.05),详见表2,表3。
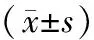
Table1Comparison of clinical data between osteoporosis and non-osteoporosis group of patients with type 2 diabetes mellitus (mean ± SD)

OP男(79) 女(72)No(53,67.1%)Yes(26,32.9%)PNo(40,55.6%)Yes(32,44.4%) P年龄(岁)60.43±7.5562.5±10.280.315 60.38±10.8865.09±9.050.053 病程(年)6.66±7.267.02±5.360.826 8.07±7.726.49±5.380.310 BMI(Kg/m2)24.55±2.8624.26±3.160.683 24.86±4.1222.75±2.720.011∗ HbA1C(%)8.72±2.259.28±2.390.314 8.73±2.528.73±2.161.000 FT3(pmol/L)4.96±0.794.54±0.540.016∗ 4.41±0.674.4±0.510.926 FT4(pmol/L)17.05±2.2416.82±2.450.679 16.89±2.3415.96±1.60.058 TSH(μIU/mL)2.4±1.082.38±0.920.963 2.96±1.364.06±1.990.010∗ BUN(μmol/L)5.53±1.45.84±1.630.389 5.61±1.995.18±1.980.358 Cr(μmol/L)63.36±16.6468.42±20.160.240 53.26±18.8651.31±14.720.636 TC(mmol/L)4.25±0.884.51±1.210.326 4.61±1.144.64±1.040.911 TG(mmol/L)2.55±2.531.78±1.080.062 2.28±1.351.69±0.820.032∗ HDL(mmol/L)1.06±0.221.12±0.230.238 1.2±0.251.27±0.230.244 LDL(mmol/L)2.37±0.742.64±0.950.164 2.76±1.042.77±1.050.967 PTH(pg/mL)47.36±15.7345.55±29.050.790 41.13±13.2538.88±18.220.626 β-cross(ng/mL)0.37±0.200.31±0.20.401 0.41±0.231.22±3.530.265 P1NP(ng/mL)33.01±8.7839.72±15.960.078 41.08±14.2257.59±40.840.078 VitD(ng/mL)14.2±9.1614.58±6.520.896 13.68±8.4112.25±7.100.544
*P<0.05。

表2 腰椎骨密度与各临床指标的相关性Table 2 Correlation between bone mineral density of the lumbar spine and clinical indicators
*P<0.05。

表3 股骨颈骨密度与各临床指标的相关性Table 3 Correlation between bone mineral density of the femoral neck and clinical indicators
**P<0.01,*P<0.05。
2.3 2型糖尿病中OP危险因素的多因素logistic回归分析
以是否OP为因变量,筛选出年龄、BMI、TSH、PTH、PINP、β-cross为自变量进行logistic回归分析,发现在男性中,P1NP较高者骨质疏松发生风险增加(OR=1.122,P=0.013);女性中,BMI较高者骨质疏松发生风险小(OR=0.796,P=0.048),TSH、P1NP较高者骨质疏松发生风增加(OR=2.581,P=0.014;OR=1.052,P=0.039)。详见表4。
3 讨论
随着糖尿病发病率的升高,糖尿病患者中骨质疏松的发生也越来越受到重视。目前骨质疏松及骨折已成为糖尿病患者的一个严重的并发症,研究表明,女性糖尿病患者绝经后骨质疏松发生比例高于非糖尿病者,且年轻的糖尿病患者骨质疏松的发生也并不少见[9]。

表4 2型糖尿病患者中骨质疏松危险因素的多因素logistic回归分析Table 4 Multivariate logistic regression analysis of risk factors for osteoporosis in patients with type 2 diabetes mellitus
*P<0.05。
糖尿病患者骨质疏松的原因复杂,目前已知的有胰岛素生长因子-1(insulin—like growth factor 1, IGF-1)和硬骨素(sclerostin);高血糖和糖基化代谢产物AGEs;血清甲状旁腺激素(PTH)和骨钙素 (osteocalcin,OC);还有降糖药物对T2DM骨代谢的影响。
近年的研究表明,促甲状腺激素与骨质疏松的关系密切,TSH 通过与细胞膜上7 次跨膜 G 蛋白耦联受体-TSH 受体(TSH receptor, TSHR)结合,发挥促进甲状腺滤泡生长、甲状腺激素合成及分泌的作用。TSHR 主要表达于甲状腺滤泡细胞,但其在成骨细胞、破骨细胞、肾脏、脑组织、心脏、睾丸、淋巴细胞以及脂肪细胞中亦有表达[10-12]。关于甲状腺功能亢进症引起骨质疏松的研究较多,其机制也较复杂[13-15]。也有研究显示,患有亚临床甲亢或亚临床甲减的老年男性髋部骨折风险会增加[16]。我国学者梁利波等[17]研究发现,与同年龄健康组相比,亚临床甲减患者的骨量丢失升高、血钙浓度降低。甲减可累及骨代谢,导致骨转换减慢,骨折风险性增加[18]。而2型糖尿病中骨质疏松发生率高,关于TSH与其相关性的研究却相对较少。
本研究中女性患者无论是腰椎还是股骨颈BMD均与TSH呈负相关,说明随着TSH的升高,BMD是下降的,而Logistic回归分析提示TSH水平升高是骨质疏松的危险因素,对于甲功正常的绝经期女性来说,TSH每升高1μIU/mL,骨质疏松发生的概率升高了2.58倍,而这在男性中表现并不明显。考虑原因有以下几点:1. TSH通过与破骨细胞或成骨细胞上的TSHR结合,引起破骨作用与成骨作用之间的失衡,导致了骨量减少乃至骨质疏松的发生。而在该过程中,TSHR的突变可以引起TSHR的自身激活,也可能是造成骨量减少乃至骨质疏松的原因[19],而有研究显示,肥胖组大鼠TSHR在睾周脂肪及甲状腺组织的表达显著高于对照组[20],其可能也参与了胰岛素抵抗,而在女性2型糖尿病患者中,成骨细胞及破骨细胞上的TSHR水平是否与男性有所不同及其是否存在突变有待于进一步研究。2.绝经期女性TSH水平的升高与雌激素的降低有关,雌激素可增加甲状腺结合球蛋白水平进而影响甲状腺功能[21],我国学者梁君慧等[22]的研究也提示绝经期女性TSH水平升高。近期也有研究表明,对切除卵巢的大鼠给予不同性激素干预后,其子宫TSHR的表达差异明显,进而影响了TSH及甲状腺激素水平[23]。而对于绝经期女性来说,TSHR水平可能也是和性激素水平密切相关的,从而影响了骨代谢水平。3.研究表明,TSH对甲状腺细胞的作用大部分是通过G蛋白-腺苷酸环化酶-cAMP系统起作用的,而此过程受到细胞内钙离子浓度的影响[24]。维生素D缺乏时钙离子通道关闭,导致细胞内钙离子浓度变化,影响TSH的信号通路[25],垂体代偿性地分泌更多的TSH。我国学者刘佳等认为,在2型糖尿病中,血清维生素D水平与TSH水平呈负相关[26],这与我们的研究结果是一致的(虽无统计学差异,但骨质疏松组TSH水平高,而维生素D水平较低)。
本研究中,Pearson相关分析结果显示,在不同性别中高龄及低BMI均与股骨颈BMD显著相关,既往对于老年男性2型糖尿病骨质疏松的研究中,发现高龄、长病程、高血糖及低BMI是其危险因素[27],其中年龄、BMI与BMD的关系与我们的研究结果一致,我们的结果中病程、高血糖等未见显著性差异,这可能与我们纳入的病例相对较少有关。多因素回归分析提示P1NP升高增加骨质疏松发生风险,说明老年2型糖尿病中骨质疏松患者骨形成是增强的,呈高转换状态,这可能与我们所入组的患者的年龄有关,既往的研究证明,高转换型骨质疏松年龄在50-70岁,而低转换型骨质疏松年龄更大,多在70岁以上[28]。
综上所述,2型糖尿病患者中,随着年龄的增长和BMI的降低骨质疏松发生的风险增高; 2型糖尿病中50岁以上男性及绝经期女性呈高转换型骨质疏松;TSH参与了绝经期女性骨质疏松的发生,其机制可能与TSHR表达异常、低雌激素水平、低维生素D水平有关。对于绝经期女性应行TSH及骨密度检测,评估骨质疏松的风险,必要时给予相应治疗。

