IL-6对RAW264.7细胞成熟分化的体外实验研究
王信 张怡 陈萍 季文军 马亚萍 敖俊,* 张军,*
1. 遵义医学院附属医院骨科,贵州 遵义 563000 2. 遵义医学院公共卫生学院,贵州 遵义 563000 3. 遵义医学院-罗切斯特大学骨科研究中心,贵州 遵义 563000
白介素-6(Interleukin-6,IL-6)作为一种多功能细胞因子,在人体内含量甚微,对骨代谢的调节具有双重作用:既可以通过结合IL-6特异性受体,激活Ras/Raf/MEK/ERK、JAK/STAT3、PI3K等信号通路发挥破骨效应;又可以促进成骨细胞中碱性磷酸酶、骨钙素等表达,从而加强骨基质的矿化形成[1]。在我们前期实验中,已经证实了100 ng/mL骨保护素(Osteoprotegerin,OPG)和IL-6联合抑制小鼠单核-巨噬细胞的成熟和分化[2]。本次实验旨在研究不同浓度的IL-6因子直接对破骨细胞分化和破骨功能的影响是否存在浓度依赖性,从而为今后防治骨质疏松症提供一定的实验基础。
1 方法和材料
1.1 主要试剂
实验选用小鼠单核/巨噬细胞系RAW264.7细胞由重庆医科大学附属第一医院骨科惠赠;小鼠重组sRANKL购于美国PeproTech公司,用无菌PBS溶液将其配制为工作浓度为50 ng/mL的溶液;IL-6试剂购于PeproTech公司,使用时用无菌PBS溶液将其稀释成工作浓度为50 ng/mL、100 ng/mL、150 ng/mL的液体。胎牛血清购于美国GIBCO公司;DEME高糖培养基购于美国GIBCO公司;TRAP染色试剂盒购于美国Simga公司。
1.2 实验方法
1.2.1RAW264.7细胞培养
将RAW264.7细胞培养于含10%胎牛血清(FBS)的高糖DMEM培养基,温度控制于37 ℃,含有5% CO2的培养箱中培养,常规换液。取出细胞种植入无菌六孔板中,单用50 ng/mL RANKL干预RAW264.7细胞1 d后,分为4组,1空白对照组(1 mL 50 ng/mL RANKL + PBS 1 mL)、2低浓度IL-6组(1 mL 50 ng/mL RANKL + 1 mL 50 ng/mL IL-6)、3中浓度IL-6组(1 mL 50 ng/mL RANKL + 1 mL 100 ng/mL IL-6)、4高浓度IL-6组(1 mL 50 ng/mL RANKL + 1 mL 150 ng/mL IL-6)。分别向各组中加入1 mL DMEM培养基,连续培养至第9天,进行如下实验:
1.2.2HE染色
盖玻片经浓硫酸过夜浸泡、冲洗并消毒处理后,放置于6孔板中,待上述细胞完成80%以上的细胞爬片后,进行HE组织染色,,每组选用3个盖玻片进行观察成熟破骨细胞的染色情况,每个盖玻片采集5个不同的视野。采用光镜下测量成熟破骨细胞生成数,主要是根据破骨细胞核的多核细胞(超过3个细胞核)形成数量来判定成熟破骨细胞生成量。
1.2.3TRAP特异性染色
细胞如同上述方法处理,参照试剂盒说明书进行TRAP染色,经过TRAP染色后,成熟破骨细胞胞浆被染成典型的玫瑰红,细胞核则会被苏木精染成深蓝或蓝紫色。通过倒置显微镜下采集图像后,经图像分析软件测量玫瑰红色细胞浆在每个高倍镜视野下所占的累计面积,每组分别采集3个标本,每个标本采集5个不同的视野,求得平均值,计算其占视野面积的百分比。
1.2.4骨片扫描电镜检查
取新鲜小鼠颅骨,制成面积为1 cm×1 cm,厚度约65 μm左右的薄骨片,清洗4-5次/20 min,用以去除多余的软组织。然后,将其置于4 ℃冰箱保存。使用前取出浸泡在75%酒精过夜后,并暴露在紫外线照射8 h以上。以1×107个/孔接种RAW264.7细胞于每个薄骨片上,予以50 ng/mL RANKL干预1 d后,如上述方法继续用不同浓度的IL-6刺激和培养9 d,无菌PBS冲洗,戊二醛和锇酸双固定后、酒精梯度脱水,CO2真空干燥,镀金,扫描电镜观察骨吸收陷窝形成情况。采用图像分析软件对上述各组骨吸收陷窝面积进行计算,统计各组3个标本,每个标本5个不同视野进行陷窝面积的计算,求得平均值,计算其占视野面积的百分比。
1.2.5统计学分析
图像采集Leica(FX-BUSRS232C)显微镜、Nikon倒置荧光显微镜,图像分析利用Image Pro-Plus 6.0软件,统计应用SPSS 10.0版软件,组间比较应用方差分析的方法,P值<0.05判断为差异有显著性。数据表达均使用均数±标准误差形式。
2 结 果
2.1 HE染色结果
空白对照组中的破骨细胞,在RANKL的刺激下细胞胞体明显增大,胞质丰富,可见细胞间融合现象,有典型多核形成表现。低浓度IL-6组中仍可见少许成熟破骨细胞形成,并随着浓度的增高,多核形成不明显(如图1)。经过光镜计数,成熟破骨细胞生成数量结果如下:空白对照组152.50±35.24;IL-6组中分别为 120.8±18.89、66.5±17.23、35.25±19.0。中和高浓度IL-6组明显少于对照组(P<0.05)。

图1 HE染色下各组破骨细胞的形态学变化A:空白对照组 B:50 ng/mL IL-6组 C:100 ng/mL IL-6组 D:150 ng/mL IL-6组Fig.1 The morphological changes of osteoclast cells in HE staining (×200)A: Control group; B: 50 ng/mL IL-6 group; C: 100 ng/mL IL-6 group; D: 150 ng/mL IL-6 group
2.2 TRAP染色结果
50ng/mL RANKL处理的空白对照组,胞质染色明显较深,阳性染色面积区域大;低和中浓度IL-6组偶见阳性染色区域,且面积较小和少,仅可见少许粉红色区域;高浓度IL-6组中,染色更浅,比较难找到阳性染色区域(如图2)。通过倒置相差显微镜采集图像,经图像分析软件测量其区域面积,空白对照组、低浓度IL-6组、中浓度IL-6组和高浓度IL-6组TRAP染色阳性区域与视野面积百分比分别为(12.63±1.28)%、(10.98±0.99)%、(4.69±0.79)%、(2.26±0.83)%,可见,IL-6浓度超过50ng/mL后,中、高处理组和空白对照组的染色面积差异显著(P<0.05)。
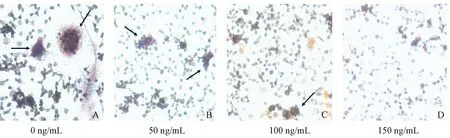
图2 TRAP染色下各组破骨细胞的成熟分化情况A:空白对照组 B:50 ng/mL IL-6组 C:100 ng/mL IL-6组 D:150 ng/mL IL-6组Fig.2 Assessment of osteoclastic differentiation and maturation with TRAP staining (×200)A: Control group; B: 50ng/mL IL-6 group; C: 100ng/mL IL-6 group; D: 150ng/mL IL-6 group
2.3 骨片扫描电镜观察
扫描电镜观察,明显可见骨陷窝形态及大小均不一,状如圆形、椭圆形或不规则形。空白对照组中骨片上可见散在、分布不均的因破骨细胞的骨吸收作用引起的骨陷窝,钙质丢失较多,有的形成空洞征象;低浓度IL-6组中骨质破坏明显减轻,仍可见破骨细胞的伪足和少许空洞形成;中浓度IL-6组中,破骨细胞伪足形成不明显,未见明显空洞形成,但可见微小的凹陷形成;高浓度的IL-6组中骨质较完整,未见明显的骨陷窝形成和骨质破坏(如图3)。扫描电镜下采集图像,经图像分析软件计算和分析陷窝面积,空白对照组、IL-6组和联合组的骨吸收区域与视野面积的百分比分别为:(11.24±1.50)%,(9.41±1.71)%、(3.65±1.04)%、(2.39±0.71)%。由此可见,中、高IL-6处理组和空白对照组间存在明显差异(P<0.05),而低浓度IL-6组和中高浓度IL-6组之间的吸收面积之间也存在显著性差异(P<0.05)。

图3 扫描电镜下各组骨陷窝形成情况A:空白对照组 B:50 ng/mL IL-6组 C:100 ng/mL IL-6组 D:150 ng/mL IL-6组Fig.3 Evaluation of bone graft resorption using SEM (×800)A: Control group; B: 50 ng/mL IL-6 group; C: 100 ng/mL IL-6 group; D: 150 ng/mL IL-6 group
3 讨 论
成骨细胞所介导的骨形成和破骨细胞所介导的骨吸收紧密相联,而这动态平衡一旦失衡往往导致骨代谢性疾病的发生,如OP[3]。破骨细胞是由单核/巨噬细胞的前体细胞(又称为破骨前体细胞,Osteoclast precursors,OCP)分化而来,其正常成熟分化的条件必须具备c-Fms和RANK两种受体[4]。然而,由OCP转化为成熟破骨细胞的过程是一个复杂的多细胞间通过信号通路交互对话的过程[5]。一直以来,由基质/成骨细胞释放的RANKL因子被公认为调节OC分化、激活、成熟、凋亡等一系列过程最重要的因子之一[6]。本实验使用的破骨样细胞RAW264.7细胞,是一种经典的破骨前体细胞模型[7-8]。
在正常生理情况下,骨基质细胞和成骨细胞除了分泌RANKL,还能分泌OPG来和RANKL竞争结合位点,从而抑制骨质的过度吸收[9, 10]。实验证明,OPG能有效地抑制破骨细胞的激活、分化,并诱导其发生凋亡[11-12]。所以,OPG/RANKL的比例多少在维持骨量平衡和调控骨重建过程,起着极为重要的作用。通过联合运用OPG和IL-6,发现两者存在一定的协同作用,较单独运用OPG组更能有效地抑制RAW264.7细胞的成熟分化(P<0.05)[2]。
IL-6是由T细胞、B细胞、单核细胞、基质细胞/成骨细胞激活后分泌,它是一个分子家族的原型。该家族包括:ILF、OSM、CT-1、IL-11和CNTF等,它们都有一个极其相似的螺旋结构[13]。IL-6的生物学活性需要通过其受体介导,IL-6受体是由IL-6的特异受体结构链(IL-6R α)和IL-6的信号传递链(IL-6R β,亦称gp130)组成[14]。IL-6只有先与IL-6R α相结合,并形成IL-6/ IL-6R α复合物后才能与gp130结合,进而激活Ras/Raf/ERK/MEK、JAK/STAT3等信号传导通路而发挥生物效应[15]。Laurence等证明:单独加入IL-6对破骨细胞的分化未见明显影响,但IL-6可以在分化早期(小于3天)以剂量依赖方式明显抑制外源性RANKL诱导的破骨细胞分化[16]。IL-6能刺激成骨细胞产生大量的下游信号分子,如IL-1、PGE2等等,抑制OPG的表达,促进RANKL的表达,进而间接促进破骨细胞形成并加强破骨活动[17],IL-6又能通过抑制NF-κB信号通路的激活,从而直接抑制破骨细胞的成熟分化和骨吸收作用[18],这与本研究结果相一致。
本实验采用RAW264.7细胞作为破骨前体细胞,在体外给与不同浓度的IL-6因子进行干预,当浓度超过50 ng/mL时,连续作用至第10天时,可以观察到明显的抑制作用。空白对照组和IL-6处理组进行比较,成熟破骨细胞的生成数量和骨陷窝形成的数量进行统计学分析后,均有显著的统计学意义,且它们存在一定的剂量-效应依赖关系。然而,IL-6如何参与到抑制破骨细胞分化的分子机制,还需要在进一步实验去研究IL-6和RANKL之间的相互作用关系。

