电针对去卵巢大鼠Wnt3a和β-catenin的基因及蛋白表达的影响
王亚军 张来举 浪万英 宋亚文 宋凯
甘肃中医药大学针灸推拿学院,甘肃 兰州 730000
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是随着年龄的增长或妇女绝经后,由成骨细胞和破骨细胞承担的骨形成活动和骨吸收活动之间的平衡被打破,骨吸收超过骨形成而引起的以骨量减少、骨强度降低、骨脆性增加为特征,并伴随骨组织显微结构退化的全身代谢性骨病[1-3]。PMOP早期无明显症状,故不会引起患者的注意,是一种易被人们忽视的隐性、慢性的流行性疾病[4-5],随着社会的老龄化,PMOP发病率和骨折率呈上升趋势,本疾病引起的骨痛、骨骼变形及并发症严重影响老年人的身体健康和生活质量,PMOP的危害及防治已成为当今热点问题之一[6]。以往,研究者认为绝经后骨质疏松症的首要原因是由于雌激素水平的下降[7-8],但近年来已有越来越多的实验研究结果表明,骨免疫异常、慢性炎性反应、骨髓微循环障碍以及氧化应激等也可导致PMOP,提示PMOP的发病机制是多靶点、多因素、多维度的,不再单纯以雌激素为中心,最终,无论何种机制都是通过影响成骨细胞和破骨细胞的来源、分化增殖、凋亡及其功能而实现的。然而,任何干预手段最终均通过调节相关的信号传导通路发挥治疗作用,针灸疗法亦如此[9]。近年来,针灸疗法在治疗PMOP的临床和实验研究中取得了一定进展,并以其安全简便、无不良反应和疗效显著等优点而日益受到重视,但在疗效评价和治疗机制方面仍存在许多未解决的问题[10-11]。本实验通过观察电针对去卵巢骨质疏松模型大鼠Wnt3a和β-catenin的蛋白及基因表达的影响,探讨针刺干预后Wntβ-catenin信号传导通路的变化规律,阐明针刺是否通过调节这一信号通路系统达到治疗的目的,以期从分子水平揭示针刺对PMOP的治疗机制,为针灸治疗PMOP的临床应用提供科学实验依据。
1 材料与方法
1.1 实验动物及分组
选取60只SPF级雌性SD大鼠,日龄60 d左右,体质量180 g~220 g,饲养温度(22±2)℃,湿度50%~70%,饮用纯净水,食用标准鼠类饲料,由甘肃中医药大学科研动物实验中心提供[许可证号:SCXK(甘)2011-0001],实验动物质量合格证编号:62001000000276。按随机数字表法分为空白组、假手术组、模型组、药物组、针刺组,各12只。
1.2 主要仪器、试剂、针具及药物
实时荧光定量PCR仪(ABI,美国);相差显微镜(OLYMPUS,日本);锯式切片机(Leica公司,德国);Wnt3a一抗(Abcam,美国);Beta-catenin(Abcam,美国);免疫组织化学染色二抗试剂盒(博士德公司);Total RNA提取试剂盒、Prime ScriptTM reagent逆转录试剂盒、Prime Ex TapTM ⅡPCR 试剂盒均购自TakaRa公司;引物由大连宝生物公司设计并合成;戊酸雌二醇片(拜耳医药保健有限公司,生产批号:199A3);水合氯醛(保定市凌业商贸有限公司,生产批号:G3045);针灸针(Ф0.35×13 mm,苏州华佗医疗器械有限公司生产);电针仪(上海华谊医用仪器有限公司,型号SDZ-Ⅱ)。
1.3 实验方法
1.3.1骨质疏松模型建立:按照文献[12]方法造模:将模型组、药物组、针刺组大鼠以10%水合氯醛溶液(0.3 mL/100 g)腹腔注射麻醉,腹位固定,在其最末肋骨下,腋中线与距脊柱外侧约1 cm交叉处备皮、消毒,切开皮肤约1~1.5 cm,依次切开肌肉,剪开腹膜进入腹腔,用小镊子轻轻将白色发亮脂肪团拉出切口外,分离脂肪团,便可见到粉色菜花样卵巢,先将卵巢下端输卵管用丝线结扎,然后摘除双侧卵巢,观察无异常后,切口分层缝合,外部敷以消炎粉。空白组不做任何处理,假手术组只暴露双侧卵巢但不切除。造模后饲养13周,经骨密度和骨矿物含量检测,结果显示骨质疏松模型建立成功,见表1。
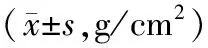

分组nBMDBMC空白组120.176±0.00919.38±0.031模型组120.151±0.011∗17.83±0.026▲
注:与空白组比较:*P<0.05;▲P<0.05,差异具有统计学意义。
Note: Compared with the blank group,*P<0.05,▲P<0.05.
1.3.2干预方法:针刺组选取“肾俞”、“脾俞”、“三阴交”、“足三里”,穴位定位参照《实验针灸学》[13]类比取穴,将大鼠穴位局部剪去鼠毛,穴位和针具常规消毒后,用0.35×13 mm不锈钢毫针快速刺入皮下一定深度,接入电针仪,频率为2 Hz,断续波,刺激强度1.0mA,以局部见肌肉轻微收缩为佳[14-15],每次电针刺激15 min,1次/1 d,连续治疗5 d,间隔2 d,20 d为1个疗程,治疗3个疗程,同时灌服与药物组相同体积的蒸馏水;药物组大鼠给予1 mL/100 g体质量的0.02 mg/mL戊酸雌二醇水溶液灌胃(给药剂量按照大鼠体表面积比值折算而成)[12,16],疗程同针刺组;空白组不予处理,常规饲养;假手术组和模型组大鼠灌服与药物组相同体积的蒸馏水,疗程同针刺组。各组大鼠每周称重1次,以此调整给药剂量。治疗期满3个疗程后采用10%水合氯醛溶液腹腔注射麻醉并处死各组大鼠,分离出股骨和胫骨,剥除附着的软组织,用经生理盐水浸透的医用纱布包裹左侧胫骨和右侧股骨,放置于-20 ℃冰箱中保存待用。
1.4 指标检测与方法
1.4.1RT-PCR分析法检测Wnt3a和β-catenin mRNA表达:(1)总RNA提取:将新鲜的右侧股骨加入液氮,研磨至粉末后,家兔Trizol裂解液室温放置5~10 min使细胞充分裂解后,加入250 μL预冷过的氯仿,盖上离心管盖,用手剧烈震荡20 s后室温放置5 min左右,12000rpm 4 ℃离心15 min,此时样品分为三层,取最上一层上清液(注意别吸到蛋白层),加入400 μL异丙醇,轻轻上下颠倒混匀15次,室温放置30 min左右。12000 rpm 4 ℃ 离心15 min,得到白色沉淀,弃上清后沿离心管壁加入75%的乙醇1 mL进行沉淀的清洗,12000 rpm 4 ℃离心5 min。弃上清,室温干燥沉淀2~5 min后溶解沉淀,紫外分光光度计检测所提取的RNA溶液在260 nm、280 nm、320 nm的吸光值,计算RNA纯度及浓度。
(2)总mRNA的逆转录:逆转录过程根据Prime ScriptTM reagent逆转录试剂盒操作说明书进行,PCR扩增体系为1步PCR,37℃15 min,最后85℃5 s使酶变性失活,然后4 ℃保存10 min。引物的设计与合成由宝生物(大连)公司完成。
Wnt3a: F 5’-AAAGCACGGTGTTGGG -3’;R 5’-CAGAGGATTCGGGATC -3’
β-catenin: F 5’-CGGTTAGAAGGGGTTA-3’;R 5’-GACGGTCTCGGTGTGT-3’
GAPDH:F 5’-TATCGGACGCCTGGTTAC-3’;R 5’-CTGTGCCGTTGA ACTTGC-3’
(3)PCR检测:实时荧光定量PCR过程按照TakaRa Prime Ex TapTM ⅡPCR 试剂盒操作说明进行。PCR反应条件:第一步95 ℃预变性30 s;第二步95 ℃变性5 s,第三步60 ℃退火40个循环,每个循环31 s,最后进行溶解阶段。所有结果经GAPDH内参校正后,ΔΔCt法计算最终结果并采用2-ΔΔCt表示。
1.4.2免疫组化法检测Wnt3a和β-catenin 蛋白表达
(1)切片:将新鲜冻存的左侧胫骨置于饱和EDTA溶液中进行脱钙,20天后,检测脱钙效果;将脱钙后的骨组织进行脱水,石蜡包埋后,切片,组织厚度不超过50 μM;将制备好的切片进行脱蜡至水;沸水浴5 min进行抗原修复;透膜:加入0.02% TritonX-100 10 min,PBS清洗3次,5 min/次。
(2)免疫组织化学染色:封闭:PBS清洗3次,5 min/次,加入3%H2O210 min,PBS清洗3次,5 min/次,加入5% 胎牛血清(FBS)封闭1 h;孵育一抗:吸掉FBS,加入一抗,4 ℃过夜;孵育二抗:PBS清洗3次,5 min/次,加入二抗,37 ℃培养箱孵育0.5 h;PBS清洗3次,5 min/次,加入SABC 37 ℃ 培养箱孵育0.5 h;显色:PBS清洗2次,5 min/次,加入DAB显色剂,显色1~5 min,出现棕黄色即可;复染:蒸馏水清洗2次,5 min/次,苏木素复染1 min,蒸馏水漂洗,加入盐酸酒精,立即洗掉,蒸馏水清洗15 min;脱水封片:分别浸入80%乙醇、95%乙醇、100%乙醇、二甲苯各1 min,脱水,树脂封片至干净载玻片,光学显微镜下观察。
1.5 统计学方法

2 结果
2.1 各组大鼠股骨Wnt3a mRNA表达水平
如图1所示,模型组Wnt3a mRNA表达量最低,与空白组和假手术组比较差异有统计学意义(P<0.05);经药物或针刺干预后,Wnt3a mRNA表达显著升高,与模型组比较差异具有统计学意义(P<0.05)。
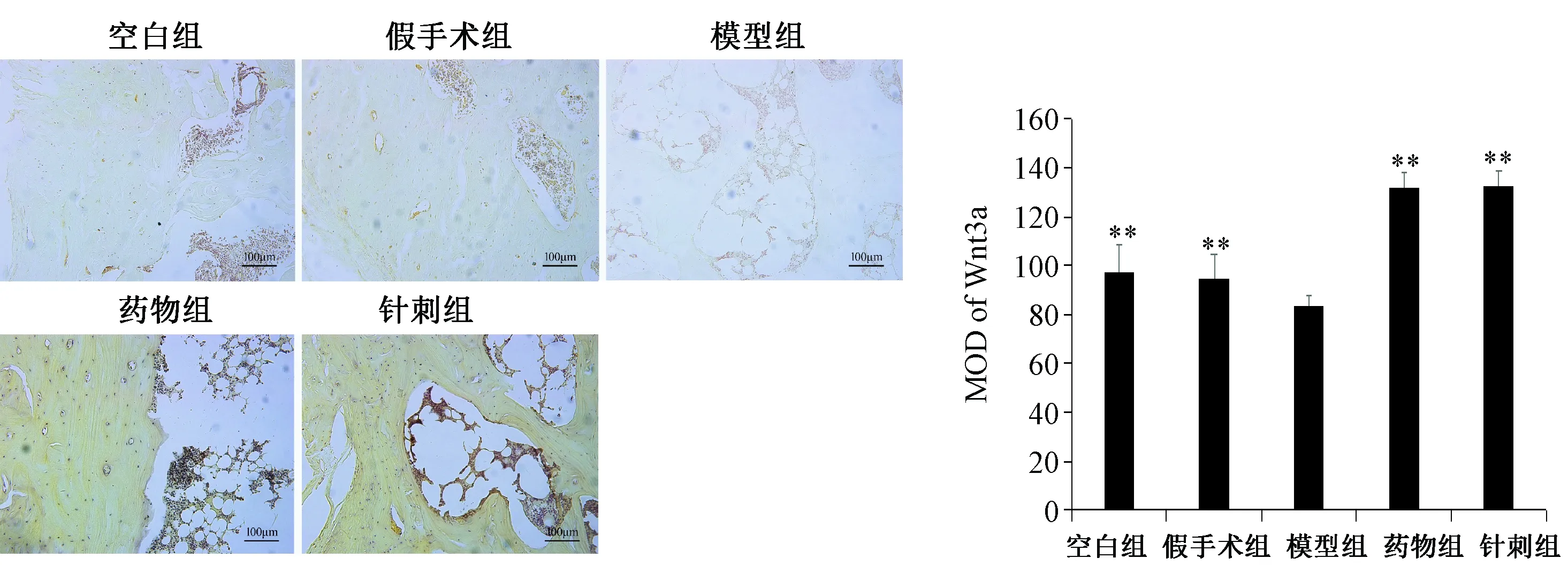
图3 各组大鼠Wnt3a 蛋白表达与模型组比较,**P<0.05Fig.3 Protein expression of Wnt3a in each group Compared with model group,**P<0.05

图1 各组大鼠Wnt3a mRNA相对表达量与模型组比较,**P<0.05Fig.1 The relative mRNA expression of Wnt3a in each group Compared with model group,**P<0.05
2.2 各组大鼠股骨β-catenin mRNA表达水平
如图2所示,模型组β-catenin mRNA表达量最低,与空白组和假手术组比较差异有统计学意义(P<0.05);经药物或针刺干预后,β-catenin mRNA表达显著升高,与模型组比较差异具有统计学意义(P<0.05)。
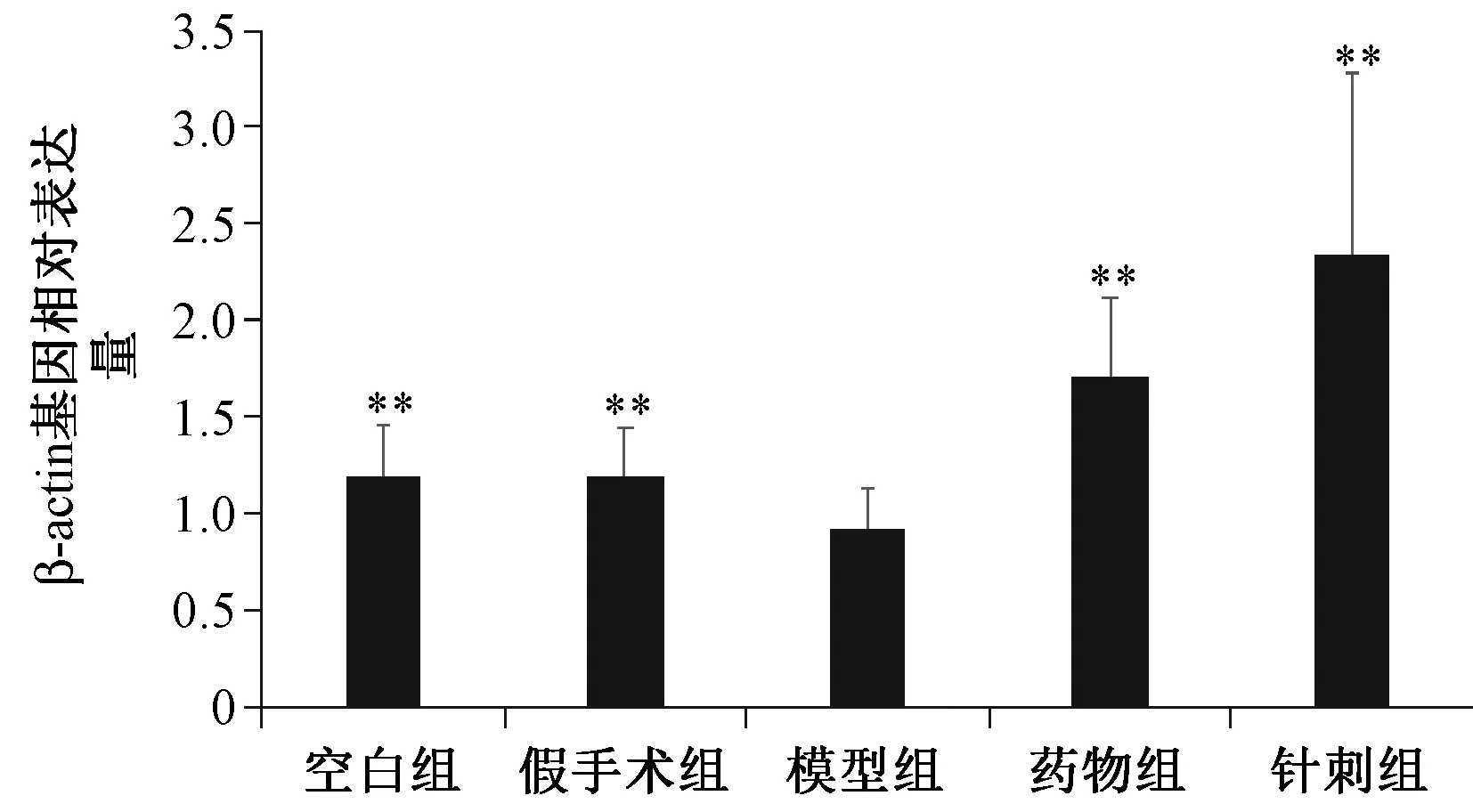
图2 各组大鼠β-catenin mRNA相对表达量与模型组比较,**P<0.05Fig.2 The relative mRNA expression of β-catenin in each group Compared with model group,**P<0.05
2.3 各组大鼠胫骨Wnt3a 蛋白表达水平
如图3所示,模型组Wnt3a 蛋白表达量最低,与空白组和假手术组比较差异有统计学意义(P<0.05);经药物或针刺干预后,Wnt3a 蛋白表达显著升高,与模型组比较差异具有统计学意义(P<0.05)。
2.4 各组大鼠胫骨β-catenin蛋白表达水平
如图4所示,模型组β-catenin蛋白表达量最低,与空白组和假手术组比较差异有统计学意义(P<0.05);经药物或针刺干预后,β-catenin蛋白蛋白表达显著升高,与模型组比较差异具有统计学意义(P<0.05)。
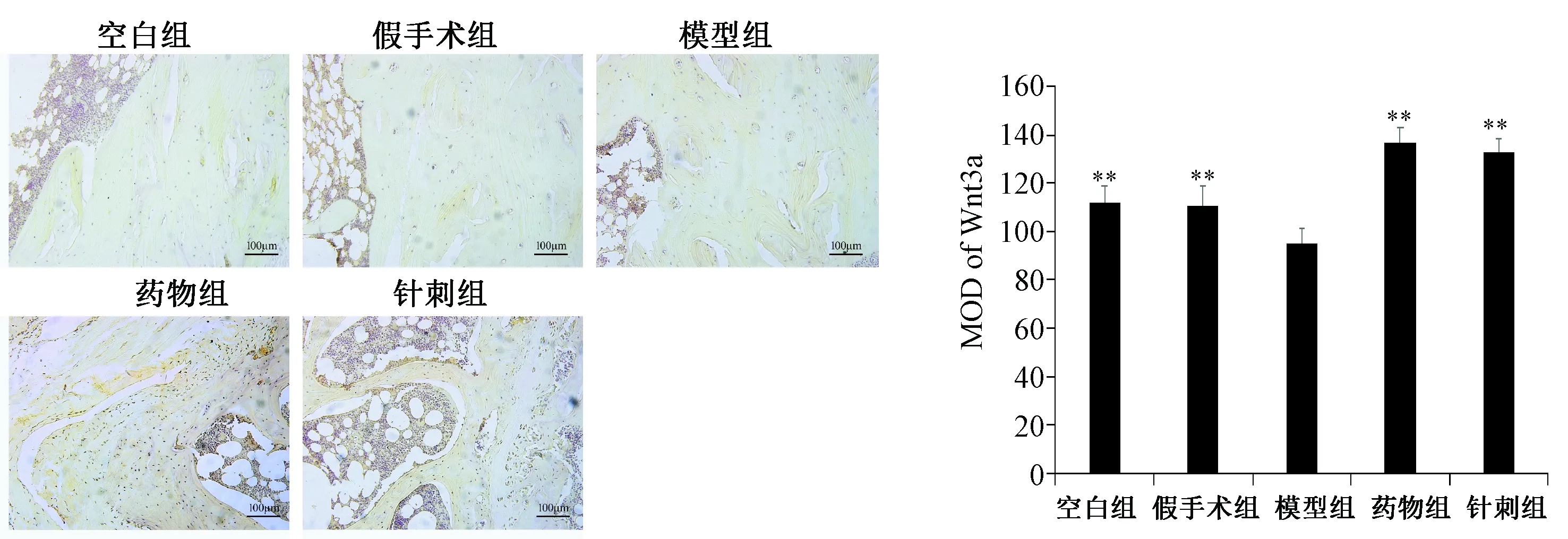
图4 各组大鼠β-catenin蛋白表达与模型组比较,**P<0.05Fig.4 Protein expression of β-catenin in each group Compared with model group,**P<0.05
3 讨论
关于PMOP的中医病因病机及辨证分型由于缺乏经典理论的指引,临床上尚缺乏统一的诊断标准,历代医家多认为其与肾、脾、肝、瘀密切相关,基本病机是脾肾亏虚、骨枯髓痿为本、邪阻经络为标,肝失疏泄是关键,血瘀是其促进因素,当以补肾健脾疏肝,辅以通络为治疗原则[17]。中医理论认为,肾主骨藏精,肾精对骨的发生、成长及退化起着重要作用;脾主四肢,为百骸之母,气血生化之源,脾化生精微借助于肾阳的温煦,而肾中精气依赖于水谷精微的充养,二者相互资养,互为因果,脾虚可导致肾虚及骨髓空虚,从而引起PMOP的发生。脾俞、肾俞具有健脾补肾的作用,三阴交为肝脾肾三经的交会穴,可补益三脏之虚,足三里,为胃之下合穴有健脾和胃、扶正培元、通经活络、升降气机的功效,为全身强壮要穴,诸穴相配可有效改善PMOP的临床症状,从而达到较好的治疗效果。
现代医学认为,PMOP发病机制是由成骨细胞骨形成功能绝对或相对不足,破骨细胞骨吸收功能亢进,骨吸收超过骨形成而引起的。因此,西医治疗PMOP多采用骨形成促进剂和骨吸收抑制剂,包括雌激素类、降钙素类、甲状旁腺激素类、活性维生素D等[18],上述治疗方法虽有效果,但存在远期疗效欠佳、副作用多等不足。大量临床实践和实验研究的结果表明,针刺能有效增加大鼠骨密度,阻止骨量降低,减缓骨力学的退变,增强骨强度[19-21]。为进一步从分子水平探讨针刺治疗PMOP的作用机制,本实验以RT-PCR法和免疫组化技术检测去卵巢骨质疏松大鼠Wnt3a和β-catenin基因和蛋白表达水平。结果显示,模型组Wnt3a和β-catenin基因和蛋白表达水平均明显低于空白组和假手术组(P<0.05);补肾健脾穴位电针或戊酸雌二醇水溶液灌胃可明显提高去卵巢骨质疏松大鼠Wnt3a和β-catenin基因和蛋白表达水平,提示Wntβ-catenin信号传导途径对成骨细胞分化增殖起着十分重要的作用。其中Wnt3a蛋白是Wntβ-catenin信号通路的起始因子,β-catenin是Wntβ-catenin信号通路中最关键因子[22]。 本实验结果提示,针刺PMOP可能是通过上调Wnt3a和β-catenin的基因和蛋白表达从而调节Wntβ-catenin信号通路,以此调节骨重建系统的平衡,从而达到预防和治疗PMOP的效果,该实验结果为临床针灸治疗PMOP提供了科学的理论依据。
针灸的疗效具有整体性、多维度、多靶点、多目标的调节作用的特点,随着对针刺治疗产生的全身的、整体的调节作用,深入探究以及现代分子生物学实验技术方法的发展,对PMOP的认识已达到细胞分子水平,但仍有些问题值得思考:1.研究发展缓慢,一味地重复相同指标且研究层次较低,应针对以往未涉及的实验环节,如机制研究。2.研究治疗周期较短,针灸对PMOP远期疗效尚不能确定,由于PMOP是一个长期形成的过程,治疗也同样需要长期的过程,因此,今后的研究可考虑采用更长的研究周期,这样能更好地凸显针刺的治疗效果。3.治疗PMOP方法繁杂多样,新的治疗方法不断涌现,如何找到一种既突出本方法特色又对其特异性及所针对适应证型规律性进行总结和概括的优化治疗方案,仍有待进一步探讨。总之,针灸治疗PMOP的研究任重道远,有待向更系统、更深领域发展。

