醋酸曲普瑞林长方案降调节前预处理对多囊卵巢综合征患者体外受精-胚胎移植效果的影响
陆兰英 马海兰 王 巍 胡肖玲 杨 露
(广西桂平市人民医院生殖医学中心,桂平市 537200,电子邮箱:zhan926306892@163.com)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是导致不孕的常见疾病之一[1]。目前,临床上常采用体外受精-胚胎移植(invitrofertilization-embryo transfer,IVF-ET)术,治疗经反复促排卵及人工授精等人为干预受孕措施均无效的PCOS患者[2]。为确保术前取得数量多且质量相对好的卵子,通常在行控制性超促排卵前对患者进行垂体功能降调节治疗。醋酸曲普瑞林作为促性腺激素释放激素类似物,较长周期使用反复刺激垂体后能使垂体到达不应期,从而降低垂体功能[3]。但目前在临床上,对于PCOS患者,降调节前是否需要进行去氧孕烯炔雌醇预处理存在争议。本研究分析醋酸曲普瑞林降调节预处理对PCOS患者行IVF-ET效果的影响,为临床治疗方案的选择提供参考。
1 资料与方法
1.1 临床资料 回顾性分析2016年1月至2017年9月于我院行IVF-ET的197例PCOS患者的临床资料。纳入标准:(1)满足《多囊卵巢综合征中国诊疗指南》[4]中关于PCOS的诊断;(2)明确诊断为原发性不孕且自愿接受IVF-ET治疗[5];(3)IVF-ET术前完整接受长方案降调节治疗;(4)至妊娠结束的随访资料完整。排除标准:(1)并发子宫内膜异位症等妇科疾病;(2)内分泌异常;(3)伴有引发受精卵着床困难的相关疾病;(4)先天性生殖系统畸形。根据长效醋酸曲普瑞林使用前是否接受预处理,将患者分为A组103例和B组94例。A组患者年龄26~39(32.17±4.38)岁,不孕年限2~6(4.19±1.83)年,体质指数22.79~25.45(23.86±3.76)kg/m2;B组患者年龄25~36(31.28±5.39)岁,不孕年限1~5(4.03±2.09)年,体质指数22.85~25.97(22.95±2.96)kg/m2。两组患者的年龄、不孕年限、体质指数等一般情况比较,差异均无统计学意义(均P>0.05),具有可比性。
1.2 方法
1.2.1 降调节方案:所有患者于月经来潮的第2天,肌肉注射长效醋酸曲普瑞林注射液(德国辉凌制药有限公司,批号:H20140123;规格:3.75 mg/支)3.75 mg。B组于前一个月经周期的第3天开始口服0.15 mg去氧孕烯炔雌醇片(妈富隆,荷兰欧加农公司,批号:H20130491)进行预处理,1次/d,连续服用21 d。A组患者不给予其他任何预处理。检测所有患者注射长效醋酸曲普瑞林后28~32 d左右的激素水平,观察是否达到垂体脱敏。垂体脱敏判断标准[6]:促卵泡激素(follicle-stimulating hormone ,FSH)低于5 U/L,黄体生成素(luteinizing hormone,LH)低于5 U/L,雌二醇低于183 pmol/L,同时B超显示无直径>10 mm的卵泡即为垂体脱敏。
1.2.2 控制性超促排卵方案:达到垂体脱敏状态后根据患者体质指数、卵泡数目以及基础激素水平皮下注射112.5~225.0 U的促性腺激素(gonadotropin, Gn),1次/d,连用4 d,包括基因重组FSH(德国默克雪兰诺公司意大利药厂,批号:S20110004;规格:450 UI/支)和人绝经期促性腺激素(丽珠集团丽珠制药厂,批号:H20052130;规格:75 UI/支),注射完成后4 d每日监测患者基础激素水平以及卵泡大小,根据监测结果决定是否停用Gn。当出现下列作任一情况时皮下注射重组人绒毛膜促性腺激素(德国默克雪兰诺公司意大利药厂,批号:S20100016;规格:250 μg/支;250 μg/次,1次/d):(1)血清LH超过7 U/L;(2)有1个主导卵泡直径超过18 mm;(3)有2个主导卵泡直径超过17 mm。
1.2.3 取卵、移植以及储存方案:注射重组人绒毛膜促性腺激素32~38 h后于阴道超声引导下行取卵术,随后对取出的卵母细胞培养5 h后行体外受精术,受精后持续定期观察受精卵的原核情况并培养,培养72 h后根据胚胎评分标准[7]对胚胎情况进行评分。选择1~2枚优质胚胎在B超引导下行胚胎移植术,剩余胚胎进行囊胚培养备用。因卵巢过度刺激综合征(ovarian hyperstimulation syndrome,OHSS)高风险而取消移植标准为:注射人绒毛膜促性腺激素日雌二醇>5 000 pg/mL,或获卵>25枚,或已出现OHSS的症状或体征。所有患者取卵当日起每日给予黄体酮注射液(浙江仙琚制药股份有限公司,批号:H33020828;规格为1 mL ∶20 mg)60 mg肌肉注射,于胚胎移植术后14 d检查患者人绒毛膜促性腺激素水平,若人绒毛膜促性腺激素超过10 U/L则确定为生化妊娠,移植后28 d检查见胚芽及胎心搏动确定为临床妊娠。
1.3 观察指标 观察并比较两组患者开始治疗后各阶段的激素水平、治疗过程中一般情况、术后卵细胞及体质胚胎数目、妊娠结局。其中各阶段的激素水平包括治疗前和开始使用Gn时的FSH、LH、雌二醇。治疗过程中一般情况包括Gn持续使用时间及总量及OHSS发生率[8]。IVF-ET效果包括获得卵细胞数目、受精率、优质胚胎数、胚胎种植率。妊娠结局包括减胎率及流产率。
1.4 统计学分析 采用SPSS 22.0软件进行统计分析。计量资料以(x±s)表示,组间比较采用t检验;计数资料以例数和百分比表示,组间比较采用χ2检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组患者各阶段激素水平比较 两组患者开始使用Gn时FSH和LH水平均低于术前,而雌二醇水平高于术前(均P<0.05),但两组患者各阶段激素水平差异均无统计学意义(均P>0.05),见表1。

表1 两组患者各阶段激素水平比较(x±s)
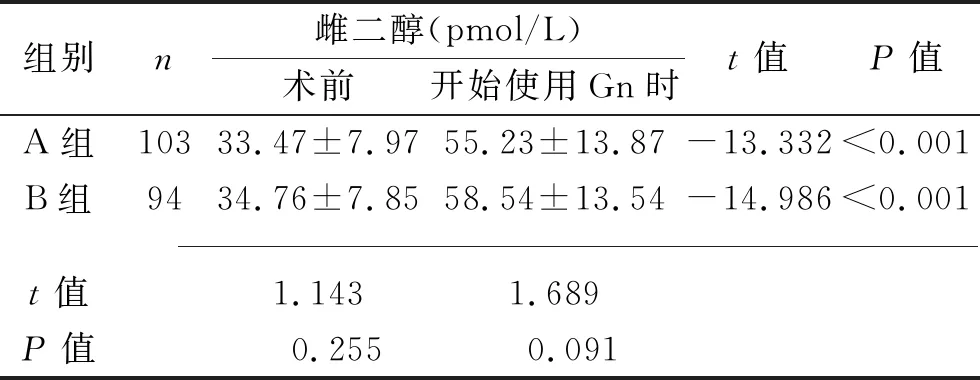
组别n雌二醇(pmol/L)术前开始使用Gn时t值P值A组10333.47±7.9755.23±13.87-13.332<0.001B组9434.76±7.8558.54±13.54-14.986<0.001t值1.1431.689P值 0.255 0.091
2.2 两组患者治疗过程中的一般情况比较 两组患者OHSS发生率差异无统计学意义(P>0.05),而A组患者Gn使用总量及持续使用时间少于或短于B组(均P<0.05),见表2。

表2 两组患者治疗过程中一般情况比较
2.3 两组患者获得卵细胞、优质胚胎数目以及妊娠结局比较 A组患者获得卵细胞数和优质胚胎数均多于B组(均P<0.05);两组患者受精率、胚胎种植率、减胎率及流产率差异均无统计学意义(均P>0.05)。见表3。

表3 两组患者获得卵细胞、优质胚胎数目及妊娠结局比较
3 讨 论
IVF-ET是目前临床上治疗不孕症较为常用的方法,相较于传统术式,其成功率相对较高[9]。临床上使用IVF-ET治疗有生育意愿的PCOS患者成功率相对较高[10]。IVF-ET术前降调节方案的选择相对较多。有学者认为,由于PCOS患者的经期无明显规律,通过避孕药物预处理能使患者经期相对规律,从而使取卵时间亦相对规律,最终可改善体外受精术后取卵的质量[11];但也有研究显示,预处理后患者的体外受精效果以及术后OHSS的发生率与未进行预处理的患者无显著差异[12]。本研究结果显示,两组患者开始使用Gn时FSH、LH水平均低于术前,雌二醇水平高于术前(均P<0.05)。这可能是由于FSH以及LH是体内促进卵泡成熟及脱落的重要成分,通过降调节处理能有效减少垂体释放上述两种激素,同时增加雌二醇在体内的含量,有效抑制卵细胞发育,使其发育状态处于同一水平线,避免优势卵细胞发育对其他卵细胞发育的抑制,从而在控制性超促排卵时能获得更多发育成熟的卵细胞。单丹等[13]研究结果显示,降调节后患者LH升高会导致不良妊娠结局。本研究中两组患者各阶段激素水平差异均无统计学意义(均P>0.05),提示预处理并不会影响激素水平。
本研究结果显示,A组患者Gn使用总量及持续使用时间低于或短于B组(均P<0.05)。这提示预处理会增加患者Gn使用的量及时间,主要是由于预处理使用的药物中含有雌激素成分,而大量雌激素成分会降低垂体对Gn的反应,从而导致需要更多剂量的Gn才能达到预期目标,故其使用总量及时间明显增加。本研究中,两组OHSS发生率差异无统计学意义(P>0.05),说明未行预处理并不会增加患者发生OHSS的概率,与Wu等[14]的研究结果相似。
本研究结果显示,A组患者获得卵细胞数和优质胚胎数均多于B组(均P<0.05)。笔者认为,这是由于预处理时去氧孕烯炔雌醇片使用的时间相对较长,对患者体内垂体-性腺轴的抑制作用在一定程度上影响了控制性超促排卵时排出卵细胞的质量所致。有研究显示,由于预处理药物中雌激素的影响,患者早期流产率相对较高[15]。但本研究中,两组患者受精率、胚胎种植率、减胎率及流产率差异均无统计学意义(均P>0.05),与上述研究结果不一致。这可能与本研究使用的去氧孕烯炔雌醇量相对小,对患者子宫相关功能的影响也相对较小有关,也可能与本研究样本量相对较少有关。
综上所述,PCOS患者IVF-ET术前行醋酸曲普瑞林长方案降调节能获得有效的促排卵前垂体抑制的效果,但行口服避孕药预处理会增加患者促性腺激素使用的量和时间,同时减少其体外受精术后获得成熟卵细胞以及胚胎移植术后获得优质胚胎的数量。故今后对于PCOS患者,行IVF-ET术前降调节时应避免进行预处理。本研究对患者成功妊娠后的随访时间较短,故未对预处理是否会影响孕妇分娩和新生儿结局进行研究,今后可针对这方面进行研究。

