X连锁核糖体S6激酶4在乳腺癌发生发展中的作用及其机制▲
(广西医科大学附属肿瘤医院乳腺外科,南宁市 530021,电子邮箱:2448468746@qq.com)
X连锁核糖体蛋白S6激酶4(ribosomal protein S6 kinase 4,RSK4)最早是在复杂X连锁智力低下患者中发现的一种缺失基因[1],但是现有的研究却表明其在正常人全身各组织器官的细胞中均有表达,并参与多种细胞的功能调节和生理病理过程[2]。近年来,不断有学者发现RSK4参与了肿瘤的发生,其在结直肠癌[3]、胰腺癌[4]、子宫内膜癌[5]、卵巢癌[6]和乳腺癌[7]中的表达均下调。本研究就RSK4在乳腺癌发生中的作用及其可能机制进行初步的探讨。
1 材料和方法
1.1 标本来源 纳入2016年1月至2016年8月我科收治的8例乳腺癌患者。纳入标准:首次诊断为乳腺癌的女性患者,未在外院做过乳房活组织病理检查及任何相关治疗,此次入院首选乳腺癌手术治疗。排除标准:有乳腺癌家族史者,术前接受放化疗及其他相关抗癌治疗者。收集8例患者的乳腺手术切除标本,包括乳腺癌组织及距离癌组织阴性切缘5 cm以上的正常腺体组织。术中取材后立即放入液氮中,置于-80℃冰箱中冻存。所有手术标本术后均由我院病理科医师确诊为乳腺癌,并按照美国肿瘤联合会制定的第8版癌症分期系统进行乳腺癌临床病理原发肿瘤-区域淋巴结-远处转移(tumor-node-metastasis,TNM)分期和组织病理学分级[8]。8例患者的相关临床资料见表1。

表1 8名乳腺癌患者的临床资料
1.2 细胞株、实验动物及慢病毒 (1)无特定病原体级BALB/c雌性裸鼠12只(购自北京斯莱克实验室动物有限公司),5~6周龄,重量17~21 g,于无病原体的高位高效的微粒空气过滤网箱中饲养,喂食含14%蛋白质和3%脂肪的高压灭菌饮食。(2)非恶性乳腺细胞株MCF-10A以及乳腺癌细胞株MCF-7、T47D、ZR-75-1、MDA-MB-436、SK-BR-3和MDA-MB-231均由广西医科大学附属肿瘤医院实验中心提供。(3)pLVEF-1a/GFP-Puro慢病毒载体系统购自上海吉凯基因化学技术有限公司,过表达RSK4基因的慢病毒过表达载体(pLVEF-1a/GFP-Puro-RSK4)的包装及构建均由上海吉凯基因化学技术有限公司完成。
1.3 主要试剂与仪器 一抗:RSK4(1 ∶250)购自美国Abcam公司(批号:ab76117),抗蛋白激酶B(protein kinase B,AKT;1 ∶1 800)、抗磷酸化的蛋白激酶B(phospho-protein kinase B,p-AKT;1 ∶200)、抗细胞外信号调节激酶(extracellular signal-regulated kinase,ERK;1 ∶1 000)、抗磷酸化的细胞外信号调节激酶(phospho-extracellular regulated protein kinases,p-ERK,1 ∶1 000)、E-钙黏蛋白(1 ∶1 000)和波形蛋白(1 ∶500)均购自美国Cell Signaling Technology公司(批号:cst4051、cst9272、cst9101、cst9102、cst9961、cst3932),p- AKT对应的二抗为羊抗鼠(1 ∶1 000),RSK4、AKT、ERK、p- ERK、E- 钙黏蛋白和波形蛋白对应的二抗为羊抗兔(1 ∶1 000),均购自美国Cell Signaling Technology公司(批号:cst14709、cst14708)。Trizol试剂盒(美国Thermo Fisher Scientific公司,批号:15596026),RNeasy Mini试剂盒(美国Qiagen公司,批号:74904),SYBR Green Supermix试剂(公司:Bio-Rad公司;批号:4106212),cDNA反转录试剂盒(日本Takara Bio公司,批号:6210A),Takara套件(日本Takara Bio公司,批号:RR390A),聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(美国Millipore Corp公司,批号:T11784),Image-Quant软件5.2版(美国Molecular Dynamics公司),ABI PRISM 7900HT序列检测系统(美国Applied Biosystems Life公司),Qubit平台(美国Invitrogen公司)。配制裂解缓冲液:140 mmol/L氯化钠、10 mmol/L三羟甲基氨基甲烷盐酸盐(trishydroxymethylaminomethane hydrochloride,Tris-Hcl)、1%聚乙醇辛基苯基醚、1 mmol/L乙二胺四乙酸和蛋白酶抑制剂混合);配制Tris盐酸吐温缓冲液:50 mmol/L Tris-Hcl+150 mmol/L氯化钠+1%吐温20)。
1.4 方法
1.4.1 细胞培养与转染:(1)用含10%胎牛血清、丙酮酸钠和青霉素、链霉素的杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)在37℃、5%CO2培养箱中培养MDA-MB-231、MDA-MB-436、MCF-7细胞,用含15%胎牛血清和1%青链霉素混合液的RPMI 1640培养基于37℃、5%CO2培养箱中培养MCF-10A、T47D、ZR-75-1、SK-BR-3细胞。待细胞密度达到80%左右时,进行细胞传代。(2)挑选生长状态良好的MDA-MB-231细胞制成细胞悬液,以3×105个/孔的密度接种于6孔板中,分为3组,其中转染过表达RSK4的慢病毒载体(pLVEF-1a/GFP-Puro-RSK4)的细胞(即过表达RSK4的MDA-MB-231细胞)作为实验组,转染不含RSK4的慢病毒载体(pLVEF-1a/GFP-Puro)的细胞作为阴性对照组,未做处理的MDA-MB-231细胞为空白组,待细胞覆盖率达60%时进行转染,弃上清培养液。转染48 h后,检测3组细胞的RSK4 mRNA和蛋白表达水平。
1.4.2 实时荧光定量PCR检测:检测8份乳腺癌组织及配对癌旁组织、7种细胞(MCF-10A、T47D、ZR-75-1、SK-BR-3、MDA-MB-231、MDA-MB-436、MCF-7)、3组MDA-MB-231细胞(实验组、阴性对照组、空白组)的RSK4 mRNA表达水平。采用Trizol法提取组织或细胞的总RNA,用反转录试剂盒将RNA反转录成cDNA。在GenBank(https://www.ncbi.nlm.nih.gov/gene/)中查找基因的序列,设计相应的引物,最终引物由Invitrogen公司合成。RSK4的上游引物为5′-TGAGTGGTGGAAACTGGGACAATA-3′,下游引物为5′-TGGCATGGACTGTGGTCATGAGTC-3′。以甘油醛三磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参基因,GAPDH的上游引物为5′-GCACCGTCAAGGCTGAGAAC-3′,下游引物为5′-TGGTGAAGACGCCAGTGGA-3′。按照上机说明书配置PCR反应体系,扩增条件:94℃ 2 min,1个循环;94℃ 30 s,55℃ 1 min和68℃ 2 min,30个循环;68℃ 5 min,延伸循环。PCR反应结束后确认扩增曲线和溶解曲线,采用2-ΔΔCt法计算目的基因的相对表达量。
1.4.3 蛋白质印迹法检测:检测8份乳腺癌组织及配对癌旁组织、7种细胞(MCF-10A、T47D、ZR-75-1、SK-BR-3、MDA-MB-231、MDA-MB-436、MCF-7)的RSK4蛋白表达水平,以及3组MDA-MB-231细胞(实验组细胞、阴性对照组细胞及空白组细胞)的RSK4、AKT、ERK、p-AKT、p-ERK、E-钙黏蛋白及波形蛋白的表达水平。将组织及细胞用配好的裂解缓冲液进行裂解,通过二喹啉甲酸法测定蛋白质浓度,加入蛋白上样缓冲液后电泳分离并转移到PVDF膜上,用含5%脱脂奶粉的TBST溶液封闭2 h后加入一抗,在室温下孵育1 h,TBST洗涤3次,10 min/次,将膜与二抗在室温下孵育1 h,再用TBST漂洗3次,10 min/次,进行X线胶片曝光成像。用凝胶图像分析系统对电泳条带进行密度扫描后,进行灰度分析,以目的蛋白与 GAPDH蛋白条带的灰度比值作为目的蛋白的相对表达量。
1.4.4 细胞迁移和侵袭能力的检测:取3组MDA-MB-231细胞,用无血清的高糖DMED制备细胞悬液,各组取100 μl细胞悬液(约含4×104个细胞)分别加入Transwell上室中,用含15%小牛血清的DMEM完全培养液使Transwell下室充满。于37℃、5%CO2培养箱中放置24 h,多聚甲醛固定,0.1%结晶紫染色20 min,磷酸缓冲盐溶液洗涤3次,10 min/次,后置于显微镜下观察并计数迁移到Transwell下室的细胞总数。侵袭实验前先将60 μl配好的基质胶(基质胶∶DMEM=1∶6)铺至Transwell上室,在37℃、5%CO2培养箱中放置1 h,其余步骤同细胞迁移实验,最后计数侵袭到Transwell下室的细胞总数。
1.4.5 甲基化测序:采用Trizol法从MDA-MB-231细胞提取总DNA,并使用Qubit平台对DNA进行质量分析,用硫酸氢铵处理DNA样本后进行PCR扩增。反应体系共20 μl:SYBR-Green Supermix 10 μl,无酶水8 μl,正向和反向引物(浓度均为10 μmol/L)各0.5 μl,经硫酸氢盐修饰过的DNA 1 μl。PCR反应条件:95℃ 5 min,1个循环;95℃ 1 min、60℃ 1 min、72℃ 1 min,50个循环;最后一个循环为72℃ 1 min,最后终止在4℃。将得到的PCR产物纯化,取50 ng产物使用序列检测系统进行测序,通过测量鸟嘌呤(G)和腺嘌呤(A)的峰高度值之比来评估DNA扩增内每个胞嘧啶-磷酸-鸟苷位点的甲基化水平。用去甲基化试剂5-Aza-2′-脱氧胞苷(美国Sigma公司,批号:2353-33-5)处理MDA-MB-231细胞后再次采用上述方法进行甲基化测序。使用实时荧光定量PCR法检测MDA-MB-231细胞及去甲基化的MDA-MB-231细胞RSK4 mRNA表达水平,方法同1.4.2。
1.4.6 构建裸鼠移植瘤模型:采用抽签法将12只裸鼠随机分为实验组和对照组,每组6只。在实验组裸鼠的乳房脂肪垫中注射过表达RSK4的MDA-MB-231细胞混悬液(细胞计数为5×106个),在对照组裸鼠的乳房脂肪垫中注射对应数量的阴性对照组MDA-MB-231细胞,观察裸鼠成瘤情况。接种后的裸鼠在无特定病原体级动物房中饲养,每隔7 d对裸鼠进行称重1次并观察瘤体大小,用游标卡尺分别测量裸鼠瘤体短轴及长轴,瘤体体积(mm3)=1/2[长轴(mm)×短轴2(m2)],以时间为横坐标,以裸鼠体重及瘤体体积为纵坐标建立生长曲线。6周后,颈脱位处死所有小鼠,完整解剖肿瘤组织,称瘤体重量。
1.5 统计学分析 采用SPSS 19.0软件进行统计学分析。计量资料以(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,两两之间的比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 RSK4 mRNA及蛋白在乳腺癌组织及乳腺癌细胞中的表达情况 乳腺癌组织中RSK4 mRNA的相对表达量为(0.131±0.111),低于癌旁正常组织的(1.000±0.000)(t=22.106,P<0.001)。乳腺癌组织中RSK4蛋白的相对表达量为(0.506±0.298),低于癌旁正常组织的(1.034±0.069)(t=4.839,P=0.002)。
MCF-10A细胞的RSK4 mRNA及RSK4蛋白表达均高于6种乳腺癌细胞(均P<0.05);MCF-7细胞的RSK4 mRNA及RSK4蛋白表达均高于其余5种细胞(均P<0.05);MDA-MB-231细胞的RSK4 mRNA及RSK4蛋白表达均低于T47D、ZR-75-1、MDA-MB-436、SK-BR-3细胞(均P<0.05)。见表2。
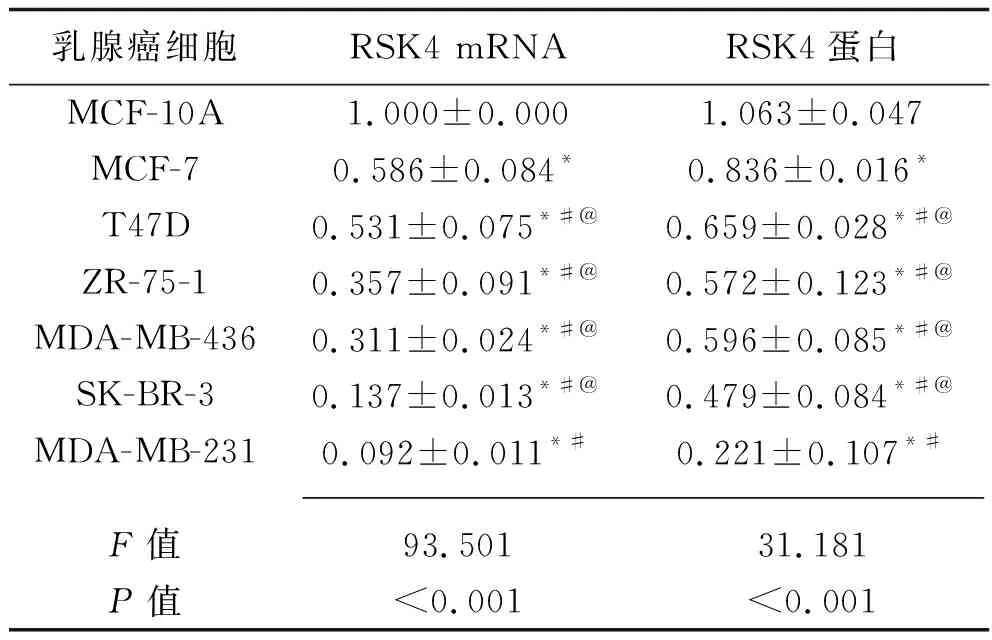
表2 7种乳腺癌细胞RSK4 mRNA和蛋白的相对表达水平(x±s)
注:与MCF-10A细胞比较,*P<0.05;与MCF-7细胞比较,#P<0.05;与MDA-MB-231细胞比较,@P<0.05。
2.2 3组MDA-MB-231细胞RSK4表达情况、细胞迁移及侵袭能力比较 实验组细胞RSK4 mRNA及RSK4蛋白的表达水平均高于阴性对照组和空白组(均P<0.05),阴性对照组和空白组间差异无统计学意义(P>0.05)。实验组细胞的迁移细胞数和侵袭细胞数均低于阴性对照组和空白组(均P<0.05),阴性对照组和空白组间差异无统计学意义(P>0.05)。见表3。

表3 3组MDA-MB-23细胞RSK4 mRNA和蛋白质的相对表达水平、细胞迁移和侵袭能力比较(x±s)
注:与实验组细胞比较,*P<0.05。
2.3 3组MDA-MB-23细胞AKT、ERK、p-AKT、p-AKT、E-钙黏蛋白和波形蛋白表达水平比较 3组细胞AKT及ERK的表达水平比较,差异均无统计学意义(均P>0.05)。实验组细胞的p-AKT、p-ERK、波形蛋白表达水平表达水平均低于其他两组,而E-钙黏蛋白高于其他两组(均P<0.05),阴性对照组和空白组细胞以上指标比较差异均无统计学意义(均P>0.05)。见表4。
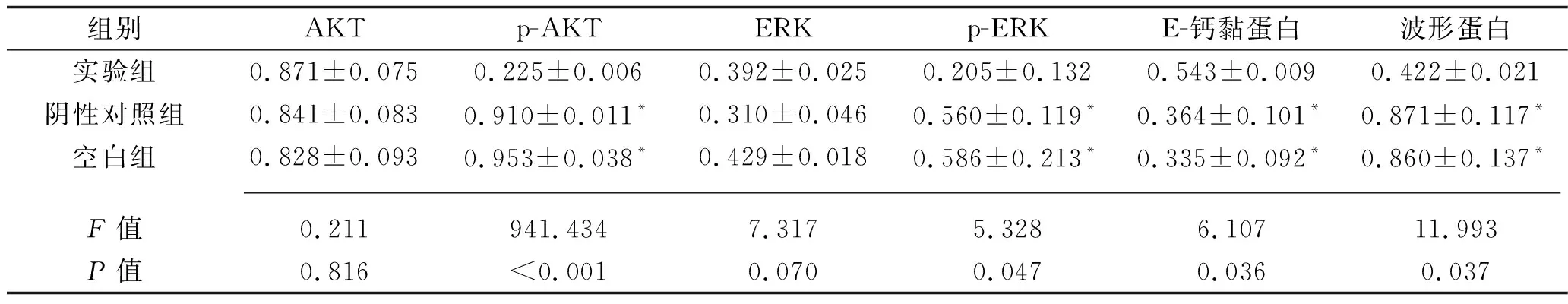
表4 3组MDA-MB-23细胞相关蛋白的相对表达水平(x±s)
注:与实验组细胞比较,*P<0.05。
2.4 乳腺癌MDA-MB-23细胞中RSK4启动子的甲基化 MDA-MB-231细胞的甲基化率为87.1%(296/340),去甲基化后MDA-MB-231细胞的甲基化率为56.8%(193/340)。MDA-MB-231细胞RSK4 mRNA的相对表达量分别为(1.000±0.000),低于去甲基化MDA-MB-231细胞的(5.433±0.330)(t=10.450,P=0.002)。
2.5 裸鼠体重变化及移植瘤的生长情况 两组裸鼠的体重比较,差异有统计学意义(F组间=273.803,P组间<0.001),其中在第3、4、5、6周,实验组的体重均高于对照组(均P<0.05);两组裸鼠的体重均有随时间变化的趋势(F时间=31 950.788,P时间<0.001);分组与时间无交互效应(F交互=85.875,P交互=0.106)。两组裸鼠的瘤体体积比较,差异有统计学意义(F组间=4 987 320.551,P组间<0.001),其中在第2、3、4、5、6周,实验组的瘤体体积均小于对照组(均P<0.05);两组裸鼠的瘤体体积均有随时间变化的趋势(F时间=8.174,P时间<0.001);分组与时间有交互效应(F交互=1.384,P交互<0.001)。

表5 两组裸鼠体重比较(x±s,g)

表6 两组裸鼠瘤体体积比较(x±s,mm3)
3 讨 论
本研究结果显示,乳腺癌组织中的RSK4 mRNA及蛋白表达水平均低于癌旁正常组织(均P<0.05),提示RSK4基因作为一种抑癌基因参与乳腺癌的发生。此外,在6种乳腺癌细胞中,生物学行为恶性度最高的MDA-MB-231细胞中RSK4 mRNA及RSK4蛋白质表达水平最低,而生物学行为恶性度最低的MCF-7细胞中RSK4的mRNA及蛋白质表达水平最高(P<0.05),说明RSK4表达的降低很可能与乳腺癌的发生发展有关。MCF-7细胞是雌激素受体阳性的乳腺癌细胞,MDA-MB-231细胞是雌激素受体阴性的乳腺癌细胞,由此推测不同乳腺癌细胞间RSK4的表达差异有可能与雌激素受体状态有关。乳腺癌组织或细胞中mRNA表达水平下调的原因可能有[7]:(1)基因突变或缺失等原因造成的基因结构异常;(2)启动子胞嘧啶-磷酸-鸟苷位点的异常甲基化等基因表达调控机制异常导致的转录生成mRNA不足。而乳腺癌组织或细胞中RSK4蛋白表达水平下调很可能是由RSK4 mRNA下调导致的。此外,在本研究的裸鼠移植瘤实验中,第3周至第6周时实验组裸鼠的体重均大于对照组,第2周至第6周时实验组裸鼠的瘤体体积均小于对照组(均P<0.05),提示RSK4对乳腺癌肿瘤的生长起到抑制作用,体内及体外实验均表明RSK4的功能与乳腺癌及生物学行为密切相关。实验组细胞的迁移细胞数和侵袭细胞数均低于阴性对照组和空白组(均P<0.05),提示过表达RSK4可显著抑制乳腺癌MDA-MB-231细胞的迁移和侵袭能力。
RSK4是X染色体连锁基因,由于只有一个拷贝,该基因甲基化或突变就可直接导致其功能丧失,从而促使肿瘤发生[7]。为了验证RSK4启动子异常甲基化可能是导致RSK4基因沉默的原因,本研究检测了MDA-MB-231细胞及去甲基化的MDA-MB-231细胞RSK4 mRNA的表达水平,结果显示去甲基化的MDA-MB-231细胞中RSK4 mRNA表达水平高于MDA-MB-231细胞(P<0.05),表明甲基化可能是导致RSK4基因沉默的原因[9]。
当上皮来源的癌细胞向临近组织或者远处器官入侵时会伴随有上皮间质转化发生,而上皮间质转化有助于肿瘤侵袭转移、异质性和耐药的产生[10]。乳腺上皮细胞上皮间质转化的进展和转移潜能需要RSK的下游效应器核因子κB来诱导[11]。最新研究表明,肿瘤坏死因子受体相关因子4可能通过AKT途径负性调节RSK4,然后参与核因子κB的激活途径,最后导致肿瘤增殖、侵袭和转移[12]。RSK4也是丝裂原活化蛋白激酶/ERK途径的下游因子[13],是抑制ERK运输的重要肿瘤抑制因子。而上皮间质转化也可以通过AKT/ERK信号传导途径发生[14]。本研究对过表达RSK4的乳腺癌细胞进行了AKT、ERK信号传导途径关键蛋白及上皮间质转化的两种主要标志物(即E-钙黏蛋白和波形蛋白)的检测,结果发现实验组细胞的p-AKT、p-ERK、波形蛋白表达水平均低于阴性对照组和空白组,而E-钙黏蛋白表达水平高于阴性对照组和空白组(均P<0.05)。因此,我们推测由于RSK4异常甲基化导致其功能失活,进而影响上皮细胞AKT和ERK蛋白的正常磷酸化进程,从而促进了上皮间质转化的发生。这也部分解释了为什么具有更加恶性表型的肿瘤细胞往往RSK4甲基化程度更高、RSK4的表达更低。而RSK4的异常甲基化究竟是通过何种作用机制,并如何能通过AKT和ERK信号通路途径参与了乳腺癌上皮间质转化的过程,目前还在进一步研究中。
综上所述,RSK4对乳腺癌的发生发展过程中起到抑制作用,在乳腺癌中RSK4的低表达可能由其启动子异常甲基化引起的。RSK4或通过AKT/ERK信号通路调节乳腺癌细胞的上皮间质转化过程。

