MSCTA联合术中超声在小肾癌后腹腔镜肾部分切除手术中的应用价值
宋殿宾,王志勇,张晶晶,李红阳,马光,刘英
(承德医学院附属医院,河北 承德 067000)
随着医学影像学的普及、发展,小肾肿瘤(≤4.0 cm)的检出率明显增多,这些小肿瘤行肾部分切除术(partial nephrectomy, PN)替代传统根治性肾切除。而后腹腔镜肾部分切除术(laparoscopic partial nephrectomy, LPN)治疗小肾癌得到快速发展,其成为金标准。与传统的开放手术比较,其有术中出血少、术后恢复快、卧床时间短及并发症少等优点,且LPN能达到相同的肿瘤切除效果[1]。术前多层螺旋CT血管成像(multidetector spiral computed tomographic angiography, MSCTA)能准确显示肾脏血管的解剖和变异,有助于术中准确分离、阻断血管,术中联合超声能在有限的热缺血的时间内完整切除肿瘤,尽量多的保留正常肾组织。本文选取承德医学院附属医院收治的55例小肾癌患者施行后LPN、部分患者行术中超声,效果满意。现报道如下。
1 资料与方法
1.1 一般资料
选取2014年5月—2016年5月该院小肾癌患者55例,其均为单发。根据术中是否行应用超声将其分为超声组和非超声组。其中,超声组28例:男性17例,女性11例;年龄27~78岁,平均51.6岁;左肾肿瘤16例,右肾肿瘤12例;肿瘤平均直径为3.0 cm。非超声组27例:男性17例,女性10例;年龄28~80岁,平均52.2岁;左肾肿瘤17例,右肾肿瘤10例;肿瘤平均直径为3.1 cm。两组具有可比性。所有病例术前均完善MSCTA检查。由于肿块位于肾实质内,CT平扫不易看出,行MSCTA检查时肿块边界变得清晰,有快进快出的特点;同时显示肾动脉的形态,有无副肾动脉、动脉过早分支及供应肿瘤的动脉。见图1~3。
1.2 手术方法
患者采用全身麻醉。取健侧卧位,采用后腹腔入路,行患侧腰部三孔法,游离肾脏,术中超声采用Nemio SSA-550A超声诊断仪(日本东芝株式会社,探头为PVF-738F术中探头)。术中置入超声探头观察肿瘤的部位、大小、血流信号、肿瘤距肾表面和肾蒂血管及集合系统距离、肾内是否存在其他肿瘤病灶等(见图4)。术中超声标记切缘后,根据术前MSCTA找到肾动脉。阻断动脉前用5%葡萄糖注射液+肌苷静脉滴注,用20%甘露醇溶液快速静脉滴注用来保护肾功能,用冰屑外敷肾脏周围行局部降温。阻断肾动脉后,用超声观察阻断效果。在距肿瘤边缘0.5 cm行肾部分切除,3-0 V-lock线或2-0 V-lock线缝合肾脏创面。阻断时间≤30 min,严密止血后将肿物装入取物袋,经腋后线小切口取出。留置肾旁引流管,依次关闭各层,详细记录手术时间等观测指标。标本送病理。所有肿瘤分期为T1aN0M0。术后病理回报:肾透明细胞癌高分化30例,中分化17例,低分化8例。

图1 术前CT平扫图像
图2 术前MSCTA图像

图3 MIP像显示肾动脉过早分支

图4 术中超声观察肿瘤
1.3 统计学方法
数据分析采用SPSS 13.0统计软件,正态分布计量资料以均数±标准差(±s)表示,比较采用t检验,非正态分布计数资料以M(P25,P75)表示,比较采用非参数检验,计数资料以率(%)表示,比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组术中、术后相关指标比较
两组术中、术后相关指标比较,差异有统计学意义(P<0.05);超声组手术时间、术中热缺血时间、出血量、中转开放率均低于非超声组。见图5和表1。
2.2 两组术前与术后肾功能和术肾GFR比较
术后1年随访,超声组尿素氮、肌酐及术肾GFR术前与术后比较,差异无统计学意义(P>0.05)。非超声组尿素氮及肌酐术前与术后比较,差异无统计学意义(P>0.05),而术肾GFR术前与术后比较,差异有统计学意义(P<0.05)。见表 2。

图5 (MIP像)显示右肾肿瘤,术后改变
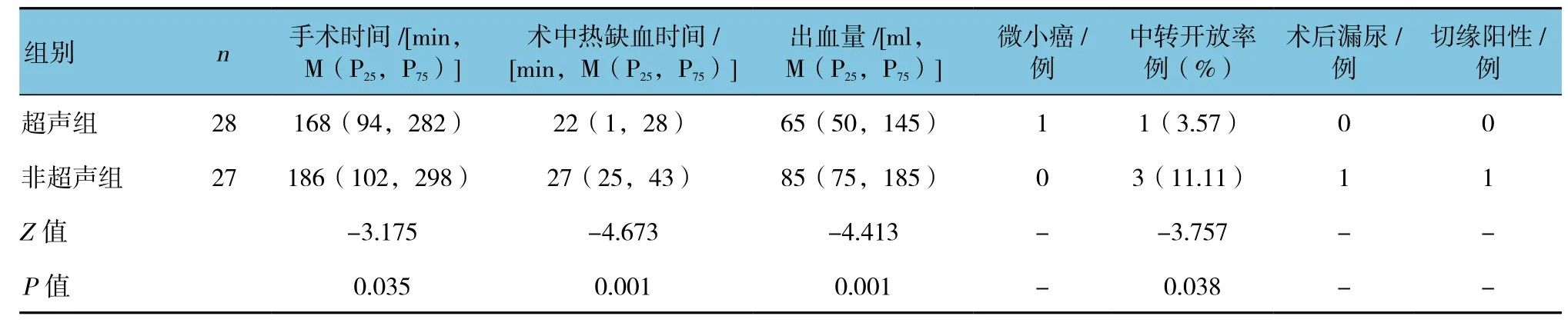
表1 两组术中、术后相关指标比较
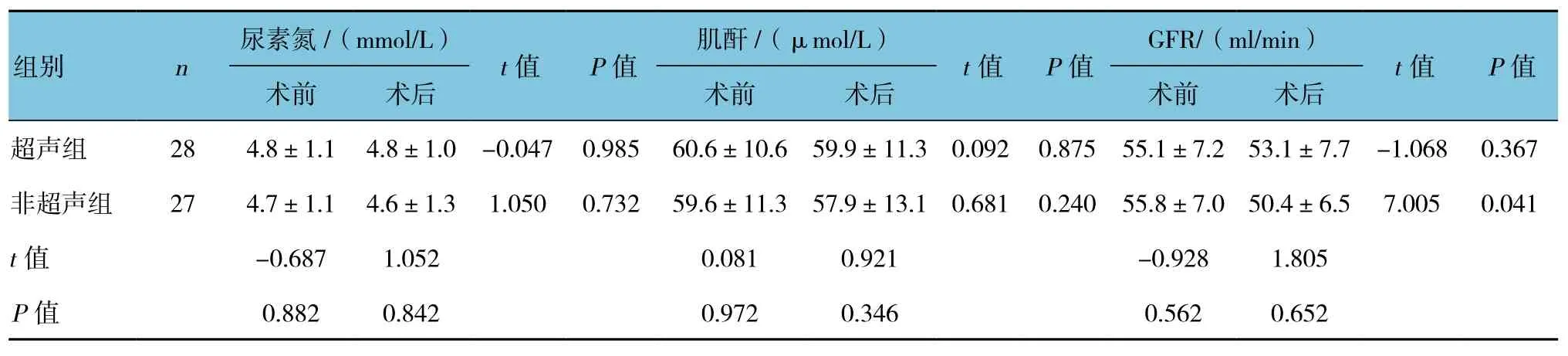
表2 两组术前与术后肾功能和术肾GFR比较
3 讨论
随着人们生活水平的提高、健康意识增强、检查手段日趋多样化和先进化及影像学检查技术的不断发展与进步,肾脏小肿瘤检出率增多。而这些小肿瘤可做保留肾单位的手术,其术后效果及并发症与肾癌根治术几乎无差异,且远期生活质量和生存率优于根治性肾切除[2]。在肾部分切除术前,全面、精确地认识肿瘤大小、位置、与周围肾实质及血管毗邻关系是手术顺利完成、减少肾动脉阻断时间和保留更多肾单位的关键。MSCTA除能清楚显示小肾癌的密度、邻近肾脏皮质及集合系统的的浸润情况,还能清楚地显示肾脏血管的解剖结构及其变异血管的情况,且还有操作简便、无创的优点。MSCTA有利于影像医生对病变部位进行精确定位显示,掌握患者肾血管解剖位置,指导临床医生制定正确的治疗方案[3]。薛红强等[4]对小肾癌保留肾单位手术的80例患者,对术前行MSCTA的42例和仅行MSCT 38例比较时,其结果MSCTA组手术时间、术中肾脏热缺血时间缩短,术中出血量、术后渗血量减少,术后住院时间缩短,均优于单纯MSCT组。本组55例术前均做MSCTA的检查,术中能根据其显示的肾脏血管及其副肾血管,使术者准确的分离、阻断肾脏血管、减少术中出血、缩短手术时间,术中无1例需要输血。
小肾癌行肾部分切除术的初衷是保留更多的肾单位和肾功能,最初人们担心患肾的微小多发灶难以切除以及切缘阳性,容易引起肿瘤的复发。但是越来越多的研究表明,对于单发的,较小的肿瘤行肾部分切除术局部复发率不足2%。最担心的是切缘阳性,切缘阳性率2.0%~10.7%[5-6]。无论是切开、腹腔镜还是机器人的部分肾切除均有可能发生切缘阳性。特别是位于肾实质内或邻近主要血管的肿瘤,因担心损伤肾脏的血管,切除肿瘤保守,更容易出现切缘阳性。TABAYOYONG等[7]对11 587例因肾癌做了部分肾切除进行研究,而806例切缘阳性(7.0%),其中切开手术5 094例、腹腔镜1 681例、机器人4 812例,切缘阳性率在这3种手术方法各不相同,分别为4.9%、8.1%和8.7%。最近MAURICE等[8]报告6 038例部分肾切除,切缘阳性302(5.3%)。本组为3.7%,切缘阳性可能有较高的局部复发和转移。术中超声将超声探头可以直接放置肾脏的表面,避免腹壁组织的干扰。同时术中超声比腹部超声的分辨力更高,能更清楚地显示肿瘤部位、血流信号、有无微小癌灶等[9]。特别对于内生型肿瘤,而对中央型肾癌由于肿瘤内生且靠近肾脏血管及集合系统,不仅定位困难,术中更容易出现损伤集合系统或血管出现尿瘘或出血等术后并发症,手术难度相对较大。而术中超声实时监测,能完整切除肿瘤、最大限度保留肾单位[10],能根据术中具体情况实现动态观测的过程,术中根据血流信号判断肾动脉阻断是否完全。因术中超声定位准确,在切除时可保留较多的正常肾组织,减少出血风险,缩短手术时间,利于术后肾功能恢复。但术中应用超声检测下做肾脏部分切除,能切除肿瘤的足够边缘,同时还能切除微小病灶,本组1例,术前影像学未能发现,术中超声检出,同时给与切除。
对小肾癌行后腹腔镜肾部分切除的手术,术前MSCTA联合术中超声较未联合术中超声,能保留较多的正常肾组织,减少出血,缩短手术时间,利于术后肾功能恢复。但本组病例数尚少,缺乏长期随访,有待今后进一步研究。

