结肠镜减压及大黄肠道去污对合并胃肠功能障碍脓毒症患者临床疗效及预后的影响*
杨超,郭翠翠,王玉珍,白奎,张春民,张二辉,高海波,韩大正
(河南大学第一附属医院 1.重症医学科,2.消化内科,河南 开封475000)
脓毒症(sepsis)是由于创伤、烧伤、大型手术、再灌注损伤等导致感染引发全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)所导致的脏器功能致命性损伤,脓毒症起病急、发展迅速,病死率极高[1-2]。脓毒症的发生与机体凝血机制异常和免疫功能紊乱密切相关[3]。细菌感染诱导机体释放多种炎症因子,引起SIRS;同时激活机体的外源性凝血途径,导致机体凝血、纤溶系统功能失控,进一步加速炎症反应的发生;而炎症反应也可促进凝血系统的激活,从而形成恶性循环[4]。胃肠系统作为体内最大的储菌库和内毒素库,极易受到炎症反应的影响,出现胃肠功能障碍[5]。有研究提出,胃肠功能障碍是多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)的早期表现,同时又可以进一步加重胃肠感染和炎症反应,形成恶性循环[6]。因此如何治疗胃肠功能障碍是降低SIRS和MODS发病率和致死率的重要环节之一。选择性肠道去污(selective decontamination of the digestire tract, SDD)可以降低脓毒症患者的病死率以及继发性MODS的发生率,但是会明显增加耐药性革兰菌的感染率,极大地限制其在脓毒症治疗领域的推广[7]。近些年,随着中医学的快速发展,越来越多的中药制剂用于临床并得到普遍认可。基于笔者多年的临床经验,在积极的西医治疗基础上,配合中医辨证治疗,可有效的改善脓毒症患者的胃肠功能障碍以及炎症反应,达到重建内环境稳态的目的。本项研究采用前瞻性随机对照的方法探讨结肠镜减压联合应用大黄进行肠道去污对合并胃肠功能损伤的脓毒症患者的临床疗效及预后的影响,为合并胃肠功能损伤的脓毒症患者的治疗策略提供依据。现报道如下。
1 资料与方法
1.1 临床资料
本研究随机选取2014年1月—2017年12月河南大学第一附属医院重症医学科住院接受治疗的合并胃肠功能损伤的脓血症患者72例。根据欧洲危重病学会于2012年提出的急性胃肠功能损伤(a cute gastro-intestinal injury, AGI)分级标准,Ⅱ级45例,Ⅲ级27例。其中,男性37例,女性35例;年龄47~83岁,平均(68.27±11.34)岁。本研究已获得本院伦理委员会批准。按照随机数字表法,将所有患者分为治疗组与对照组,每组36例。
1.2 纳入标准
所有患者均符合2008年国际脓血症定义会议制定的脓血症诊断标准[8]:①中心体温>38.3℃或<36.0℃;②心率>90次/min;③呼吸>30次/min;④血糖>7.7 mmol/l;⑤C反应蛋白(C-reactive protein,CRP)或降钙素原(procalcitonin, PCT)>正常值2个标准差。所有患者均符合AGIⅡ~Ⅲ级胃肠功能障碍诊断标准[9];由患者或患者家属签署知情同意书。
1.3 排除标准
①不符合上述纳入标准的患者;②既往有血液透析史;③有免疫抑制剂治疗史;④自身免疫性疾病或恶性肿瘤患者;⑤精神障碍患者;⑥肝肾功能异常者;⑦依从性差者。
1.4 治疗方案
1.4.1 对照组 患者给予常规基础治疗,包括注射抗生素抗感染、早期体液复苏治疗、静脉滴注营养液、脏器功能支持、纠正水电解质酸碱平衡紊乱、减量或停止肠内营养及胃肠减压治疗。
1.4.2 治疗组 在对照组基础上给予结肠镜减压联合大黄肠道去污治疗。其中结肠镜采用Olympus CF230型肠镜(日本Olympus公司),大黄液来源于该院中药房大黄粉,使用前将10 g大黄粉溶于100℃沸水中,充分溶解后冷却至37℃;具体方法为:边进镜边用生理盐水冲洗附着于黏膜表面的黏稠物,将冲洗下来的黏稠物吸走,充分暴露结肠黏膜;在进镜过程中,尽量避开肠腔内成形粪便,以免堵塞内镜吸引孔道;到达回盲部且肠道清洗干净后、退出结肠镜前,于回肠末段或回盲部肠腔内注入大黄液100 ml;在退镜过程中再次清除肠腔残留粪渣并尽量吸尽腔内气体和冲洗液;每日1次,使用至患者胃肠道功能恢复。
1.5 观察指标
1.5.1 一般临床资料 详细记录患者的年龄、性别、感染部位等一般临床资料。密切监测两组患者肠鸣恢复时间、肛门排气时间、腹痛腹胀缓解时间、住院时间、使用血管活性药物的时间、机械通气的时间等指标。
1.5.2 实验室指标 分别在受试前和治疗结束后检测患者的血常规,包括PCT、CRP、尿素氮(blood urea nitrogen, BUN)、血清肌酐(serum creatinine, SCr)等生化指标。
1.5.3 疗效评估 采用急性生理与慢性健康评分系统(acute physiology and chronic health evaluation Ⅱ ,APACHEⅡ)评分系统评估患者的病情变化[10]。
1.5.4 胃肠功能障碍评分 依据2015年重修的95庐山会议MODS病情分期诊断及严重程度评分标准[11],疗效系数(n)=(治疗前积分-治疗后积分)/治疗前积分×100%。①显效:腹部症状、腹围、肠鸣音等临床症状基本消失或得到改善,n≥70%;②有效:腹部症状、腹围、肠鸣音等临床症状得到改善,30%≤n<70%;③无效:腹部症状、腹围、肠鸣音等临床症状未见改善甚至恶化,n<30%。
1.6 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验,计数资料以率(%)表示,比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般临床资料比较
两组患者的一般临床资料比较,年龄、性别、感染部位、AGI分级、血管活性药物或正性肌力药物服用史患者、行机械通气患者数等基本一致,差异无统计学意义(P>0.05)。见表 1。
2.2 两组患者血液生化指标的比较
治疗前,两组患者血清PCT、CRP、BUN、Scr水平基本一致,差异无统计学意义(P>0.05);经治疗后,两组患者血清PCT、CRP、BUN、SCr水平较治疗前均有改善,与治疗前比较,差异有有统计学意义(P<0.05);但是治疗组患者血液生化指标下降更多,治疗后,治疗组患者PCT、CRP、BUN、SCr水平低于对照组患者,差异有有统计学意义(P<0.05)。见表2。
2.3 两组患者治疗后临床指标比较
经治疗后,治疗组患者APACHEⅡ评分、胃肠功能障碍评分、肠鸣音恢复时间、肛门排气时间、腹痛腹胀缓解时间、使用血管活性药物的时间、机械通气时间、ICU住院时间均低于对照组患者,差异有统计学意义(P<0.05);两组患者总住院时间的比较,差异无统计学意义(P>0.05)。见表 3。
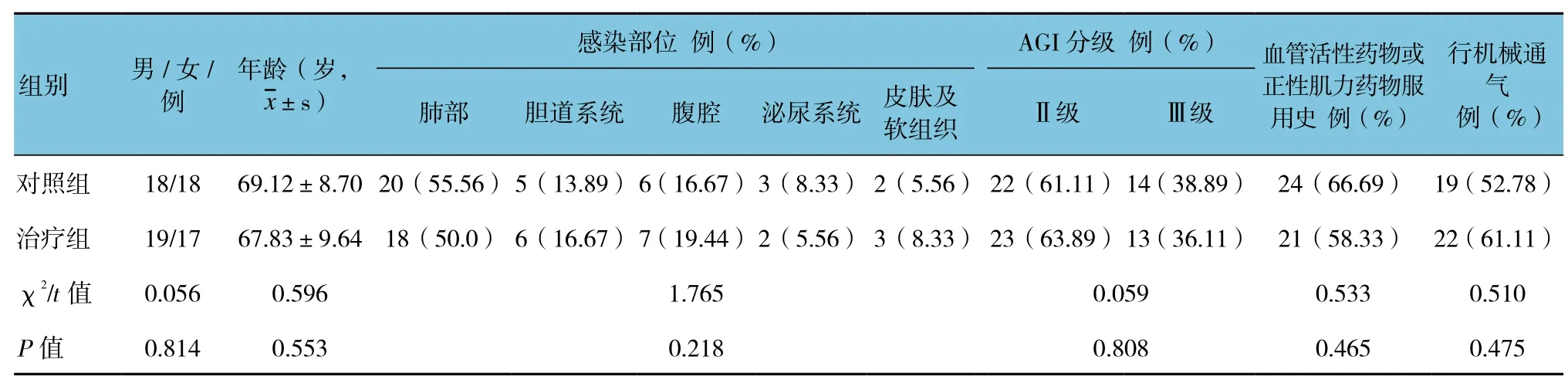
表1 两组患者一般临床资料比较 (n =36)
表2 两组患者PCT、CRP、BUN、Scr的变化比较 (n =36,±s)
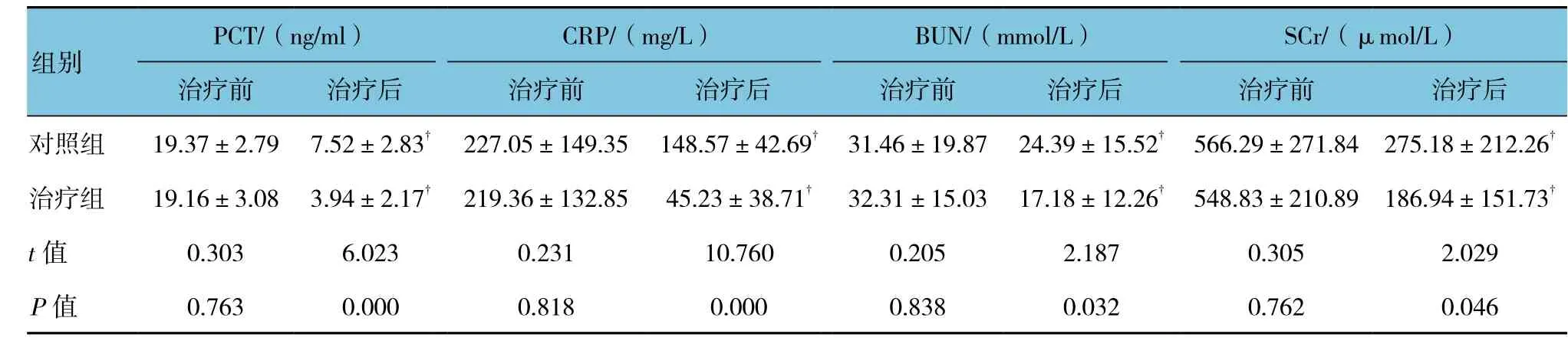
表2 两组患者PCT、CRP、BUN、Scr的变化比较 (n =36,±s)
注:†与治疗前比较,P <0.05
PCT/(ng/ml) CRP/(mg/L) BUN/(mmol/L) SCr/(μmol/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 19.37±2.79 7.52±2.83† 227.05±149.35 148.57±42.69† 31.46±19.87 24.39±15.52† 566.29±271.84 275.18±212.26†治疗组 19.16±3.08 3.94±2.17† 219.36±132.85 45.23±38.71† 32.31±15.03 17.18±12.26† 548.83±210.89 186.94±151.73†t值 0.303 6.023 0.231 10.760 0.205 2.187 0.305 2.029 P值 0.763 0.000 0.818 0.000 0.838 0.032 0.762 0.046组别
2.3 两组患者临床疗效及预后比较
经治疗后,治疗组患者胃肠功能障碍总有效率高于对照组,差异有统计学意义(P<0.05);对照组MODS发生率和病死率均高于治疗组,差异有统计学意义(P<0.05)。见表 4。
表3 两组患者治疗后的临床疗效的比较 (n =36,±s)
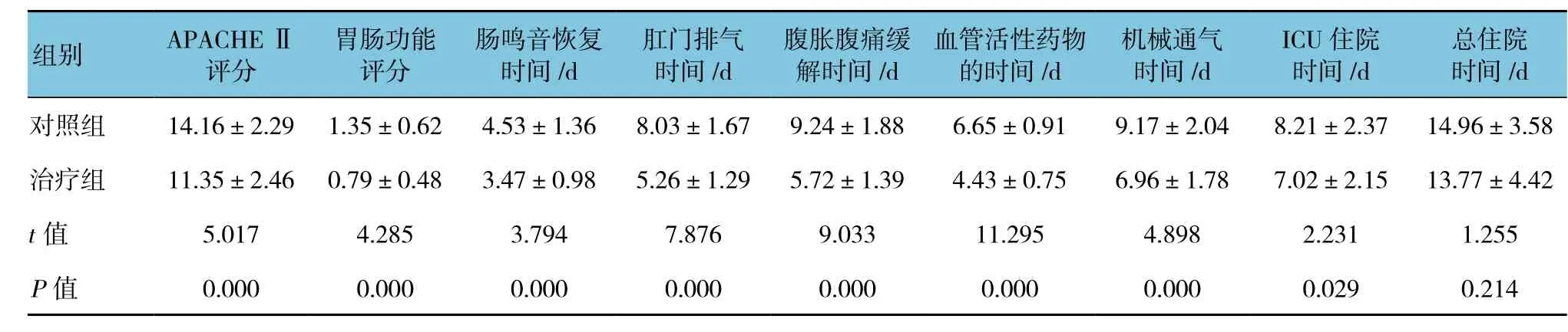
表3 两组患者治疗后的临床疗效的比较 (n =36,±s)
总住院时间/d对照组 14.16±2.29 1.35±0.62 4.53±1.36 8.03±1.67 9.24±1.88 6.65±0.91 9.17±2.04 8.21±2.37 14.96±3.58治疗组 11.35±2.46 0.79±0.48 3.47±0.98 5.26±1.29 5.72±1.39 4.43±0.75 6.96±1.78 7.02±2.15 13.77±4.42 t值 5.017 4.285 3.794 7.876 9.033 11.295 4.898 2.231 1.255 P值 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.029 0.214组别 APACHEⅡ评分胃肠功能评分肠鸣音恢复时间/d肛门排气时间/d腹胀腹痛缓解时间/d血管活性药物的时间/d机械通气时间/d ICU住院时间/d

表4 两组患者胃肠功能临床疗效和预后情况比较 [n =36,例(%)]
3 讨论
脓毒症是ICU危重患者的主要死亡原因,大大增加社会医疗负担。脓毒症的发病机制极其复杂,涉及免疫系统、凝血系统、炎症反应、代谢功能、神经内分泌系统等多种因素,尤其是机体免疫功能紊乱和炎症反应是脓毒症最主要的病理基础。机体受到外伤刺激时,大量细菌侵入,促使机体释放大量炎性介质以及细胞因子,引发全身性炎症反应[2];而炎症反应又可以刺激凝血酶系统异常活化,导致机体凝血功能失控,从而又进一步加重炎症反应的发展,形成恶性循环,最终诱发脓毒性休克和MODS[3]。而胃肠道作为机体内最重要的细菌储存库和免疫器官,最先受到细菌感染和炎症因子的浸润,不仅是SIRS的靶器官和启动器官,同时也是炎症反应的增强器,与MODS的发生密切相关[12]。因此,及时改善胃肠功能障碍对脓毒症的治疗和预后十分重要。目前临床上缺乏统一的关于合并胃肠功能障碍的脓毒症患者的治疗标准,主要采取常规治疗方案,包括改善肠道灌注、采用抗菌药物清除肠道感染致病菌、抗感染、胃肠减压、肠内营养支持、静脉补充血容量等对症治疗,但是单纯的西医治疗效果都不甚理想[13]。
基于笔者多年的临床经验,对合并胃肠功能障碍的脓毒症患者,可行结肠镜减压联合大黄选择性肠道去污,目前尚未见关于此方案的临床报道。SSD是指通过口服肠道不吸收的抗生素以减少肠道微生物,从而降低脓毒症患者的病死率以及呼吸机相关性肺炎的发生率,但其有一个致命的弱点,即会增加革兰耐药菌(如耐甲氧西林金葡菌)的感染率,此缺陷极大地限制了其在临床实际中的广泛应用,所以目前并不推荐SDD用于治疗脓毒症。而近些年,随着中医学的研究深入,越来越多的疾病建议采用中西医结合治疗。2013年,由中国中西医结合学会急救医学专业委员会提出的《脓毒症中西医结合诊疗专家共识》[14]中指出,对于热结肠腑患者建议采用大黄、芒硝、厚补等治疗。大黄素、黄酸、芦荟等是大黄主要的药理活性成分,不仅可以抑制大肠平滑肌酶活性,增加肠腔渗透压,对肠壁产生机械性刺激,且还具有胆碱样作用,通过兴奋平滑肌上M胆碱受体,促使肠蠕动;此外,大黄素还具有抗感染作用[15]。笔者建议可将大黄直接注入患处进行肠道去污,不仅提高药物的生物利用度和治疗效果,同时也避免口服对胃肠道的副作用[9-10]。
本课题符合发展中医药、规范抗菌药物临床应用、多学科合作的相关政策。结果显示,治疗组患者胃肠功能改善情况、临床疗效、血清炎症因子水平、继发性MODS发生率以及病死率均优于对照组,差异有统计学意义。
综上所述,结肠镜减压联合大黄肠道去污治疗合并胃肠功能障碍的脓毒症患者疗效确切,可改善患者的临床指征,在治疗脓毒症方面具有良好的应用前景。

