肝癌患者TACE治疗前后外周血PD-1、PD-L1的表达及临床意义*
程小珍,李晓东,王顺兰,谢宗宙,毛山山,朱燕兴,崔荣花,王美清
(1.中南大学湘雅医学院附属海口医院 肿瘤化疗科,海南 海口 570208;2.加州大学戴维斯分校-医学院 临床免疫研究室,美国 加州 CA95817;3.中南大学湘雅医学院附属海口医院 中心实验室,海南 海口 570208)
原发性肝癌的全球发病率呈上升趋势,预计到2020年肝癌新发病例将上升至95 374例[1]。在全球癌症死亡原因中排名第3位[2]。我国是肝癌的高发地,其发病率和病死率均占世界首位。原发性肝癌恶性程度高,早期多无明显的症状和体征,出现临床症状时多处于中晚期,导致约80%的患者就诊时已无法行根治性手术切除,非手术治疗以肝动脉介入栓塞化 疗(transcatheter arterial chemoembolization, TACE)为首选,生存期可获得明显延长。自2008年以来索拉非尼药物治疗成为晚期肝癌患者标准的一线治疗方法,能延长晚期肝癌患者近3个月生存期[3]。肝癌对放化疗均相对不敏感,治疗效果差,新兴的免疫治疗给肝癌患者带来新的曙光,近年来程序性死亡受体1(programmed death 1, PD-1)和程序性死亡配体(programmed death ligand 1, PD-L1)作为免疫治疗新的靶点成为国内外学者研究热点之一。
PD-1,又称CD279,为CD28免疫球蛋白超家族成员,是一种重要的免疫抑制分子。PD-L1,又称CD274或B7-H1(B7 homolog 1),是B7家族中一个负性T细胞共刺激分子。目前研究结果表明,表达于肿瘤细胞表面的PD-L1与表达于CD8+T细胞表面的受体PD-1的结合后,可以在体外抑制T细胞的增殖和细胞因子的产生,进而导致细胞毒性T淋巴细胞(cytotoxic T lymphocytes, CTL)的凋亡和耗竭,从而抑制机体的抗肿瘤免疫和介导肿瘤免疫逃逸的发生[4]。
关于PD-1与PD-L1的体内研究,目前主要集中在采用免疫组织化学来检测恶性肿瘤组织标本,关于恶性肿瘤治疗前后外周血PD-1和PD-L1表达变化的研究较少,目前尚未见文献关于肝癌患者介入治疗前后外周血PD-1和PD-L1表达变化及临床意义研究的报道。既往研究显示,多种恶性肿瘤组织如非小细胞肺癌[5-6]、胃癌[7]、肝癌[8]、乳腺癌[9]、宫颈癌等[10]患者组织标本中PD-1和PD-L1表达升高,且高水平PD-1和PD-L1可能与肿瘤的恶性程度高、肿瘤分期晚、预后差有关,但PD-L1与各种不同恶性肿瘤预后之间的相关性仍存在争议[11]。因原发性肝癌患者手术标本获取不易,本研究通过流式细胞术检测TACE治疗前后肝癌患者外周血CD4+T、CD8+T及抗原提呈细胞(antigen-presenting cells, APC)表面PD-1和PD-L1表达变化,并分析PD-1和PD-L1表达与患者细胞分化程度、疗效的关系,探讨PD-1和PD-L1与肿瘤进展及疗效的关系,为肝癌患者的免疫治疗提供更多的理论依据。
1 资料与方法
1.1 研究对象
选取2014年1月—2016年12月中南大学湘雅医学院附属海口医院临床资料完整的28例有TACE治疗指征的中晚期肝癌患者(肝癌组)。均经临床及病理组织学检查确诊为原发性肝癌,且无手术指征。其中,男性25例,女性3例;年龄36~71岁,中位年龄57岁;病理类型均为肝细胞癌,高-中分化16例,低分化12例。所有患者肝、肾、心、肺功能基本正常,KPS评分>60分,预计生存期>3个月,且无合并自身免疫性疾病。所有患者或法定代理人知情并签署知情同意书,并报本院医学伦理委员会批准。选取同时期体检的年龄、性别相匹配的健康志愿者20例为对照组。
1.2 材料与方法
1.2.1 主要试剂与材料 荧光抗体PerCP-Cy5.5-CD4、APC-H7-CD8、PE-PD-1、PE-Cy7-PD-L1、APC-CD85g(ILT7)、FITC-CD149(美国BD 公司),红细胞裂解液(FACS Lysing Solution,美国BD公司)、淋巴细胞分离液(美国Cell Grow公司),FACS Canto流式细胞仪(美国BD公司)。
1.2.2 TACE治疗 所有患者均采用Seldinger技术经股动脉穿刺行动脉灌注化疗,化疗方案为:吡柔比星25~40 mg/m2+奥沙利铂100~130 mg/m2,将碘油与化疗药混匀制成乳剂行远侧栓塞,依肿瘤的大小一般用碘油5~20 ml,注入适量的明胶海绵行近侧栓塞。
1.2.3 PD-1和PD-L1检测 在TACE治疗前、治疗后1个月内采集肝癌患者外周血5~10 ml。流式管加混匀全血80 μl,加预先按比例混合的荧光抗体(18 μl,共6种),蜗旋混匀,避光室温45 min;加1.2 ml红细胞裂解液,蜗旋1 min,避光室温15 min;2 100 r/min离心5 min,弃上清液,加PBS 1.5 ml,蜗旋,2 100 r/min离心5 min,弃上清液,加300~400 μl固定液(1%多聚甲醛PFA,4℃保存),2 h内上机检测。
1.3 疗效评价
治疗前1周、治疗后3个月评价疗效,常规行肝脏彩超/CT/MRI、胸部CT检查,对比治疗前后肿瘤大小变化。按《常见恶性肿瘤诊治规范》来评价肝癌患者的疗效,显效(PR):肿瘤缩小<50%;有效(PC):肿瘤缩小介于25%~50%;稳定(NC):肿瘤缩小>25%;进展(PD):肿瘤增大>25%,并有新病灶出现。
1.4 统计学方法
数据分析采用SPSS 21.0统计软件,计量资料以均数±标准差(±s)表示,组间数据的比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组外周血PD-1、PD-L1表达比较
肝癌组患者外周血CD4+PD-1、CD8+PD-1、APC PD-1、CD4+PD-L1、CD8+PD-L1及 APC PD-L1表达差异有统计学意义(P<0.05),肝癌组均高于对照组。见表1。
2.2 肝癌组治疗前后外周血PD-1、PD-L1表达比较
肝癌组患者经TACE治疗后1个月内外周血CD4+T、CD8+T及APC表面PD-L1水平与治疗前比较,差异有统计学意义(P<0.05),治疗后较治疗前下降,CD4+T、CD8+T及APC表面PD-1表达也较治疗前下降,但差异无统计学意义(P>0.05)。见表2。
2.3 肝癌组外周血PD-1、PD-L1表达与肿瘤细胞分化程度的关系
细胞分化差的肝癌组患者外周血PD-1、PD-L1表达较高,以CD8+T细胞表面的PD-1、PD-L1表达升高最明显,差异有统计学意义(P<0.05)。见表3。
2.4 PD-1、PD-L1表达与疗效的关系
肝癌组患者经TACE治疗后3个月,治疗有效(PR+PC+NC)的患者有15例,肿瘤进展(PD)的13例,其中肿瘤进展者PD-L1表达高于治疗有效的患者,CD8+PD-L1表达升高比较明显,差异有统计学意义(P<0.05)。见表 4。
表1 两组外周血PD-1、PD-L1表达比较 (±s)
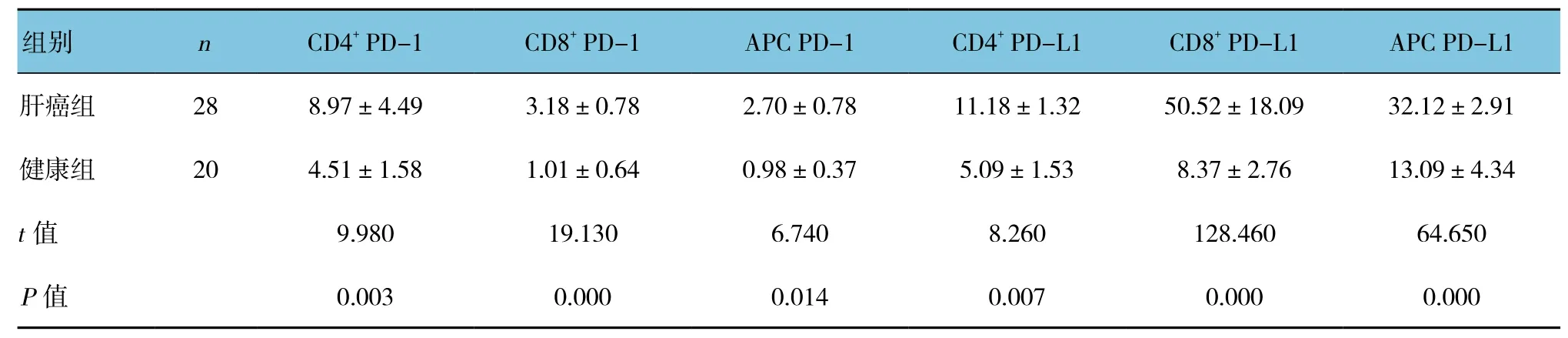
表1 两组外周血PD-1、PD-L1表达比较 (±s)
组别 n CD4+ PD-1 CD8+ PD-1 APC PD-1 CD4+ PD-L1 CD8+ PD-L1 APC PD-L1肝癌组 28 8.97±4.49 3.18±0.78 2.70±0.78 11.18±1.32 50.52±18.09 32.12±2.91健康组 20 4.51±1.58 1.01±0.64 0.98±0.37 5.09±1.53 8.37±2.76 13.09±4.34 t值 9.980 19.130 6.740 8.260 128.460 64.650 P值 0.003 0.000 0.014 0.007 0.000 0.000
表2 肝癌组治疗前后外周血PD-1、PD-L1表达比较 (n =28,±s)
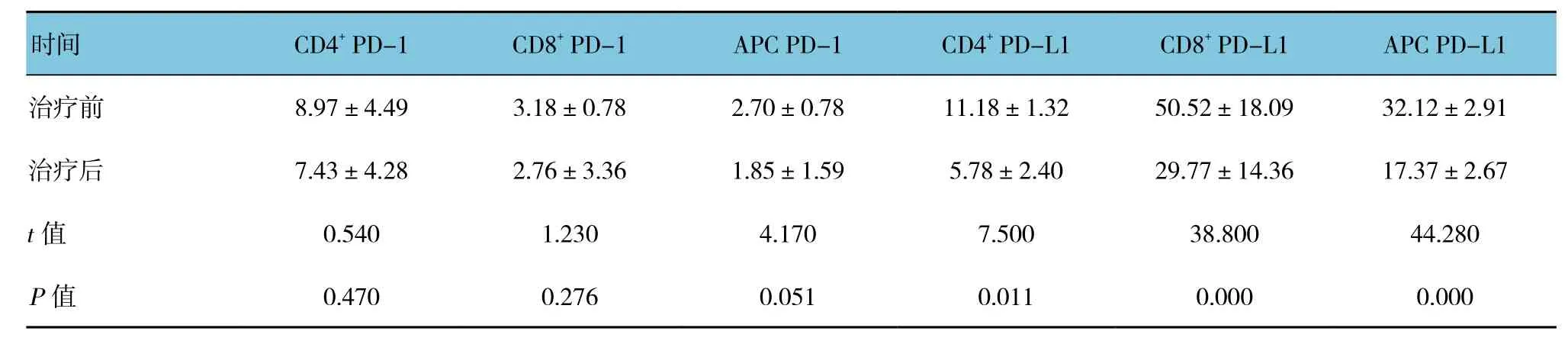
表2 肝癌组治疗前后外周血PD-1、PD-L1表达比较 (n =28,±s)
时间 CD4+ PD-1 CD8+ PD-1 APC PD-1 CD4+ PD-L1 CD8+ PD-L1 APC PD-L1治疗前 8.97±4.49 3.18±0.78 2.70±0.78 11.18±1.32 50.52±18.09 32.12±2.91治疗后 7.43±4.28 2.76±3.36 1.85±1.59 5.78±2.40 29.77±14.36 17.37±2.67 t值 0.540 1.230 4.170 7.500 38.800 44.280 P值 0.470 0.276 0.051 0.011 0.000 0.000
表3 肝癌组外周血PD-1、PD-L1表达与肿瘤分化程度的关系 (±s)
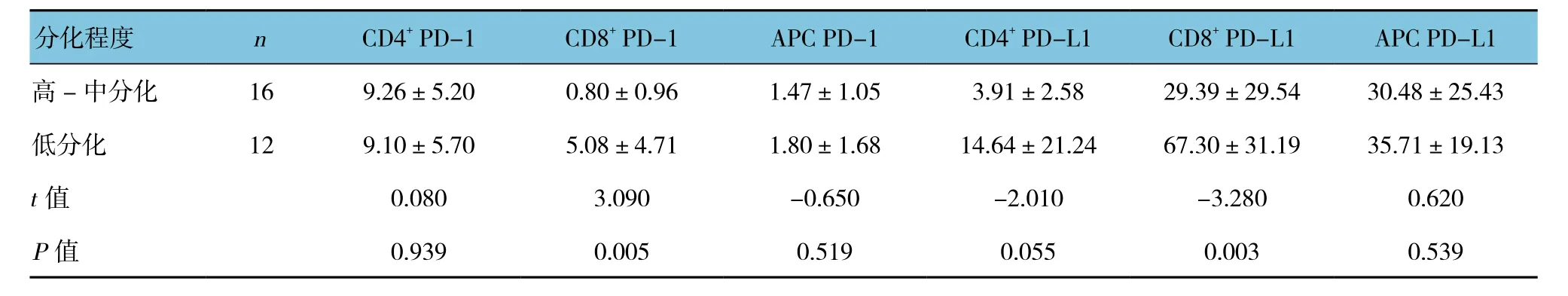
表3 肝癌组外周血PD-1、PD-L1表达与肿瘤分化程度的关系 (±s)
分化程度 n CD4+ PD-1 CD8+ PD-1 APC PD-1 CD4+ PD-L1 CD8+ PD-L1 APC PD-L1高 - 中分化 16 9.26±5.20 0.80±0.96 1.47±1.05 3.91±2.58 29.39±29.54 30.48±25.43低分化 12 9.10±5.70 5.08±4.71 1.80±1.68 14.64±21.24 67.30±31.19 35.71±19.13 t值 0.080 3.090 -0.650 -2.010 -3.280 0.620 P值 0.939 0.005 0.519 0.055 0.003 0.539
表4 肝癌组外周血PD-1、PD-L1表达与疗效的关系 (±s)
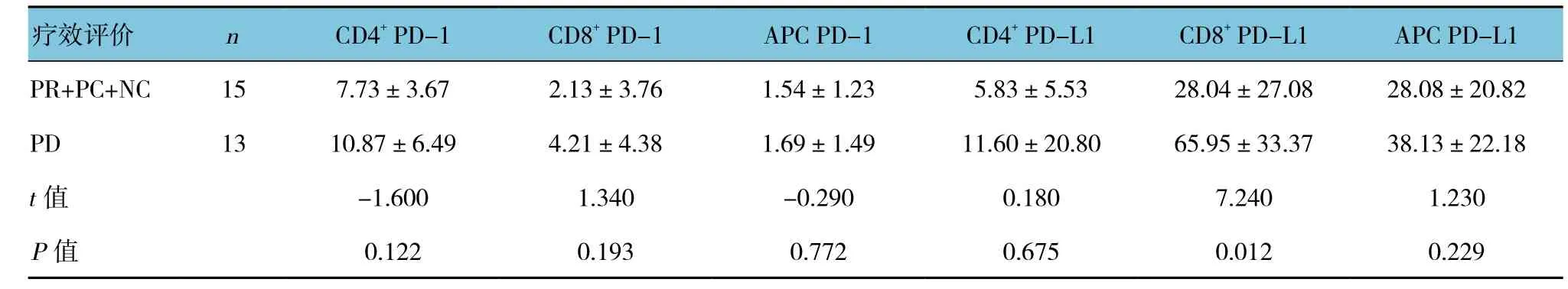
表4 肝癌组外周血PD-1、PD-L1表达与疗效的关系 (±s)
疗效评价 n CD4+ PD-1 CD8+ PD-1 APC PD-1 CD4+ PD-L1 CD8+ PD-L1 APC PD-L1 PR+PC+NC 15 7.73±3.67 2.13±3.76 1.54±1.23 5.83±5.53 28.04±27.08 28.08±20.82 PD 13 10.87±6.49 4.21±4.38 1.69±1.49 11.60±20.80 65.95±33.37 38.13±22.18 t值 -1.600 1.340 -0.290 0.180 7.240 1.230 P值 0.122 0.193 0.772 0.675 0.012 0.229
3 讨论
原发性肝癌恶性程度高、治疗效果差、危害大,目前尚无特效的治疗方法和有效的疗效监测指标,综合使用介入、化疗、免疫、分子靶向等治疗是目前提高肿瘤局部控制率、改善疗效、延长生存期的主要方法,迫切需要新的治疗手段来改善患者预后。PD-1和PD-L1是一对负性免疫共刺激分子,因其参与T淋巴细胞活化、介导肿瘤免疫逃逸,近年来成为国内外学者的研究热点,也是肿瘤免疫治疗的靶点之一。
生理情况下,组织细胞表面的PD-L1与淋巴细胞表面的PD-1结合后,可抑制淋巴细胞功能,诱导活化的淋巴细胞凋亡,在维持外周T淋巴细胞耐受和调节炎症反应发挥重要作用,从而避免自身免疫性疾病的发生[13]。到目前为止,应用免疫组织化学方法已经在多种恶性肿瘤组织表面检测到PD-L1高表达,PD-L1可与肿瘤浸润淋巴细胞表面的PD-1结合,可抑制淋巴细胞的功能及诱导其发生凋亡,从而抵抗淋巴细胞对肿瘤细胞的杀伤作用,最终导致肿瘤发生免疫逃逸[14]。但PD-1和PD-L1表达与各种恶性肿瘤患者预后关系尚不明确,比如在肝癌、胃癌患者中高表达PD-L1患者预后不良,在乳腺癌患者中高表达PD-L1则对预后有益,而在非小细胞肺癌[15-16]中高表达PD-L1预测预后作用存在争议。
本研究通过流式细胞仪检测发现,肝癌组患者外周血CD4+T、CD8+T及APC表面PD-1、PD-L1表达高于对照组,与既往研究结果一致[17-18]。本研究还发现,肝癌组患者治疗前PD-1和PD-L1表达升高,经过治疗后PD-1和PD-L1表达下降,与ZENG等[19]的研究结果一致,但PD-L1表达下降较明显,且PD-1、PD-L1表达与肿瘤组织分化程度有关,肿瘤细胞分化差的患者外周血PD-1、PD-L1表达较高。因本研究样本例数较少,未能进一步分析PD-1、PD-L1表达与患者年龄、性别、AFP等指标之间的关系,需要在今后进一步加大样本量来研究,以获得更多的关于PD-1和PD-L1表达与患者临床生物学特征之间相关性的信息。本研究还发现,经治疗后疗效好的患者外周血PD-1、PD-L1表达较低,考虑治疗后疗效好的患者体内肿瘤负荷减少更明显所致,动态监测外周血PD-1和PD-L1表达可能预测患者疗效。既往有研究报道PD-L1表达与患者肿瘤的侵袭性、血管侵犯等有关,考虑细胞分化差、恶性程度高的肿瘤侵袭性更强、更容易出现血管侵犯,也更容易出现远处转移和疾病不容易控制[20-21]。笔者推测,TACE阻断肿瘤血管可能减少肿瘤细胞浸润,进一步降低PD-L1表达,对于治疗效果不好的患者联合使用抑制肿瘤血管生成的药物可能可以进一步降低PD-L1表达,从而可能进一步增加治疗效果。
综上所述,肝癌患者外周血PD-1、PD-L1表达升高,且与细胞分化、治疗效果有关,严密及动态监测患者外周血PD-1、PD-L1表达变化可能可以预测患者疗效、预后情况,同时可能根据PD-1、PD-L1表达与患者更多的临床生物学特征筛选出对TACE及免疫治疗效果更好的病例,为肝癌患者免疫治疗提供理论基础。

