磷酸化表皮生长因子受体表达与糖尿病皮肤病变关系的实验研究
王力,何扬 ,赵东波,陈树梅,袁琳 ,王晓迪
(1.珠海市人民医院 内分泌代谢科,广东 珠海 519000;2.杭州师范大学健康管理系,浙江 杭州 311121)
表皮生长因子受体(epidermal growth factor receptor,EGFR)在体内含量广泛,属于ErbB受体家族[1],是一种位于细胞膜的跨膜受体蛋白,它与配体表皮生长因子(epidermal growth factor, EGF)结合后,启动体内一系列信号传递,从而促进细胞的生长、增殖与分化,是一种受体酪氨酸激酶[2-4]。糖尿病可引发多种并发症,皮肤病是一种常见并发症。糖尿病患者皮肤具有易感性,皮肤组织在无外源性创伤的情况下,其细胞、生长因子、细胞外基质等就已经发生改变,这种“隐形损害”可导致糖尿病创面形成甚至长期不愈。皮肤稳态失衡和形态结构变化可导致病变,例如皮肤发黄干燥。EGFR在糖尿病患者体内许多组织中数量、性质及表达发生改变[5-6]。有研究认为[7-8],糖尿病患者皮肤中葡萄糖含量增高,皮肤的屏障作用降低,使患者易感染皮肤病,而关于这种易感性与EGFR是否有关的报道很少。
本研究通过链脲佐菌素复制大鼠糖尿病模型,测定皮肤中糖和糖基化终末产物(advanced glycation end products, AGEs)的含量及磷酸化表皮生长因子受体(pEGFR)表达水平,观察大鼠皮肤组织病理学变化,研究pEGFR表达与糖尿病皮肤病变关系,探讨其机制,为糖尿病并发皮肤病的治疗提供实验依据。
1 材料与方法
1.1 动物与试剂
清洁级健康成年SD雄性大鼠,体重(200±20)g(山东鲁抗医药股份有限公司实验动物中心)。链脲佐菌素STZ(美国 Sigma公司),SP试剂盒(南京建成公司),pEGFR抗体、抗pEGFR抗体、抗AGEs抗体(美国 Cell Signaling公司)。
1.2 方法
1.2.1 糖尿病大鼠模型的复制 80只SD大鼠随机分为两组:模型组50只,腹腔注射STZ,72 h后随机测量,血糖量≥16 mmol/L为复制模型成功;对照组30只,注射等体积的枸橼酸缓冲液。在复制模型后的第3天、第1、2、4、8周5个时间点处死动物,取背部皮肤组织4份分别行糖含量、AGEs、EGFR检测及HE染色观察。
1.2.2 糖含量检测 分别取等量(约0.1 g)皮肤组织块,剪碎后加入预冷的Ba(OH)2,匀浆,3 000 r/min离心10 min后,取上清液,Beckman's 生化自动分析仪检测糖含量[9]。糖含量计算公式如下:
糖含量(mg/g)=上清液体积(ml)×糖浓度(mmol/L)×180×103/皮肤组织块重量(g)
1.2.3 AGEs检测 配制皮肤胶原提取液,通过酶促反应和显色反应,计算提取液中的羟脯氨酸含量来反映胶原含量,再用荧光分光光度计对糖基化胶原蛋白的荧光进行自显影,通过糖基化胶原蛋白荧光值来反映AGEs含量。利用免疫组织化学和抗AGEs单克隆抗体检测AGEs的在皮肤组织中的蓄积部位和密度。
1.2.4 免疫组织化学检测皮肤组织中EGFR蛋白表达取下0.5 cm×0.5 cm的皮肤经4%甲醛固定、脱水、透明、浸蜡、包埋、切片、脱蜡、抗原修复,免疫组织化学染色按照试剂盒说明步骤进行,光学显微镜下拍照。
1.2.5 Western blotting检测皮肤组织中pEGFR蛋白表达 提取皮肤组织中的总蛋白,SDS-PAGE电泳分离不同蛋白,将其转移至硝酸纤维薄膜上,室温下脱脂奶粉封闭2 h,磷酸盐吐温缓冲溶液(PBS-T)冲洗,加入一抗4℃过夜,再加入辣根过氧化酶标记的二抗,室温下孵育2 h,PBS-T冲洗,辣根过氧化酶显色,Bio-Rad Co.生物医学图像分析系统对硝酸纤维膜上的目的条带进行扫描和光密度(OD)值分析。
1.2.6 组织学观察 取0.5 cm×0.5 cm的皮肤经4%甲醛固定、脱水、透明、浸蜡、包埋、切片、HE染色,观察皮肤形态结构及病理变化。光学显微镜目镜测微尺测量皮肤表皮的厚度,测得多个部位求平均值。
1.3 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,组间均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组大鼠平均血糖值比较
复制模型第3天,检测各组大鼠血糖值,糖尿病模型组大鼠平均血糖值为(22.85±5.21)mmol/L,对照组平均血糖值为(8.95±2.10)mmol/L,两组比较差异有统计学意义(t=8.238,P=0.000),糖尿病大鼠血糖值均在16.00 mmol/L以上,复制模型成功。
2.2 模型组大鼠形态
复制糖尿病模型成功的模型组大鼠2周后毛色暗黄,体重下降,皮肤变薄,尿量增多,精神萎靡。
2.3 两组大鼠皮肤组织中的糖和AGEs含量比较
模型组大鼠皮肤组织中的糖含量和糖基化胶原蛋白荧光值均高于对照组,且模型组在第2、4、8周时与对照组比较,差异有统计学意义(P<0.05),模型组高于对照组(见表1)。免疫组织化学结果显示,AGEs在大鼠背部皮肤真皮基质中大量表达,且分布广泛,甚至连接成片,而正常大鼠表达量较少,且染色较浅。
2.4 pEGFR蛋白的表达
免疫反应呈阳性,pEGFR在皮肤组织的细胞膜和细胞内均有表达,在细胞核中也有少量表达,镜下观察可见糖尿病大鼠在2周后染色区域减少且浅染,随着病程的发展,浅染区域越来越少(见图1)。Western blotting结果见图2,对照组与糖尿病模型组在不同时间点均有pEGFR蛋白杂交带,说明有pEGFR的表达;OD值分析显示:糖尿病模型组的OD值均比同一时间对照组值小,并且在第4、8周时与对照组比较差异有统计学意义(P<0.05)。见表2。
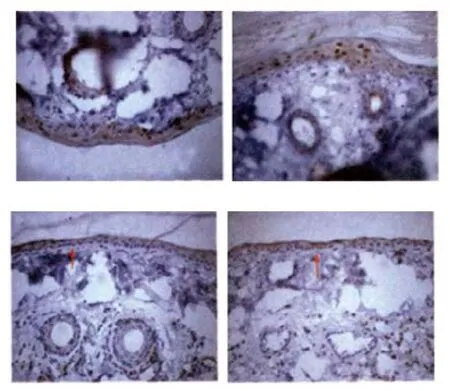
图1 pEGFR蛋白表达 (免疫组织化学×400)
表1 两组大鼠皮肤中糖含量及糖基化胶原蛋白荧光值比较 (±s)
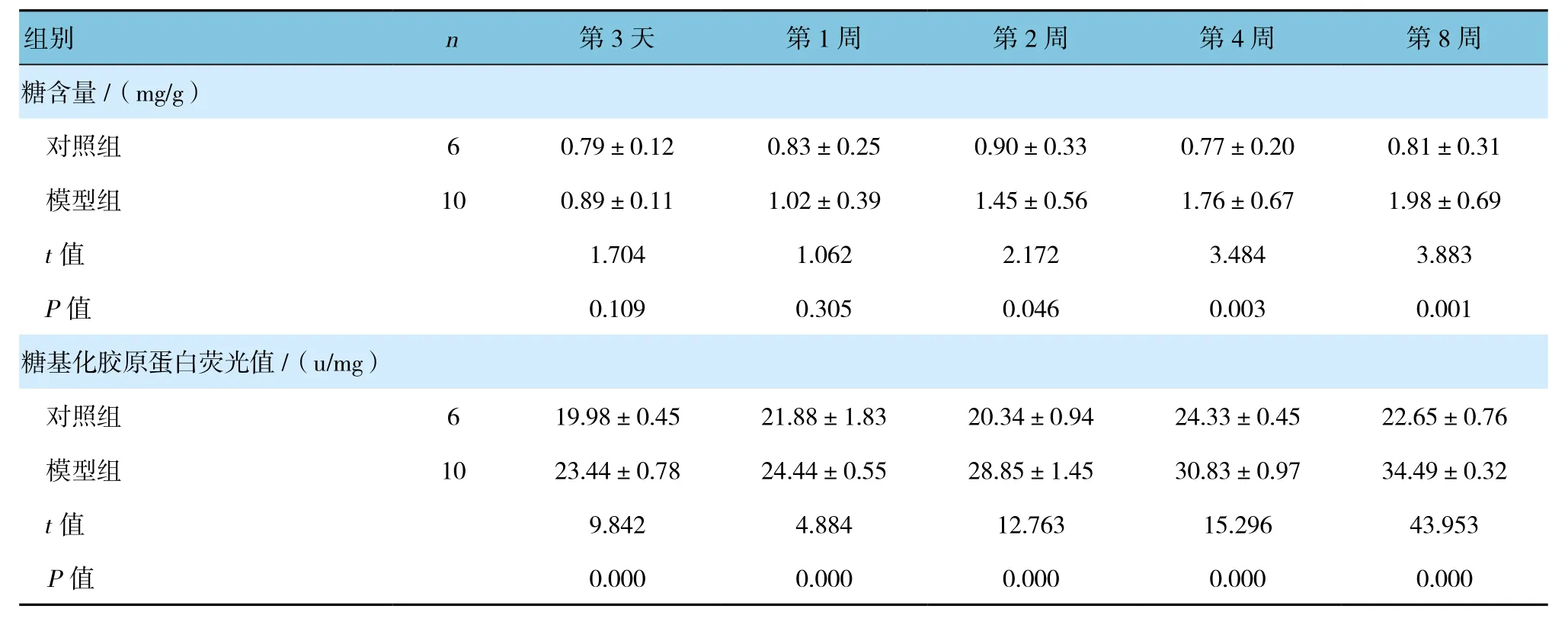
表1 两组大鼠皮肤中糖含量及糖基化胶原蛋白荧光值比较 (±s)
组别 n 第3天 第1周 第2周 第4周 第8周糖含量/(mg/g)对照组 6 0.79±0.12 0.83±0.25 0.90±0.33 0.77±0.20 0.81±0.31模型组 10 0.89±0.11 1.02±0.39 1.45±0.56 1.76±0.67 1.98±0.69 t值 1.704 1.062 2.172 3.484 3.883 P值 0.109 0.305 0.046 0.003 0.001糖基化胶原蛋白荧光值/(u/mg)对照组 6 19.98±0.45 21.88±1.83 20.34±0.94 24.33±0.45 22.65±0.76模型组 10 23.44±0.78 24.44±0.55 28.85±1.45 30.83±0.97 34.49±0.32 t值 9.842 4.884 12.763 15.296 43.953 P值 0.000 0.000 0.000 0.000 0.000
2.5 组织病理学观察
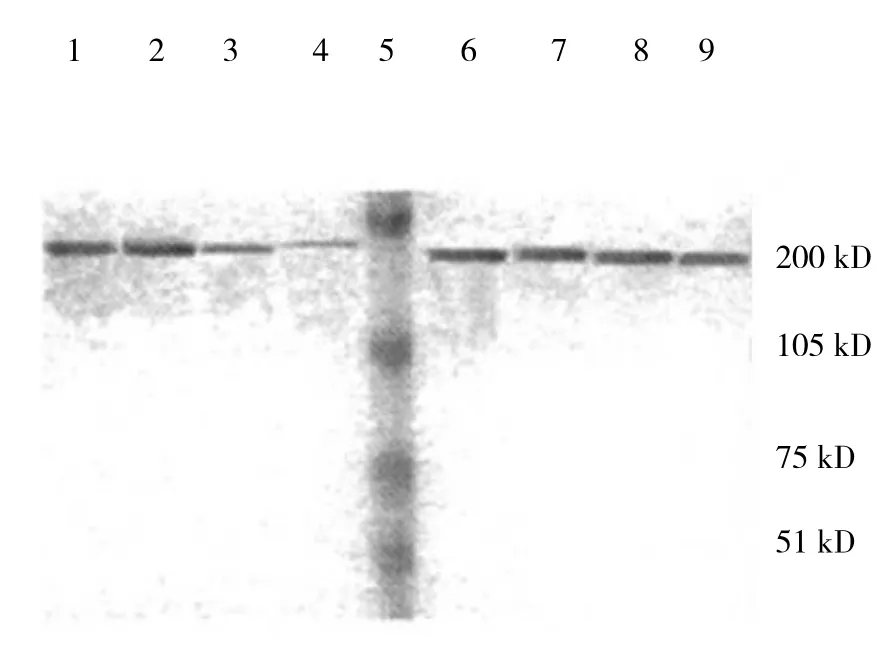
图2 两组大鼠western blotting结果
组织切片观察发现在第3天、第1周时皮肤结构变化不明显,2周后表皮变薄,在第4、8周时可见复层排列部分消失(见图3)。其厚度与对照组比较差异有统计学意义(P<0.05),见表3。真皮具有萎缩、炎症细胞浸润现象,皮下脂肪部分萎缩甚至消失。
表2 两组大鼠pEGFR表达比较 (±s)
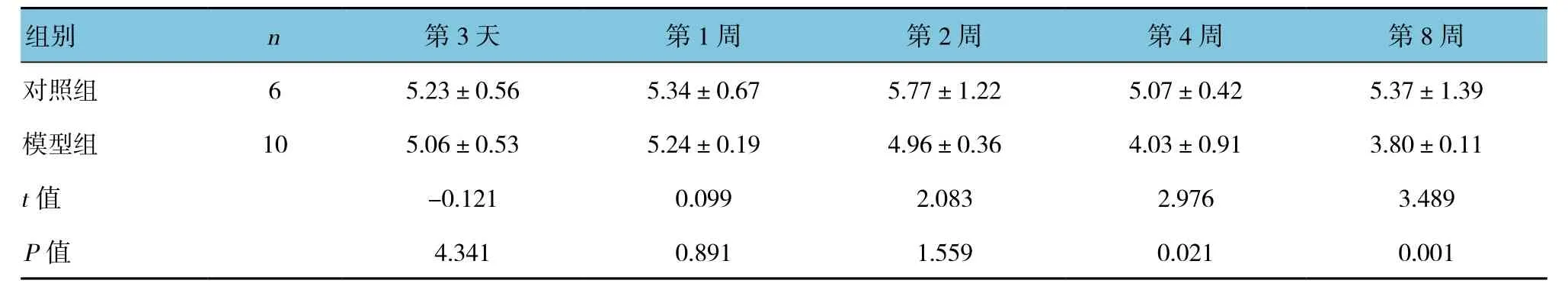
表2 两组大鼠pEGFR表达比较 (±s)
组别 n 第3天 第1周 第2周 第4周 第8周对照组 6 5.23±0.56 5.34±0.67 5.77±1.22 5.07±0.42 5.37±1.39模型组 10 5.06±0.53 5.24±0.19 4.96±0.36 4.03±0.91 3.80±0.11 t值 -0.121 0.099 2.083 2.976 3.489 P值 4.341 0.891 1.559 0.021 0.001
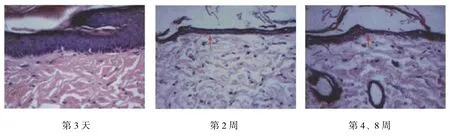
图3 大鼠组织切片 (HE×200)
表3 两组大鼠表皮厚度比较 (μm,±s)
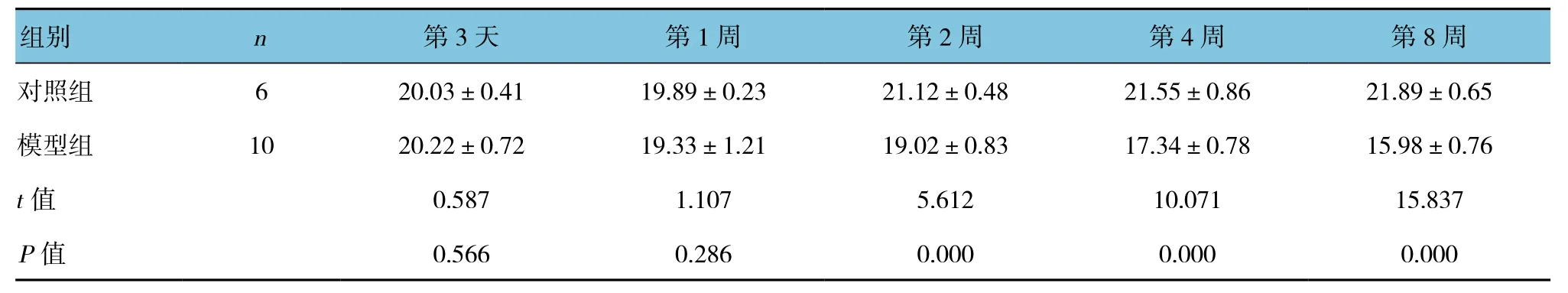
表3 两组大鼠表皮厚度比较 (μm,±s)
组别 n 第3天 第1周 第2周 第4周 第8周对照组 6 20.03±0.41 19.89±0.23 21.12±0.48 21.55±0.86 21.89±0.65模型组 10 20.22±0.72 19.33±1.21 19.02±0.83 17.34±0.78 15.98±0.76 t值 0.587 1.107 5.612 10.071 15.837 P值 0.566 0.286 0.000 0.000 0.000
3 讨论
近年来,糖尿病患者逐年增加,其并发症也日益增多[10]。糖尿病可引起皮肤隐形损害,这种内源性的损害使皮肤具有易感性,使得机体免疫功能低下严重者可导致皮肤并发症的产生,加重疾病治愈的难度[11]。
本研究对大鼠皮肤组织中的糖含量及AGEs进行检测,发现皮肤组织中2种指标均增高,AGEs是由还原性糖和蛋白质或氨基酸生成的复杂混合物。免疫组织化学和Western blotting结果显示皮肤中pEGFR表达减少,大鼠皮肤组织病理切片发现表皮变薄,并且随时间的增加越来越明显,出现炎症细胞浸润,真皮萎缩,胶原排列紊乱,皮下脂肪萎缩消失。由此可见,糖尿病大鼠由于糖代谢障碍而导致皮肤组织中糖含量增加,高糖环境进而使AGEs蓄积。有研究表明[13],糖尿病患者皮肤组织中EGFR数量、性质发生改变。EGF并不是EGFR的唯一配体,AGEs前体物质甲基乙二醛和乙二醛均可与EGFR形成受体复合物,从而抑制EGFR磷酸化,阻碍受体酪氨酸二聚化,阻断下游信号途径的传导[14],从而导致皮肤隐性损害的产生。糖尿病患者皮肤组织中的糖含量及AGEs含量均增高,因此高糖代谢产物可拮抗性的与EGFR结合,抑制了EGF与其结合,从而阻碍其作用的发挥[15]。
综上所述,由于pEGFR的减少而导致信号通路传递障碍是糖尿病造成皮肤隐性损害和皮肤并发症发生的重要机制之一,为预防和治疗糖尿病并发的皮肤病提供理论依据。

