铵态氮肥鉴别实验的探究和讨论
章昊 沈正斌


摘要:人教版九年级教材介绍了铵态氮肥鉴别的具体实验方案,但是学生在作业和考试中总写出不同于教材的实验方案,而这些方案是否真的符合客观事实有待考究。所以,作者组织学生通过一系列的对比实验来探究和拓展铵态氮肥的鉴别,培养学生的实事求是和科学创新的精神。
关键词:铵态氮肥鉴别;对比实验;实验探究;科学素养
文章编号:1008-0546(2019)01-0087-02中图分类号:G633.8文献标识码:B
doi:10.3969/j.issn.1008-0546.2019.01.027
一、问题的提出
人教版九年级化学第十一单元课题二“化肥的简易鉴别”探究实验中,介绍了铵态氮肥鉴别的具体方案,即取少量化肥于研钵中,分别加入少量熟石灰粉末,混合研磨,若能闻到氨味的是铵态氮肥,反之则不是。同时,教材下的备注也从原理上揭示了铵盐能与碱反应,放出氨气,据此检验铵态氮肥 [1]。但是,笔者在平时批改作业和阅卷的过程中,发现很多学生鉴别铵态氮肥时虽然抓住了反应的本质NH+4+OH-■H2O+NH3↑,却设计出形式多样的实验方案,如取少量化肥于试管中配成溶液,与氢氧化钙溶液混合,若有气泡产生/闻到刺激性气味的是铵态氮肥,反之则不是;取少量化肥于研钵中,加入少量NaOH固体,混合研磨,若产生使湿润的pH试纸/湿润的红色石蕊试纸变蓝的气体,则该化肥是铵态氮肥,反之则不是。这样的答案让阅卷教师很为难,因为它虽然符合原理,可是又不知道是否符合客观事实,我查阅相关教参和中国知网等数据库,也没有相关报道。因此,针对这个困惑,我让写出不同答案的学生分组实验,自主探究,完成实验报告,做了一系列的铵态氮肥鉴别实验,以供各位同行参考。
二、实验准备
实验仪器及药品:研钵,研杵,试管/托弗管,酒精灯,试管夹,药匙,电子天平,NH4Cl固体,KCl固体,Ca(OH)2固体,NaOH固体,Na2CO3固体,K2CO3固体,蒸馏水,pH试纸,红色石蕊试纸。
三、实验步骤和现象
1.实验1
(1)分别取1g NH4Cl固体和1g KCl固体于研钵中,加入1g熟石灰粉末/NaOH固体混合研磨,5分钟后将湿润的pH试纸/湿润的红色石蕊试纸放在研钵上方,觀察现象。
含有NH4Cl固体的研钵中可以闻到明显的氨味,同时湿润的pH试纸/湿润的红色石蕊试纸立即变蓝甚至变成黑色;有KCl固体的研钵中则没有明显的现象。
(2)分别取1g NH4Cl固体于两个研钵中,一个研钵中加入1g熟石灰粉末混合研磨,而另一个研钵中只加熟石灰粉末混合,却不研磨。每隔15分钟将湿润的pH试纸放在研钵上方,观察现象。
混合且研磨的研钵中,可以闻到明显的氨味,同时,湿润的pH试纸立即变蓝(见图1);只混合不研磨的研钵中,整个过程几乎闻不到氨味,2小时后湿润的pH试纸才开始略微变色(见图2)。
2.实验2
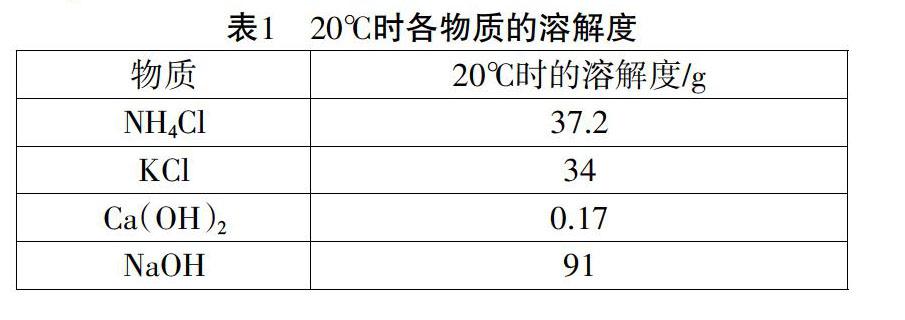
用电子天平称取3.72g NH4Cl固体、3.4g KCl固体、0.017g Ca(OH)2固体和9.1g NaOH固体,分别充分溶于10mL蒸馏水中配成饱和溶液。
(1)各取2mL NH4Cl和KCl饱和溶液于托弗管中,分别加入2mL饱和Ca(OH)2溶液/饱和NaOH溶液,充分混合,将湿润的pH试纸放在管口,观察现象。
饱和NH4Cl溶液+饱和NaOH溶液的托弗管中没有闻到明显的氨味,也没有看到明显的气泡(见图6),几分钟后,管口湿润的pH试纸变蓝(见图3)。十几分钟后,饱和NH4Cl溶液+饱和Ca(OH)2溶液的管口可以看到湿润的pH试纸开始变蓝(见图4);有KCl饱和溶液的托弗管没有明显的现象(见图5)。
(2)各取2mL饱和NH4Cl和KCl溶液于托弗管中,分别加入2mL饱和Ca(OH)2溶液/饱和NaOH溶液,充分混合,加热,将湿润的pH试纸放在管口,观察现象。
饱和NH4Cl溶液+饱和NaOH溶液的托弗管中没有闻到明显的氨味,湿润的pH试纸立即变蓝。饱和NH4Cl溶液+饱和Ca(OH)2溶液的管口几分钟后才开始变蓝;有KCl饱和溶液的托弗管没有明显的现象。
(3) 将上述配制好的饱和NH4Cl、KCl、Ca(OH)2、NaOH溶液分别稀释10倍、20倍、30倍。然后将对应稀释的NH4Cl溶液分别和Ca(OH)2、NaOH溶液混合,将对应稀释的KCl溶液和Ca(OH)2、NaOH溶液混合,将湿润的pH试纸放在管口,观察现象。
有NH4Cl溶液的托弗管中没有闻到明显的氨味,10倍稀释的NaOH溶液的管口湿润的pH试纸逐渐变蓝,20倍和30倍稀释的NaOH溶液和Ca(OH)2溶液的管口均没有明显现象;有KCl饱和溶液的托弗管没有明显的现象。
(4)各取2mL饱和NH4Cl和KCl溶液于托弗管中,分别加入2mL饱和Na2CO3溶液/饱和K2CO3溶液,充分混合,将湿润的pH试纸放在管口,观察现象。
含有饱和NH4Cl溶液的托弗管中没有闻到明显的氨味,也没有看到明显的气泡,但是,几分钟后,管口湿润的pH试纸变蓝;含有KCl饱和溶液的托弗管没有明显的现象。
四、实验结果和讨论
(1)通过实验1(1)和实验2(1)的对比,可以明显看出,教材中提出的固相研磨方案要优于学生提出的液相混合方案,因为固相研磨的操作更简便,现象更明显。
(2)通过1(2)的对比实验,可以看出固相研磨方案中研磨的操作必不可少。铵态氮肥和碱的混合虽然是一个自发的反应,但是反应速度太慢。研磨过程增大了反应物的接触面积,使反应更快更充分。
(3)虽然铵盐溶液和碱溶液混合产生氨气,但是,通过实验2可以发现,液相混合的过程中并没有气泡产生,也很难闻到刺激性的氨味。主要有两个原因:首先,各物质的溶解度限制了它们的浓度,尤其是Ca(OH)2溶液常温下溶解度仅为0.17g,解离出的离子浓度很小。另外,氨气极易溶于水,在常温下,氨气的溶解度为700,产生的氨气又溶于水,因此看不到气泡。
(4) 从实验2(1)和2(2)都可以看出:NH4Cl溶液+NaOH溶液的反应要比NH4Cl溶液+Ca(OH)2溶液的反应现象明显的多。主要是因为相同条件下,Ca(OH)2微溶,溶解度较小,即使是饱和状态解离出的离子浓度仍然很小,而NaOH溶解度很大,且完全解离,所以现象更加明显。
(5) 通过实验2(1)和2(2)的对比同样可以看出:加热可以显著加快化学反应速度,因为升高温度可以提高各物质微粒的能量,使得有效碰撞次数增多,活化分子数目增多,从而加快化学反应速度 [2]。
(6)通过实验2(1)和2(3)的一系列对比实验可以看出:浓度在液相鉴别铵态氮肥时的重要性。浓度越大,现象越明显,而浓度很小时,几乎没有现象。这是因为NH+4和OH-可以少量共存。
(7)实验2(4)拓展了教材的内容,说明鉴别铵态氮肥不是只有碱,碱性的盐也可以,如Na2CO3/K2CO3,而且现象很明显。这是因为CO2-3 逐步水解產生OH-,CO2-3 +H2O■HCO-3+OH-,HCO-3+H2O■H2CO3+OH-,因此和NH+4无法大量共存,生成能使湿润的红色石蕊试纸/湿润的pH试纸变蓝的气体。
综上所述:鉴别铵态氮肥的实验方案可以是:
(1)取少量样品于研钵中,分别加入少量熟石灰粉末/NaOH固体/Na2CO3固体/K2CO3固体,混合研磨,若能闻到氨味的是铵态氮肥,反之则不是;若能产生使湿润的红色石蕊试纸或湿润的pH试纸变蓝的气体是铵态氮肥,反之则不是。
(2)取少量样品/样品溶液于试管中,分别加入浓NaOH溶液/浓Na2CO3溶液/浓K2CO3溶液,加热,若能产生使湿润的红色石蕊试纸或湿润的pH试纸变蓝的气体是铵态氮肥,反之则不是。
五、结束语
化学教育家戴安邦先生曾说:“化学实验是全面化学教育的一种最有效的教学形式。”学生在掌握化学反应本质的基础上,提出和教材不同的实验方案,这恰好是教学中“生成性”问题的源泉,是极好的教学素材。教师应该抓住时机,深化实验教学,引导学生自主探究,培养学生实验探究和创新意识的科学素养 [3]。让学生在实验中感受科学探究,让实验“开口说话”,最终获取真知。
参考文献
[1] 王晶,郑长龙主编.义务教育教科书·化学(九年级下册)[M].北京:人民教育出版社,2016
[2] 傅献彩.物理化学(第5版)[M].北京:高等教育出版社,2005
[3] 杨剑春,徐春芸.初中化学兴趣实验的评价[J].化学教与学,2013(5):5-7

