石榴皮多酚纯化物对LO2肝细胞的损伤影响
郑 欣, 刘 盟, 常占瑛, 马桂枝, 聂昌宏, 阿依居来克·卡得尔, 李欣荣, 高晓黎
(新疆医科大学1药学院; 2附属肿瘤医院药学部, 乌鲁木齐 830011)
石榴皮为石榴科植物石榴(PunicaranatumL.)的干燥果皮,味酸涩,药性温,其中主要的化学成为多酚类物质,含量可达25%~30%[1],具有抗炎[2]、抗肿瘤[3]的药理作用;临床多用于糖尿病[4]、腹泻、痢疾、疟疾以及肠道感染等多种疾病的治疗[5-7]。安石榴苷(punicalagin)是石榴皮多酚的主要成分,是石榴皮多酚类中分子量最大的化合物,具抗氧化、抑菌、抗癌等生物活性[8-10]。近年来中药及其有效成分引起肝脏损伤的病例越来越多[11]。肝脏是人体重要的代谢器官,是药物毒性作用的主要靶向器官,大多数药物的不良反应都会引发肝脏的损伤[12]。有研究表明,不同剂量石榴果皮提取物会对小鼠造成肝脏损伤[13]。LO2肝细胞是药物对人体肝损伤及机制研究的重要体外模型,利用体外肝细胞模型评估中药的肝毒性与体内实验存在良好的相关性[14]。本实验采用体外肝细胞模型,测定石榴皮多酚纯化物对LO2肝细胞的损伤作用,现报道如下。
1 材料
1.1仪器KS12型生物安全柜(美国Thermo公司),HERAcell 150i型CO2恒温培养箱(美国Thermo公司),SDPTOP型倒置显微镜(宁波舜宇仪器有限公司),4K1S型高速冷冻离心机(美国Sigma公司),Multiskan GO型全波长酶标仪(美国Thermo公司),C2型激光扫描共聚焦显微镜(日本Nikon公司)
1.2试剂RPMI-1640培养基(美国Hyclone公司,批号:AD21582265),胎牛血清(美国Gibco公司,批号:1699800),胰蛋白酶消化液(美国Hyclone公司,批号:J170041),双抗(美国Hyclone公司,批号:J150038),PBS缓冲液(美国Hyclone公司,批号:AC13716274),CCK8细胞增殖检测试剂盒(日本Dojindo公司,批号:KR675),丙氨酸氨基转移酶(ALT)检测试剂盒、碱性磷酸酶(ALP)检测试剂盒、天冬氨酸氨基转移酶(AST)检测试剂盒(南京建成生物有限公司,批号:20180808),Hoechhst-33258染色液(中国Solarbio公司,批号:20171208)
1.3细胞人正常肝细胞系LO2(上海中乔新舟生物科技有限公司)。
1.4药材石榴皮2017年9月购自和田麦迪森药业有限公司,经新疆医科大学药学院帕丽达·阿不力孜教授鉴定为石榴科石榴属植物石榴(PunicagranatumL.)的干燥果皮。石榴皮多酚纯化物(新疆医科大学实验室自制,安石榴苷含量HPLC≥82%)。
2 方法
2.1LO2肝细胞培养将LO2肝细胞培养于含有10%胎牛血清(FBS)和1%青霉素-链霉素抗体的RPMI-1640培养基中,置于37℃恒温、5%CO2的细胞培养箱中,每1~2天观察细胞状态和细胞密度,更换培养基,待细胞密度达到70%~85%时,用0.25%胰酶消化液对其进行消化、传代;在LO2肝细胞对数生长期进行实验,实验重复3次。
2.2CCK8法检测石榴皮多酚纯化物对LO2肝细胞的抑制作用取对数生长期的LO2肝细胞,0.25%胰酶消化液进行消化,用含10%FBS和1%双抗的RPMI-1640培养基配制细胞悬液,按5×103/孔接种于96孔板中,培养于37℃恒温、5%CO2的细胞培养箱中,待细胞贴壁后,弃培养液,加入不同浓度的石榴皮多酚纯化物(药物浓度为:3.125、6.250、12.500、25.000、50.000、100.000、200.000 μg/mL),并设置阴性组,每组设置6个复孔,药物干预24 h,每空加10 μL的CCK8试剂,放置培养箱孵育2 h,用酶标仪测定450 nm处的吸光度,计算药物对LO2肝细胞的细胞活力,细胞存活率/%=(药物组平均OD值/阴性组平均OD值)×100%,实验重复3次。
2.3细胞培养液中肝功能指标测定取对数生长期的LO2肝细胞,用0.25%胰酶消化液进行消化,用含10%FBS和1%双抗的RPMI-1640培养基配制细胞悬液,接种于6孔板中,每孔2 mL,培养于37℃恒温、5%CO2的细胞培养箱中,弃培养液,加入不同浓度的石榴皮多酚纯化物(药物浓度为:12.5、50.0、100.0 μg/mL),并设置阴性组,药物干预24 h后,吸取培养液,2 500 r/min离心10 min,收集上清液,按照ALT、AST、ALP试剂盒操作说明,测定LO2肝细胞上清液中的ALT、AST、ALP指标的含量,实验重复3次。
2.4Hoechst-33258荧光染色观察细胞凋亡情况取对数生长期的LO2肝细胞,用0.25%胰酶消化液进行消化,用含10%FBS和1%双抗的RPMI-1640培养基配制成1×105/mL的细胞悬液,接种于4孔板中,培养于37℃恒温、5%CO2的细胞培养箱中,待细胞贴壁后,弃培养液,加入不同浓度(12.5、50.0、100.0 μg/mL)的石榴皮多酚纯化物,设置阴性组(只加等量的培养基),药物干预24 h后,弃培养液,每孔加入300 μL的Hoechst-33258工作液,37℃孵育30 min,弃染色液,用PBS缓冲液冲洗2次,随后在激光扫描共聚焦显微镜下观察LO2肝细胞的凋亡情况并拍照。

3 结果
3.1石榴皮多酚纯化物对LO2肝细胞存活率的影响与阴性组比较,不同浓度药物组的OD值减小,不同浓度药物组的细胞存活率降低,差异有统计学意义(P<0.01),见表1。
3.2石榴皮多酚纯化物对LO2肝细胞ALT、AST、ALP含量的影响与阴性组比较,不同浓度药物组干预LO2肝细胞24 h后,LO2培养液中ALT、AST、ALP的含量均降低(P<0.05),见图1-3。
3.3石榴皮多酚对LO2肝细胞凋亡的影响激光扫描共聚焦显微镜观察,药物培养干预24 h后,阴性组细胞少见凋亡,细胞形态规则,细胞结构轮廓清晰且细胞呈分散均匀的低强度蓝光;药物组活细胞数量随给药浓度增大无明显变化,细胞形态正常,仅有少量细胞核、细胞质缩聚形成凋亡小体呈亮蓝色荧光,见图4。
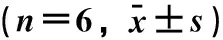
表1 石榴皮多酚纯化物对正常肝细胞LO2的增殖抑制率
注:与阴性组比较,**P<0.01。



图1 石榴皮多酚纯化物对ALT指标的影响




A: 阴性组
4 讨论
本实验以LO2肝细胞为研究对象,研究石榴皮多酚纯化物对LO2肝细胞的损伤作用,初步评价石榴皮多酚纯化物的体外安全性。药物细胞毒性的常规评估标准包括细胞增殖和生长、细胞形态、细胞膜完整性、细胞凋亡以及细胞代谢等[15-16]。体外细胞肝毒性通常表现在正常肝细胞活力下降、细胞形态受损、细胞膜受损通透性增加[17];评价细胞生长影响最常用方法为ATP、MTT、CCK8法[18],细胞膜的完整性通过检测相关酶类的含量[19]。本研究结果表明石榴皮多酚纯化物浓度小于100 μg/mL时,不会对LO2肝细胞产生损伤作用,当浓度大于100 μg/mL时,LO2肝细胞的存活率下降,可能是因为高浓度石榴皮多酚纯化物的生物活性影响到了LO2肝细胞生长,但均未达到IC50,表明石榴皮多酚纯化物对LO2肝细胞无毒性作用。相关酶(ALT、AST、ALP)的含量是评价肝损伤的主要生物指标[15],本研究通过测定肝功能相关酶ALT、AST、ALP的含量,发现石榴皮多酚纯化物不会损伤LO2肝细胞膜而导致相关酶的含量增高,说明石榴皮多酚纯化物对LO2肝细胞无损伤作用。细胞凋亡是细胞在某些药物等因素的干预下,通过调控细胞基因及产物所引起的程序性死亡;本研究通过Hoechst-33258染色法观察,石榴皮多酚纯化物干预LO2肝细胞后,LO2肝细胞的形态均正常,仅在高剂量药物组可见少量细胞核缩聚,染色加深,亮蓝色荧光的凋亡小体形成,表明石榴皮多酚纯化物对LO2肝细胞的无明显凋亡作用。综上所述,石榴皮多酚纯化物对体外培养LO2肝细胞无明显损伤影响,为石榴皮多酚纯化物的后续安全应用提供了理论依据。

