阿尔茨海默病与内侧颞叶萎缩视觉评分的研究概况
张桂美, 郭春杰, 牛 锴, 赵 檬综述, 孙 莉审校
阿尔茨海默病(Alzheimer’s Disease,AD)是老年期最常见的痴呆类型,随着年龄的增长,AD的发病率急剧增加,严重增加了社会负担,因此,早期发现、早期治疗极为重要[1,2]。2011年美国国立老化研究所和阿尔茨海默病协会对1984年提出的AD诊断标准[3]进行修订,将脑结构改变列为AD诊断的生物学标志物之一,它提到的脑结构改变主要指内侧(主要指海马)、外侧和底侧面颞叶以及内侧顶叶皮质萎缩[4]。内侧颞叶结构主要包括海马、海马旁回、内嗅皮质和嗅缘皮质[5~7],而内侧颞叶萎缩(medial temporallobe atrophy,MTA)主要指上述结构体积变小。经许多研究证实,MTA是AD中最早的脑萎缩模式,是早期诊断的敏感标志物,并且与疾病严重程度相关[8,9],还可以作为痴呆进展的预测因子[10~12]。因此如何利用方法简单、直观的影像学评价MTA情况尤为重要,为了达到这一目的,Scheltens等[13]于1992年提出了视觉评估MTA的方法,即视觉评分量表(Visual Rating Sscale,VRS)。近些年随着影像技术的飞速发展,视觉评分量表也逐渐完善,本文就目前关于AD与MTAVRS的研究进展做统一整理综述,以期建立AD的早期诊断技术和早期干预方案,这将对于AD治疗和预防具有重要的理论意义和实际应用价值。
1 MTA视觉评分相关概述及进展
1.1 经典的MTA视觉评分系统 Scheltens等[13]最先提出了MTA的视觉评分系统,主要用于鉴别AD患者和年龄相仿的正常对照者:在MRI平片上,采用T1加权(T1W)冠状位,根据脉络膜宽度、颞角宽度及海马高度的改变进行主观视觉评分,分为0~4分(见图1):0分=没有萎缩;1分=只有脉络膜裂轻度增宽;2分=同时伴有侧脑室颞角的扩大;3分=海马体积中度缩小(高度下降);4分=海马体积重度缩小。并通过内侧颞叶的线性测量来验证该方法的准确性与可行性。结果显示,阿尔茨海默病患者和正常对照组的MTA情况存在显著差异,主观MTA评分正确识别了81%的阿尔茨海默病患者(敏感性)和67%的对照组(特异性),主观MTA评分与内侧颞叶的线性测量之间有良好的相关性。但是因为样本量小,Scheltens等的研究未提出可靠、实用的临界值(本文临界值指的是:被认为是异常的初始值,例如,临界值≥2意味着大于或等于2的值应该被认为是异常的)。
1.2 新型MTA视觉评分系统
Kaneko等[14]于2102年发表的文章指出 认为Scheltens等提出的MTA视觉评分系统虽然简单直观,但由于等级之间的差异没有明确的定义,因此受评分者主观因素影响较大,为了克服这一问题,他们提出了新的MTA视觉评分系统,即:比较海马与海马周围的脑脊液(cerebrospinalfluid,CSF)间隙的形状和大小,评分者不需要测量该区域的大小,而是将海马放入海马周围的脑脊液空间,此过程中要保持海马的原始形状和大小,根据实际情况进行评分,具体操作过程为:利用MRI冠状短反转时间反转恢复(short inversion time inversion recovery,STIR)图像,比较海马的形状、大小与海马周围的CSF间隙,为了简化评估,他们将海马定义为与灰质同等强度的结构,在海马的两侧绘制垂直线以将海马周围的CSF空间分成三部分:外部(颞角),上部(脉络膜裂)和内部(环池)。将每个部分与海马进行比较,并使用以下标准分为四个等级(见图2):0分=外部和上部是狭缝状的,并且与内部的血管直径一样窄;1分=CSF空间小于海马;2分=CSF空间与海马几乎相同;3分=CSF空间大于海马。
1.3 T1W-轴位MTA视觉评分系统
临床研究中使用最广泛的MTAVRS是由Scheltens等开发的T1W冠状位VRS,但是临床工作中常规MRI序列绝大多数包括轴位,而不包括冠状位,为了克服这一问题,Kim等[15]提出了T1W轴向VRS。他们的研究结果显示改良的T1W轴位VRS与Scheltens等所提出的T1W冠状位VRS密切相关,两者具有较好的兼容性。具体操作过程为:将T1W冠状位的海马结构的最大高度转为T1W轴位上的内侧颞叶宽度,而脉络膜裂的的垂直宽度被通过脑干和内侧颞叶之间的中脑周池间隙的宽度所替代,颞角的宽度被侧脑室前部颞角的宽度代替。轴位MTAVRS范围从0分(无萎缩)到4分(严重萎缩)(见图3):0级=MTA无变化;1级=内侧颞叶可疑萎缩,中脑周池间隙或狭缝状颞角略微扩大;2级=中脑周池间隙的轻度扩大,同时伴有轻度的颞角扩大;3级=中脑周池间隙或颞角中度加宽,伴有海马结构弯曲;4级=中脑周池间隙或颞角严重扩大,伴有标志性的似“刀边样”改变的内侧颞叶皮质。
Kaneko和Kim等的研究均致力于验证他们自己提出的新型MTA评分系统是否准确、可行,均未提出与年龄相关的MTA临界值。目前临床研究应用较广泛的仍然是Scheltens等[13]提出的经典MTA视觉评分系统,通过许多临床研究证实[13,16,17],该量表具有可靠的临床意义。

图1 T1W-冠状位MTA视觉评分(图片来自吉林大学第一医院放射线科)
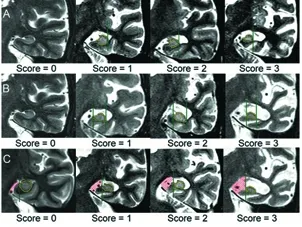
图2 海马周围的CSF空间分为三部分:(a)外部、(b)上部和(c)内部(图片来自参考文献14)
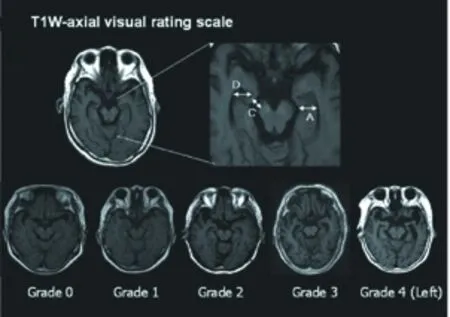
图3 T1W-轴位MTA视觉评分:A)内侧颞叶宽度,C) 中脑周池间隙的宽度,D) 侧脑室前部颞角的宽度(图片来自参考文献15)
2 MTA视觉评分的临床应用进展
有些研究表明预测MCI向AD转化时,推荐MTAVRS的临界分数≥1.5分[18,19],这具有很高的敏感性,但是Pereira等[20]2014年的研究发现,按照此临界值进行分组时,有许多患者被错误分组,而且这类患者的年龄显著偏大。这是因为随着年龄的增长,MTA增加,因此Pereira等[20]在Scheltens视觉评分量表基础上通过增加样本量提出了基于年龄的MTA临界值:以75岁为界限,当年龄小于75岁时,推荐MTA VRS的临界分数≥1.5分,当年龄超过75岁时,认为MTA VRS的临界分数≥2分更合适。同时该研究率先提到要考虑到人口统计学、遗传学、临床变量、性别及是否携带ApoEε4等位基因[21,22]等因素对MTAVRS的影响,还需要考虑到MTA不仅存在于AD中。
Ferreira等[21]同样采用Scheltens视觉评分量表,其研究较前有了新的进展,同样认为年龄、载脂蛋白E(ApoE)ε4状态和疾病发作年龄影响MTA VRS的分数,其中年龄是最主要的因素,并且首次就ApoE ε4携带状态提出了MTA VRS临界分数。他们以10 y为界划分年龄段,对于45~64岁、65~74岁、75~84岁和85~94岁的年龄范围,推荐MTA VRS临界分数分别为:≥1.5分、≥1.5分、≥2分和≥2.5分。对于早发性AD(未携带ApoE ε4)的患者,对于45~64岁、65~74岁、75~84岁和85~94岁的年龄范围,建议调整MTA VRS临界分数分别为:≥2分、≥2分、≥3分和≥3分。而且他们建议对轻度认知障碍(mild cognitive impairment,MCI)患者进行为期1 y的随访,通过随访进一步验证MTAVRS的可靠性。Claus等[23]采用CT 影像(0分,无萎缩至4分,严重萎缩)用视觉评级(Scheltens量表)对Ferreira等的研究进行了验证,得出了相似的结论:随着年龄的增长,AD患者和主观认知障碍患者(patients with subjective cognitive impairment,SCI)的MTA均呈类似的明显增大,<65岁、65~74岁、75~84岁和≥85岁各年龄段最佳MTA临界值分别为≥1.0、≥1.5、≥2.0 和≥2.0,相应的敏感度和特异度分别为83.3%和86.4%、73.7%和 84.6%、73.7%和76.2%、84%和62.5%,但他们认为MTA临界值对于年龄≥85岁组的价值有限。
最新的一项研究是来自Kim等[24],与前几项研究不同的是他们以MRI轴位为基础进行MTA VRS,其研究结论为:50~69岁患者的AD诊断最佳临界评分为≥1分(相应的敏感度和特异度分别为 89.5%和96.5%,89.5%和87.7%),70~79岁的患者为≥2分(其敏感度和特异度为 100%和12.3%),80~89岁的患者为≥3分(其敏感度和特异度为 100%和0%)。这是一项来自韩国的研究,他们的人口特征与我国相似,可以为我们的科研提供参考意义。但他们的研究中80岁以上的患者样本量较少,且在进行MTA视觉评分时未考虑到疾病发作年龄、ApoE ε4携带状态等因素的影响,其可靠性有待进一步验证。
3 小 结
关于在临床实践中应该使用什么分界线来区分AD与不患有痴呆的对照组或其他类型的痴呆,存在争论[25,26],目前大部分研究致力于寻找准确、可行的与年龄相关的MTA VRS临界值。目前的大部分研究结果更倾向于当年龄小于75岁时,推荐MTA VRS的临界分数≥1.5分,当年龄超过75岁时,推荐MTA VRS的临界分数≥2分,但当年龄大于85岁时,由于正常结构的老化,有一部分人会出现MTA,但没有明显的认知障碍或痴呆症状,这将出现假阳性的可能,因此,对于这部分人群,使用MTA VRS时要慎重。同时需要考虑到人口统计学、遗传学、载脂蛋白E(ApoE)ε4状态和疾病发作年龄等因素对MTA VRS的影响。
4 展 望
MTA视觉评分有助于评估局部脑组织萎缩情况、协助AD诊断,并且可以用于追踪MCI患者预后情况。因此,我们可以使用MTAVRS对MCI患者进行长期随访,归纳分析MCI患者发展为AD的情况,以期望对此类患者进行早期诊断、早期干预治疗,提高患者生活质量,减轻照料者负担。

