Aβ寡聚体损伤PC12细胞毒性研究
梁晓婷, 张丹丹, 梁文昭, 邵延坤, 闫亚韵
阿尔茨海默病(Alzheimer disease,AD)是一种慢性进展性中枢神经系统退行性疾病。随着人口老龄化的日益严重,患病率也随之增加,成为威胁人类健康的重大杀手,是严重的社会和医疗问题[1,2]。目前认为β淀粉样蛋白(β-Amyloid,Aβ)异常沉积可能是诱发AD形成的关键因素。其中,Aβ42较Aβ40疏水性强,有更强的毒性及自我聚集活性,易形成不可溶的Aβ纤维体导致老年斑形成。早老素1(Presenilin1,PS1)为淀粉样前体蛋白APP分解为Aβ的关键酶γ分泌酶的主要成分。自噬在AD等神经退行性疾病的发生、进展过程中起着核心作用。目前认为纤维状Aβ毒性不如可溶性Aβ寡聚体,可溶性Aβ寡聚体是产生神经毒性作用的重要来源。但体内获得可溶性Aβ很难,使其在体内聚集环境很难实现。所以,本研究通过Aβ寡聚体构建体外AD模型,探讨Aβ寡聚体对于细胞活力、凋亡、Aβ42及PS1表达、自噬等方面的影响。
1 材料与方法
1.1 试剂及仪器 未分化的半悬浮PC12细胞购自北京中国科学院细胞库;Aβ42单体、Aβ40单体购自Anaspec;CCK-8试剂盒购自东仁化学科技有限公司;BCA蛋白浓度测定试剂盒购自Bioteke;caspase-3、Beclin 1、PS1 antibody购自Anaspec;羊抗鼠IgG-HRP购自MILLIPORE。电泳仪、转移槽为BIORAD;酶标仪(BIOTEK)。
1.2 方 法
1.2.1 Aβ寡聚体的制备及CD谱分析 将Aβ40及Aβ42单体各取5 mg分别放入EP管中,各加入1.1 ml HFIP,该步在冰上进行,盖上离心管盖60 min使Aβ40和Aβ42充分溶解。分装每管100 μl,室温使在冰上预冷的HFIP挥发,将干燥的肽膜存于-80 ℃冰箱。使用时肽膜放在冰上,每管在超净台中加DMSO充分溶解,使终浓度为5 mmol/L,吹打混匀,加无酚红的DMEM培养基,尽量不要超过100 μmol/L。4 ℃孵育24 h,离心取上清液,放入-80 ℃冰箱。取制备的Aβ寡聚体,委托中科院大分子国家重点实验室进行CD谱分析。
1.2.2 Aβ42与Aβ40混合物寡聚体的制备 将Aβ40及Aβ42单体各取5 mg分别放入EP管中,各加入1.1 ml HFIP,该步在冰上进行,盖上离心管盖60 min使Aβ40和Aβ42充分溶解。分装每管100 μl,按摩尔量比例为1∶9,3∶7,4∶6,1∶0,4∶0,10∶0将Aβ42与Aβ40混合到新的EP管中,保证终浓度为1 mmol/L。室温使在冰上预冷的HFIP挥发,将干燥的肽膜存于-80 ℃冰箱。使用时肽膜放在冰上,每管在超净台中加DMSO充分溶解,使终浓度为5 mmol/L,吹打混匀,加无酚红的DMEM培养基,尽量不要超过100 μmol/L。4 ℃孵育24 h,离心取上清液,放入-80 ℃冰箱。
1.2.3 细胞培养及Aβ损伤PC12细胞AD模型制备 将未分化的半悬浮PC12细胞加入含有10%胎牛血清的DMEM培养基中,置于37 ℃、5% CO2的培养箱内孵育,按1∶4~1∶3进行细胞传代,第10~30代的分化细胞,以2×104密度接种到6孔板中,用于AD模型的制备,将1.2.2中制备的浓度为100 μmol/LAβ混合物寡聚体加到培养基中,37 ℃孵育24 h后进行实验。
1.2.4 CCK-8检测 生长良好的PC12细胞每孔8000~10000个接种于96孔板上,长满后加不含血清的DMEM高糖培养基培养,24 h后加入10 μmol/L 的Aβ混合物寡聚体,作用24 h后弃上清液,每孔加入200 μl培养基及20 μl CCK-8试剂避光孵育,酶标仪测定1 h后450 nm处OD值,重复3次。
1.2.5 ELISA法检测Aβ损伤PC12细胞Aβ42的表达 Aβ寡聚体损伤后的PC12细胞经细胞裂解液RIPA裂解、离心后取上清移入新的EP管,制备总蛋白。用酶联免疫吸附实验双抗夹心法检测Aβ42的表达,具体方法按说明书。
1.2.6 Western blot 检测Aβ损伤PC12细胞caspase-3、PS1、Beclin 1的表达 同1.2.5制备总蛋白,BCA法测蛋白浓度、 SDS-PAGE电泳,转至PVDF膜,脱脂奶粉封闭,一抗稀释比例1∶1000,孵育 4 ℃ 过夜,二抗(羊抗小鼠IgG-HRP)稀释比例1∶2000,37 ℃孵育1 h。在暗室曝光显影。用Image J 图像处理软件分析目标条带的光密度,求目的蛋白与内参蛋白灰度值的比值。
1.2.7 免疫组化检测Aβ损伤PC12细胞PS1表达 血清封闭,一抗(PS1 antibody)稀释比例1∶200,4 ℃过夜孵育,二抗(羊抗小鼠IgG-HRP)孵育,37 ℃,DAB染色,封片剂封片,显微镜下观察。
1.3 统计学方法 SPSS17.0统计,各组数据间进行t检验分析,当P<0.05时,认为具有统计学意义。
2 结 果
2.1 Aβ42 CD谱分析 用圆二色谱仪对各点聚合的Aβ42分析,用在线软件计算α-螺旋、β折叠、无规卷曲的含量,发现3 h和12 h二级结构几乎无改变,24 h二级结构β折叠升高,48h其β折叠降低。提示Aβ42寡聚体聚合24h进行实验的意义较大。
2.2 CCK-8检测Aβ损伤PC12细胞活力 Aβ寡聚体混合物总量相同时,Aβ42/Aβ40不同比例损伤PC12细胞时,比值微小变化(3 μmol/L∶7 μmol/L到4 μmol/L∶6 μmol/L)时,PC12细胞活力增加(a:P<0.05),但Aβ42的含量为10 μmol/L,PC12细胞的活力表现为下降(b:P<0.05),说明在一定浓度范围内Aβ寡聚体可以使PC12细胞活力增强,并且与Aβ42的含量相关,超过一定范围后活力下降。Aβ42蛋白的含量相同时,Aβ42蛋白的浓度增加(1 μmol/L~4 μmol/L)时,PC12细胞的活力增加(c:P<0.05),且具有剂量依赖性(见图1)。
2.3 Aβ损伤PC12细胞Caspase 3表达 Aβ寡聚体总量相同时,4∶6组,与1∶9组、3∶7组相比,caspase-3的表达增多,且差异有统计学意义(a:P<0.05),Aβ寡聚体中Aβ42含量相同时,Caspase 3表达增加,差异有统计学意义(b:P<0.05,c:P<0.05),Aβ42/Aβ40比值为4∶0(4 μmol/L∶0 μmol/L)组比1∶0(1 μmol/L∶0 μmol/L)组caspase-3表达增加,有统计学差异(d:P<0.05)。说明Aβ寡聚体损伤PC12细胞引起细胞凋亡,Aβ42比例越大,凋亡越明显,且具有剂量依赖性,Aβ40可以减轻Aβ42引起的细胞凋亡,对细胞起保护作用。综上,通过不同比例Aβ42/Aβ40混合物寡聚体损伤PC12细胞,能够在体外模拟AD的病理过程,成功建立了PC12细胞AD模型(见图2)。
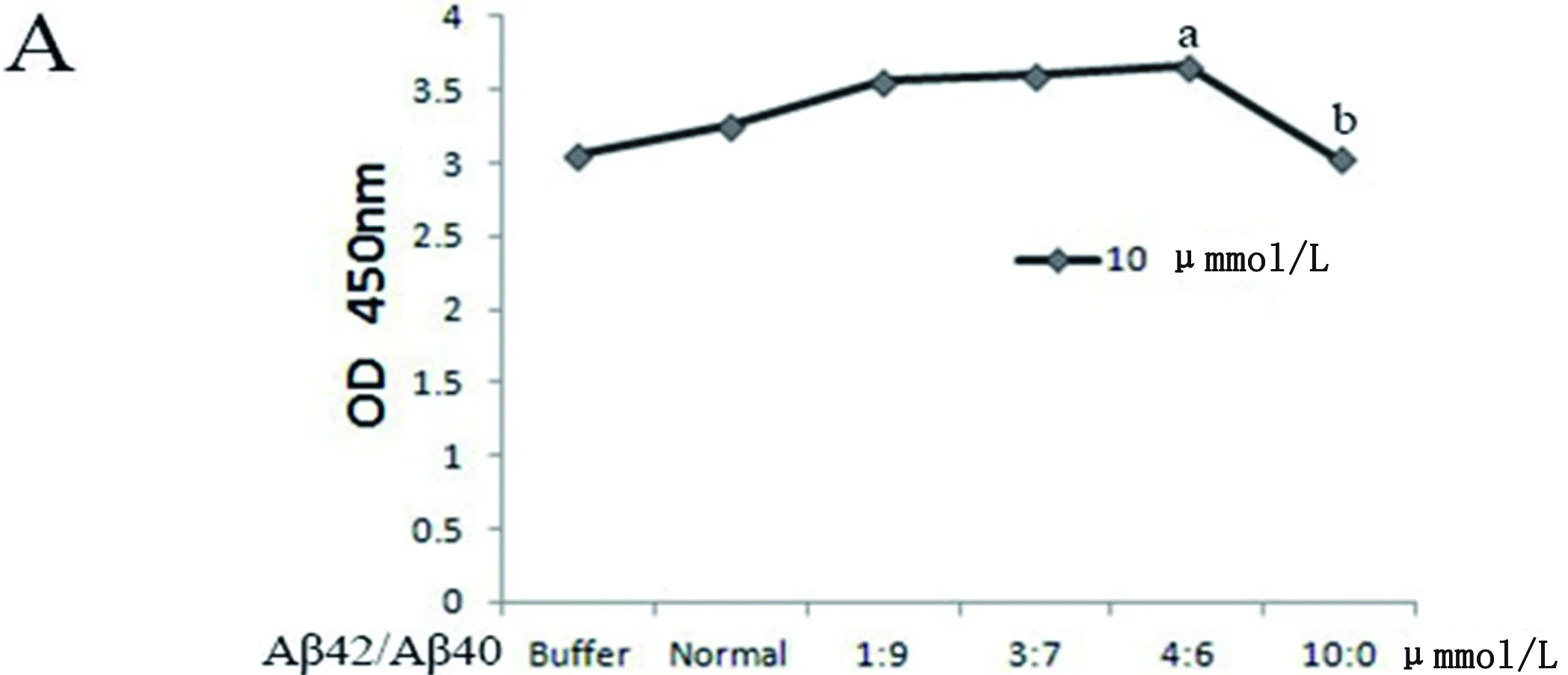


(A)a示与1∶0组相比,P<0.05,b示与4∶0组相比,P<0.05。(B)Pure示只有Aβ42,Mix示Aβ42与Aβ40混合物,a示与Mix组相比,P<0.05,b示与Mix组相比,P<0.05,c示与1∶0组相比,P<0.05。(C)a示与1∶0组相比,P<0.05,b示与4∶0组相比,P<0.01

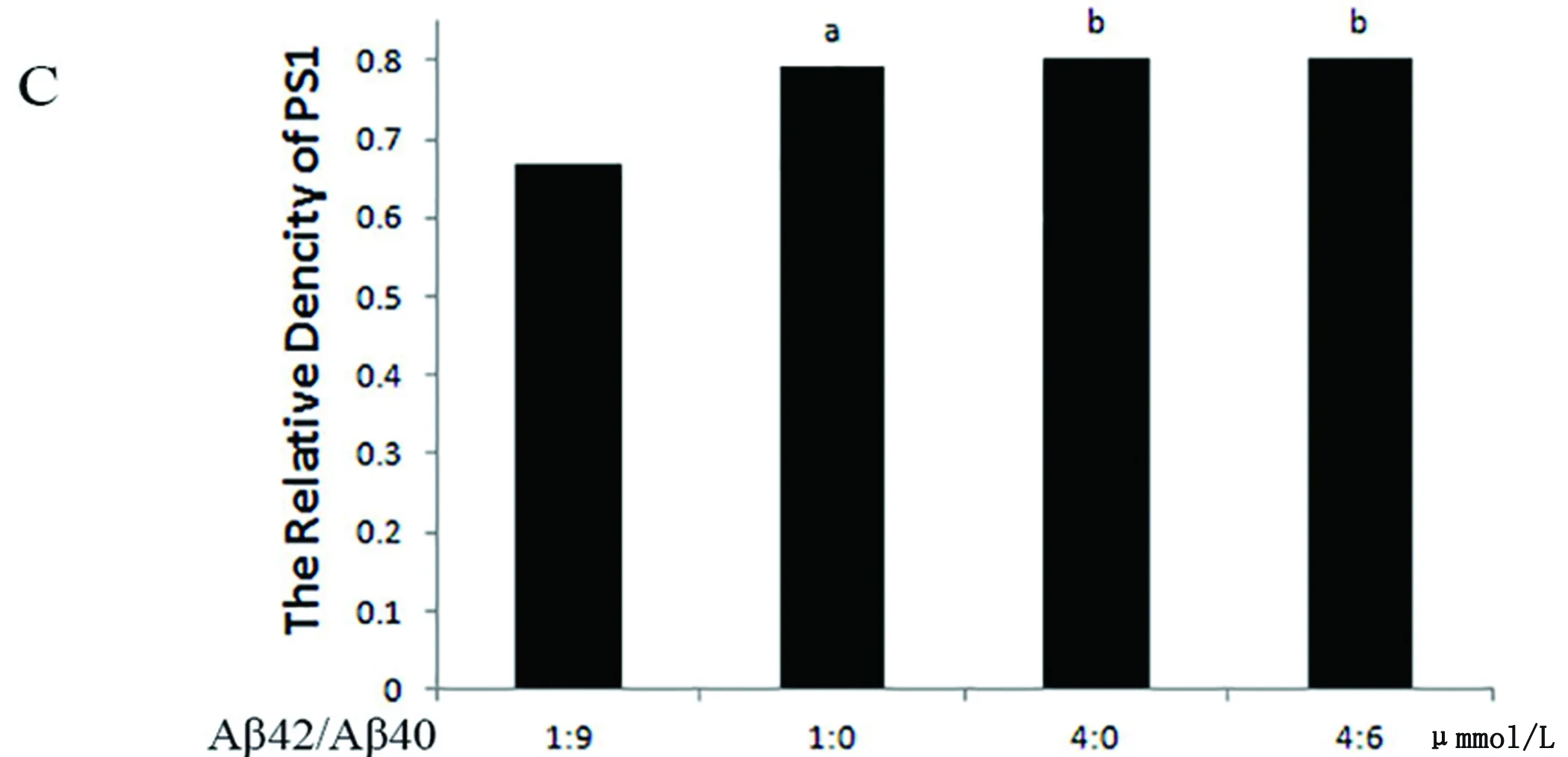
(A)β-actin为内参;(B)a示与1∶9组相比,P<0.05,b示与1∶9组相比,P<0.05,c示与4∶6组相比,P<0.05,d示与1∶0组相比,P<0.05
2.4 Aβ损伤PC12细胞Aβ42的表达 ELISA法检测示在一定浓度范围内,Aβ寡聚体混合物总量相同时,Aβ42/Aβ40不同比例损伤PC12细胞时,当比值微小变化时,Aβ42的表达量显著且比值越大,Aβ42表达量越高,具有统计学意义(b:P<0.05)。说明Aβ寡聚体混合物损伤PC12细胞Aβ42的聚集与Aβ寡聚体混合物中Aβ42的比例显著相关。单纯的Aβ42寡聚体与Aβ42与Aβ40混合物对比,当两者Aβ42含量相同,单纯的Aβ42寡聚体引起Aβ42表达增加,且具有剂量依赖性(c:P<0.01),说明Aβ40可以减少Aβ42的表达,对细胞有保护作用(见图3)。

(A)a示与1∶9组相比P<0.05,b示与3∶7组相比P<0.05,c示与4∶6组相比P<0.01。(B)a示与1∶9组相比P<0.05,b示与4∶6组相比P<0.05,c示与1∶0组相比,P<0.01
2.5 Aβ损伤PC12细胞PS1的表达 Western blot检测结果示:Aβ寡聚体总量相同时,PS1的表达差异不明显,Aβ42/Aβ40比例为10∶0时与4∶6(4 μmol/L:6 μmol/L)组,PS1的表达并不增加,但4∶6组与1∶9组、3∶7组相比,PS1的表达增多,且差异有统计学意义(a:P<0.05,b:P<0.05),表明AD的发病过中,Aβ40含量在一定程度的减少可激活PS1的表达。单纯的Aβ42寡聚体与Aβ42与Aβ40混合物对比,当两者Aβ42含量相同,PS1的表达差异没有统计学意义(b:P>0.05)(见图4)。
2.6 Aβ损伤PC12细胞Beclin 1的表达 Aβ混合物寡聚体中Aβ42/Aβ40比例变化时,Aβ42/Aβ40值4∶6(4 μmol/L∶6 μmol/L)组、4:0组比1∶9组Beclin 1的表达增加;Aβ42含量相同时,Aβ42/Aβ40从1∶9(1 μmol/L∶9 μmol/L)到1∶0、从4∶6到4∶0,Beclin 1的表达显著增加,差异有统计学意义(a:P<0.05,b:P<0.01),说明Aβ42可以激活自噬,且自噬的强弱与Aβ42在寡聚体中的含量相关,具有剂量依赖性(e:P<0.05)。当Aβ42/Aβ40的比值为10∶0(10 μmol/L∶0 μmol/L),Beclin 1的表达明显降低,自噬受到抑制,说明Aβ42对细胞自噬的激活在一定的浓度范围内有效,当浓度过大时,细胞自噬减弱,引起细胞损伤(见图5)。


(B)a示与1∶9组相比,P<0.05,b示与3∶7组相比,P<0.05。(C)a示与1∶9组相比,P<0.05,b示与1∶0组相比,P>0.05,差异无统计学意义

(A)β-actin为内参;(B)a示与1∶9组相比,P<0.05,b示与4∶6组相比,P<0.01,c示与1∶0组相比,P<0.05,d示4∶0组相比,P<0.01,e示于1∶0组相比,P<0.05
3 讨 论
Aβ蛋白是由淀粉样前体蛋白(amyloid precursor protein,APP)裂解产生的,不同个体内有不同的Aβ蛋白的谱系,表现为Aβ1~43、Aβ1~42和Aβ1-40不同比例的混合。正常人体内大约90%为Aβ40,只有少数为Aβ1~43、Aβ1~42。尽管这些β淀粉样蛋白只有几个氨基酸的差异,但功能却相差很远。Schellenberg等[3]于1992 年首次发现PS-1 基因与家族性AD发病有关,PS1属于进化过程中非常保守的蛋白质,主要表达于大脑新皮质、海马。PS1在生物体中有重要作用,在APP及Notch1蛋白的水解过程中扮演着重要角色。目前认为,PS1参与形成γ分泌酶复合物来调节Aβ的生成。γ分泌酶复合物由PS、Nicastrin、APH1和PEN2构成,PS1是γ分泌酶复合物的活性中心。自噬能清除受损细胞器及异常折叠的蛋白质,目前研究认为自噬是可以减轻神经毒性及清除神经元内异常沉积的Aβ的潜在治疗靶点。自噬囊泡在AD小鼠脑中大量积聚可使轴突受损[4]。Beclin 1是细胞自噬的关键调控因子,与配体结合,调节细胞内自噬的活性[5]。
为成功建立Aβ损伤的PC12细胞AD细胞模型,Aβ标本中β片层结构的含量为制备的关键因素。因为生理状态下Aβ是可溶性的α螺旋结构,病理状态下Aβ为容易形成纤维状或沉积的β片层结构。在病理状态下Aβ自发快速形成β片层结构,进而形成纤维、沉积发挥毒性。Aβ寡聚体比纤维状的Aβ毒性更强,且其毒性依赖于形成β片层结构的能力[6,7]。本研究应用体外制备的Aβ寡聚体损伤PC12细胞,同时检测Aβ寡聚体聚合不同时间点β片层结构的含量,研究结果显示Aβ寡聚体聚合24 h含量最高,故选用聚合24 h的Aβ寡聚体制备AD模型。用CCK-8检测细胞活力、Western blot测凋亡相关蛋白caspase-3表达鉴定PC12细胞AD模型,通过不同Aβ42寡聚体与Aβ40寡聚体的混合物比例损伤PC12细胞,说明在一定的浓度范围内(本研究为10 μmol/L),细胞凋亡率小,细胞的活力增加,研究此阶段的病理及机制可为AD的治疗及预防提供新的靶点。
目前的研究[8,9]结果显示,PS1基因突变可因为改变了γ-分泌酶对APP的剪切位点,使纤维原性较强、易聚集、神经毒性大的Aβ42生成增多从而引发AD。但Aβ损伤细胞后是否影响PS1功能目前少有研究。本研究通过Aβ寡聚体的混合物损伤PC12细胞,观察Aβ对PS1产生的影响,结果发现:Aβ42/Aβ40比例为4∶6(4 μmol/L∶6 μmol/L)时与1∶9、3∶7比,Aβ42的表达增加,PS1表达的增加远小于Aβ42的增加,当Aβ42/Aβ40比值由4∶0(4 μmol/L∶0 μmol/L)到10∶0(10 μmol/L∶0 μmol/L)时,Aβ42表达显著增加,而PS1的表达基本无变化。说明在AD的发病中,Aβ40含量在一定程度的减少可激活PS1的表达,Aβ42含量的增加可明显增加Aβ42的表达,并且具有剂量依赖性,但Aβ42含量增加时PS1表达没有显著变化。研究结果提示,Aβ42/Aβ40比值增加时,可能会引起PS1结构与功能的改变。单粒子电子显微镜及FLIM证实γ分泌酶的成熟体有不同的构象位点[10~12],在PS1突变的转基因小鼠中发现,PS1与γ分泌酶上紧密结合的区域,可协助长链的Aβ肽段的产生[13],因此把这个位点称为“closed”,化合物可通过调节PS1向“open”位点发生构象变化就能产生低分子量的Aβ肽段[11,14]。Aβ42含量的增高能够激发PS1向病理位点的构象变化,这一过程通过细胞内的钙超载实现[15],Aβ42含量的增高引起PS1的改变机制可能与细胞内Aβ42引起的钙超载导致细胞损伤相关[16]。氧化应激及胞内Ca2+的增加可使PC12细胞功能异常的PS1表达增加[17]。另有证据证明:PS可调节细胞内Ca2+的稳态,且不依赖γ-分泌酶的活性[18]。最近的研究做出推断钙超载可能为AD病理生理过程恶化的罪魁祸首[19~21]。
综上,本研究成功模拟了体外AD的病理过程,构建AD早期的细胞模型。并检测了Aβ损伤PC12细胞Beclin 1的表达,结果说明AD的早期阶段一定的浓度范围内Aβ42激活细胞自噬,当浓度过大时,细胞自噬减弱,引起细胞损伤,因此可将此阶段的病理过程作为治疗及预防的靶点。Aβ寡聚体不改变细胞内PS1的含量,可能是通过改变PS1的结构和功能引起Aβ沉积,但Aβ的毒性及机制仍不十分清楚,有待进一步探讨。

