高糖诱导大鼠海马神经元细胞模型建立及细胞凋亡的影响
许永劼, 李程程, 朱金凤, 朱丽英, 高 超, 代龙光, 钱 雯, 张競之, 潘 卫,3,李 兴
糖尿病脑病(diabetic encephalopathy,DE)是糖尿病严重的慢性并发症之一,是由糖尿病代谢紊乱导致的中枢神经系统损坏,从而引起大脑神经生理及结构改变和认知功能障碍的疾病[1]。目前,有关于糖尿病脑病动物及细胞模型的报道少见,因此建立一种稳定的糖尿病脑病的细胞模型具有重要意义。
现阶段有研究认为糖尿病脑病与海马神经元凋亡密切相关,高血糖能诱导内皮细胞功能障碍,从而加速细胞凋亡而导致血管内皮受损[2]。细胞凋亡受到多种凋亡相关基因的调控,其中Bcl-2和Bax是细胞凋亡调控的重要因素,Bcl-2主要功能是抑制细胞凋亡作用,保护细胞;而Bax则起到促进细胞凋亡的作用,加速细胞凋亡[3]。本研究旨在建立一种高糖诱导的糖尿病脑病细胞模型,探讨高糖对海马神经元细胞凋亡的影响,为进一步从细胞水平研究糖尿病脑病提供理论基础。
1 材料和方法
1.1 材料、试剂和实验动物 取出生24 h以内的SD新生鼠,体重约5~7 g(合格证号:SCXK(黔)2018-0001,由贵州医科大学实验动物中心供给) 试剂:神经元专用Neurobasal-A培养基、DMEM培养基、B-27神经元营养因子、0.25%胰蛋白酶0.25%胰蛋白酶(无EDTA)(美国Gibco公司、胎牛血清(上海臻诺生物科技有限公司)马血清(美国Hyclone公司)、L-谷氨酰胺、CCK-8试剂盒(北京鼎国昌盛生物技术有限责任公司)细胞凋亡凋亡检测试剂盒(凯基生物科技发展有限公司)、兔源β-actin单克隆抗体、兔源 Bcl-2单克隆抗体、兔源Bax单克隆抗体(购自美国affinity公司)。
1.2 主要仪器 Thermo-3111型CO2培养箱、IMARK型酶标仪(美国Bio-Rad公司)、倒置显微镜(日本Nikon公司)、Western blot垂直电泳仪、Western blot电泳转印系统(美国Bio-Rad公司)、流式细胞仪(美国 Beckman 公司)。
1.3 原代培养海马神经元细胞 取出生24 h内SD乳鼠的海马组织,将海马组织放在中低温PBS,显微镜下利用眼科镊快速分离海马组织血管包膜,剪碎组织、移液器吹打混匀20次、离心850 r/min离心5 min、弃上清液后,加入0.125%胰蛋白酶消化,37 ℃培养箱消化15 min,每隔5 min轻轻摇晃,加入等体积的血清终止消化,200目筛网过滤,制成神经元单细胞悬液,种植于预先用L-多聚赖氨酸包被24h的6孔板和96孔板中(使用前PBS冲洗3次),10 h后将种植培养基(83%DMEM培养基+1%L-谷氨酰胺+1%双抗+10%马血清+5%胎牛血清)弃去,PBS清洗3次,换成维持培养基(96%Neurobasal-A+2%B-27+1%L-谷氨酰胺+1%双抗)培养,以后每3.5 d量换液一次。
1.4 NSE免疫组化纯度鉴定 将细胞悬液以1~5×105个/ml的浓度接种到提前放置了细胞爬片(爬片经过多聚赖氨酸处理)的6孔培养板中,海马神经元培养至5 d,将培养板中细胞爬片取出,并用PBS冲洗3次,然后加入4%多聚甲醛固定30 min,再次使用PBS漂洗3次。全部操作按照NSE免疫组化染色试剂盒操作说明书进行海。显微镜下观察,随机选取观察视野,计数视野下100个细胞中海马神经元的数量,重复5次后,取观察的平均值,计数阳性细胞百分数,为海马神经元细胞纯度。
1.5 高糖浓度摸索 细胞培养至5 d,将海马神经元细胞随机分为7组,分别是将细胞分为25 mmol/L组(对照组);45 mmol/L-24 h组、45 mmol/L-48 h组、45 mmol/L-72 h组和60 mmol/L-24 h组、60 mmol/L-48 h组、60 mmol/L-72 h组。每组达到作用时间后,CCK-8法检测各组海马神经元细胞活性,全部操作严格按照CCK-8试剂盒说明书进行。为减低试验误差,每组平行做6孔,每孔加入10 μl的CCK-8溶液,37 ℃温箱孵育1.5 h后,使用酶标仪在规定波长450 nm测定OD值。
1.6 高糖作用时间摸索 细胞培养5 d,将细胞分为25 mmol/L组(对照组)、45 mmol/L-24 h实验组、45 mmol/L-48 h实验组组、45 mmol/L-72 h实验组,达到作用时间后,提取细胞蛋白,吸取上清BCA法定量蛋白浓度。以含20 μg蛋白质溶液为上样量,经12%聚丙烯酰胺凝胶电泳分离后,通过湿转法,将目的蛋白转至PVDF膜上,5%脱脂牛乳室温下封闭2 h,加入兔抗β-actin(1∶5000) 、兔抗Bcl-2(1∶1000)、兔抗Bax(1∶1000)于4℃摇床孵育过夜,TBST缓冲液漂洗PVDF膜3次,每次10 min;分别加入HRP标记的羊抗兔Ig G(1∶20000) 二抗室温孵育2 h,TBST缓冲液漂洗PVDF膜3次,每次10 min;采用ECL法发光显示,现配显色工作液,采用凝胶成像系统进行图像收集,使用ImageJ软件对条带灰度值进行分析比较,计算先对表达量。每组实验重复3次。
1.7 流式细胞术检测 细胞培养至5 d分为25 mmol/L组和最适高糖组(45 mmol/L-48h)组,达到作用时间后,弃培养基,PBS清洗3遍,每次1 min,加入适量0.125%胰蛋白酶(不含EDTA)后,放置在37 ℃的CO2培养箱中消化细胞20 min,每隔5 min轻轻摇晃一下,加速细胞脱落。显微镜下观察消化效果,细胞脱落70%左右,加入适量胎牛血清终止消化。采用用低速离心机1000 r/min离心5 min,收集消化后脱落细胞,细胞计数后,以5×104的浓度为一个标本上样量,按照操作说明书,加入500 μl结合液重悬神经元细胞,依次加入5 μl Annexin V-FITC和5 μl碘化丙啶,轻轻混匀,所有操作均避光进行,室温下避光孵育10 min,1 h内流式细胞仪上机检测细胞凋亡情况。
1.8 统计学方法 数据收集整理后用,采用SPSS 19.0统计软件进行数据分析处理,当P<0.05说明检测结果的显著性差异具有统计学意义。
2 结 果
2.1 原代海马神经元培养 海马神经元细胞形态变化:细胞种植于培养板1 d后,细胞呈小圆形,透亮且散在分布均匀,边缘有光晕(见图1);种植3 d后,细胞基本贴壁成功,部分神经元细胞长出突触(见图2);生长至5 d,细胞胞体进一步长大,成圆形或者椎体形,突触生长迅速,形成稀疏的网状结构(见图3);生长至7 d,细胞胞体饱满,细胞表明光晕明显,形成密集的网状结构,细胞有聚集生长现象(见图4)。
2.2 原代海马神经元纯度鉴定 NSE免疫组织化学染色后,光学显微镜下观察爬片中细胞形态完整,细胞分布均匀,可见清晰的网状结构,其中细胞胞体和大部分突触为黄棕色颗粒,为阳性细胞即海马神经元(见图5),经观察计数后计算阳性细胞百分数,本实验神经元纯度可达85%以上,生长状态良好,生长密度适宜,可进行后续试验。
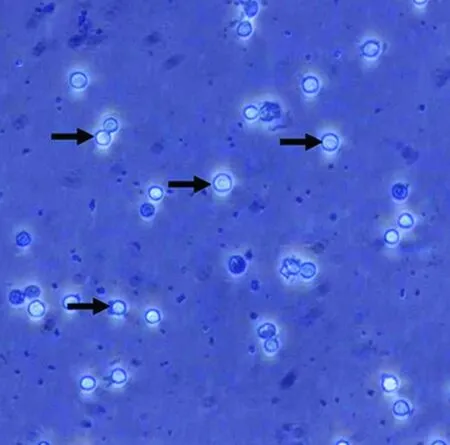
图1 神经元生长1 d后(×200)
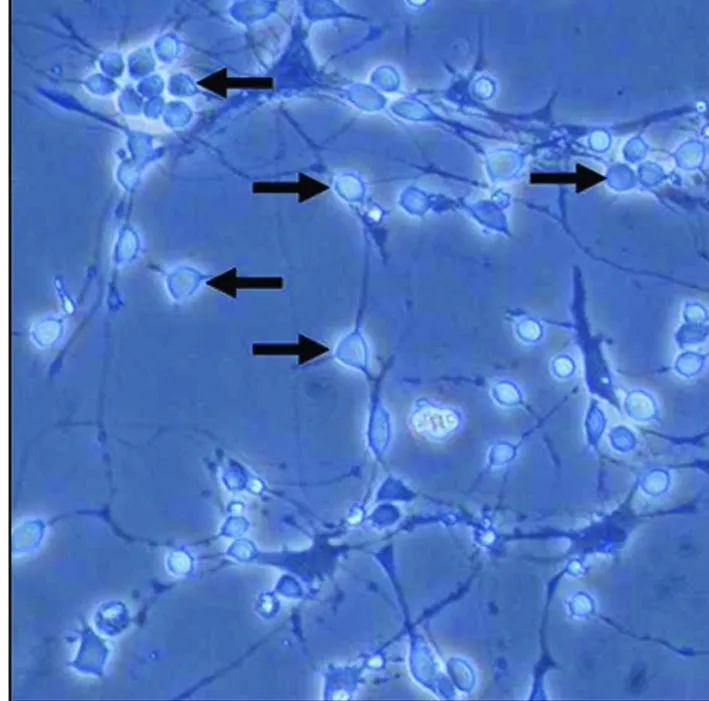
图2 神经元生长3 d后(×200)

图3 神经元生长5 d后(×200)

图4 神经元生长7 d后(×200)


图5 NSE染色后的海马神经元(×200)
2.3 高糖浓度的确定 CCK-8检测细胞活性结果(见表1),45 mmol/L组作用24 h、48 h、72 h后,细胞平均存活率均在80%以上,而60 mmol/L组作用24 h、48 h、72 h后,细胞活性全部低于80%。根据美国药典细胞毒性分级[4],细胞存活率≥80%属于1级细胞,可用于后续实验,即本研究高糖浓度确定为45 mmol/L。
2.4 高糖作用时间的确定 Bcl-2和Bax是经典凋亡相关蛋白,与细胞凋亡情况密切相关。Western blot结果显示,随着糖浓度的升高,与对照组相比,45 mmol/L-24组、45 mmol/L-48 h组、45 mmol/L-72 h组中海马神经元内均Bcl-2表达下降、Bax表达上升,差异有统计学意义(P<0.01)(见图6);与45 mmol/L-24 h组比较,Bcl-2在45 mmol/L-48 h组和45 mmol/L-72 h组下降明显(P<0.05),但45 mmol/L-48 h组和45 mmol/L-72 h组差异无统计学意义(P>0.05)与45 mmol/L-24 h组比较,Bax在45 mmol/L-48 h组和45 mmol/L-72 h组升高明显(P<0.01),但45 mmol/L-48 h组和45 mmol/L-72 h组差异无统计学意义(P>0.05)。结果显示,高糖作用时间为48h为最适时间,为后续试验奠定基础。
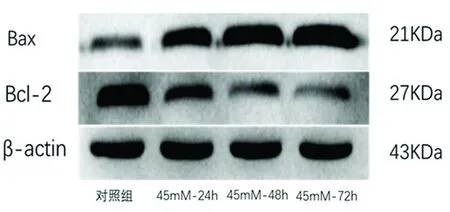
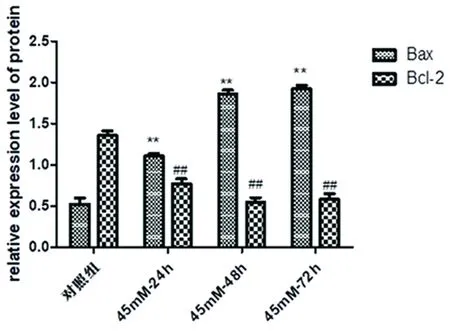
与对照组比较**P<0.01;##P<0.01
2.5 流式细胞术检测细胞凋亡率 采用流式细胞仪检测各组海马神经细胞的凋亡情况。Flow Cytometry结果显示,对照组海马神经细胞凋亡率为2.1%±0.3%,高糖作用48h后细胞凋亡率为12.5%±0.5%。与对照组对比,高糖组海马神经元细胞凋亡率显著上升(P<0.01)(见图7)。

与对照组比较**P<0.01

表1 45 mmol/L和60 mmol/L组细胞平均存活率(%)及细胞毒性分级(n=5)
3 讨 论
糖尿病脑病患者临床表现为轻、中度的认知功能障碍,学习和记忆能力下降,语言理解等能力降低,且与各种神经退行性疾病均有密切联系。现研究认为高血糖引起机体代谢紊乱,继发导致大脑海马区结构功能异常,如突触可塑性改变和神经递质释放受到影响,最终导致机体认知功能障碍[5]。目前,国内外对糖尿病脑病模型构建仍处在探索阶段,无论是动物水平还是细胞水平均缺少有效的途径,而越来越多的糖尿病患者后期出现认知功能障碍,最终发展为糖尿病脑病[6]。因此,建立一种稳定的糖尿病脑病的模型具有重要意义。
海马体(Hippocampus),又名海马回,是大脑学习记忆的关键部位。临床研究数据发现,2型糖尿病与认知功能障碍密切相关,2型糖尿病患者海马体积减少,而海马区是最先受糖尿病影响的脑区[7]。因此,本研究选择海马神经元为研究对象,探讨高糖作用时间和浓度对海马神经元的影响。本研究成功培养原代海马神经元,经NSE免疫组织化学染色鉴定纯度达85%以上,达到后续试验要求。研究发现神经元细胞具有较高代谢率,在大量体外培养实验中,发现25 mmol/L基础糖浓度是维持神经元生长发育及突触生长最适浓度[8]。本研究根据海马神经元高糖模型的研究[9,10]及张贝贝等认为高糖环境会引发血管内皮细胞凋亡相关蛋白Bcl-2和Bax水平变化[11],探讨在不同糖浓度和作用时间下培养海马神经元细胞,以观察随着糖浓度的增加是否对神经元细胞内凋亡相关蛋白Bcl-2和Bax表达有影响,从而获得最适的糖作用时间。还有研究[12]发现,海马神经元在糖浓度达50 mmol/L培养基培养时,细胞中突触相关蛋白SNAP-25、synaptotagmin-1和VGluT-1外表达显著降低,从而导致某些蛋白质在突触中运输情况受到影响,最终影响神经元细胞活性。本研究运用45 mmol/L糖浓度培养海马神经元,海马神经元生长状态受到一定程度影响,细胞形态较完整,胞体较饱满,光晕比较明显。CCK-8检测结果显示神经元细胞存活率均在80%以上。而经过45 mmol/L糖浓度作用48 h可引起神经元内Bcl-2和Bax表达水平较25 mmol/L组显著变化,但随着作用时间的延长,45 mmol/L-48 h组和45 mmol/L-72 h组差异无统计学意义,因此最终确定45 mmol/L糖浓度培养48h为最适糖浓度和作用时间。
现阶段基于神经元细胞凋亡学说研究糖尿病脑病的发病机制成为当前主流。细胞凋亡是细胞的程序性死亡,受到多种因素的调控,如环境、基因、凋亡相关蛋白等。在正常大鼠海马区内,Bc1-2扮演着抑制细胞凋亡的角色,保护细胞存活,当Bc1-2与Bax维持数量上的平衡,机体的凋亡水平处于正常阶段;当机体受到某些因素的刺激后,Bax发挥作用,介导细胞凋亡的产生,由此可见Bc1-2与Bax水平的动态平衡是维持机体凋亡的重要因素[13]。Lei等[14]研究发现大黄素可减轻高糖诱导PC-12细胞凋亡情况,通过增加Bax/Bcl-2比率,减低caspase-3和caspase-9的表达达到保护PC-12细胞的作用,降低细胞凋亡水平。闫斌等[15]发现槲皮素能够减轻高糖诱导下海马神经元的凋亡情况,其作用机制是增加p-Akt蛋白的表达,进而增加Bcl-2蛋白的表达,抑制Bax蛋白的表达。本研究与闫斌等的实验结果一致,随着糖浓度的增加,海马神经元内凋亡相关蛋白Bcl-2和Bax表达水平发生变化,其中Bcl-2表达下降而Bax表达上升。在确定最适高糖浓度和作用时间后,我们运用流式细胞术检测高糖组的凋亡情况,发现与对照组相比,海马神经元的细胞凋亡率显著上升。结合凋亡相关蛋白Bcl-2和Bax的变化情况,我们推测,高糖引起海马神经元细胞凋亡增加可能是通过改变凋亡相关蛋白Bcl-2和Bax的表达实现的,但具体的作用机制仍需要进一步研究。
综上所述,本研究成功构建一种高糖诱导糖尿病脑病细胞模型,为后续的研究提供帮助;并且发现高糖会导致海马神经元细胞凋亡率升高,其原因可能与凋亡相关蛋白Bcl-2和Bax的表达改变有关。

