不同浓度蒿甲醚对人涎腺腺样囊性癌细胞增殖、凋亡、侵袭、迁移的影响及其机制
李帅,徐向华,刘继光,刘学超,张洲铭,王彭议
(1 佳木斯大学口腔医学院,黑龙江佳木斯154003;2 山东省妇幼保健院;3 山东大学附属省立医院)
涎腺腺样囊性癌(SACC)是涎腺较常见的涎腺恶性上皮源性肿瘤,早期以无痛性肿块多见,具有生长缓慢、嗜神经侵袭性较强、易发生远处转移等特点[1]。SACC病程长且预后差,晚期高达8%~46%的远处转移率是患者死亡的主要原因,5年生存率为55%~89%[2,3]。SACC早期治疗以手术切除为主,但很难彻底切除病变组织治愈疾病,治疗后易复发,长期预后效果欠佳,因此中晚期和复发SACC患者以放化疗配以中草药调节增强免疫力的综合治疗为主。青蒿素是抗疟药,随着临床实验的深入研究,其抗肿瘤作用也备受关注[4]。研究[5]发现,青蒿素及其衍生物蒿甲醚(ART)对体外多种恶性肿瘤细胞具有显著的选择性杀伤作用,且无明显的毒副作用,其作用机制包括促使肿瘤细胞凋亡、Fe2+介导产生自由基选择性杀伤肿瘤细胞、抗血管生成作用、氧化损伤反应、抑制肿瘤细胞增殖等[6~10]。高迁移蛋白-1(HMGB1)是人体内含量最丰富的HMG蛋白,其基因定位于人染色体13q12,调节转录过程[11]。研究[12]发现,在肿瘤侵袭过程中HMGB1可释放至细胞外,与细胞表面的HMGB1相应受体相结合形成复合物,激活丝裂原活化蛋白激酶、基质金属蛋白酶等信号通路,促进肿瘤新生血管形成肿瘤侵润及转移。2018年4月5日~2018年10月8日,本研究观察了不同浓度的ART对SACC细胞系ACC-2增殖、凋亡、侵袭、迁移的影响,并探讨ART对ACC-2细胞的调控机制。
1 材料与方法
1.1 ART、细胞及试剂 ART购于阿拉丁试剂有限公司。人涎腺腺样囊性癌细胞系ACC-2购自procell公司。胎牛血清、0.25%Trypsin购于Gibco公司,CCK8细胞增殖和细胞毒性检测试剂盒购自Beyotime公司,HMGB1 Antibody购自Sanying公司,凋亡测定试剂盒购自Nanjing Kaiji Bio公司,Transwell购自FALCON公司,Matrigel购自BD公司,兔多克隆抗抗HMGB1(30 KD)购自武汉三鹰生物科技有限公司,小鼠单克隆抗体β-actin(42 KD)、HRP标记的羊抗小鼠二抗购自武汉博士德生物工程有限公司。
1.2 细胞培养 将ACC-2细胞置于含10%胎牛血清的DMEM培养基中,在37 ℃、5% CO2的细胞培养箱中培养,每2~3d换液1次,细胞呈单层贴壁生长,待融合度达90%时,用0.25%胰蛋白酶消化传代,取对数生长期细胞用于实验。
1.3 不同浓度ART对ACC-2细胞增殖的影响观察 采用CCK-8法。取生长状态良好的对数生长期ACC-2细胞,接种于96孔板,37℃、5% CO2条件下培养过夜。将ACC-2细胞分为4组,分别加入125、250、500 μg/mL的ART或等量0.1% DMSO培养液进行培养,记为125 μg/mL组、250 μg/mL组、500 μg/mL组(实验组)和对照组,每组设5个复孔,分别于培养0、24、48、72、96 h时,将10 μL CCK8溶液缓慢加入各孔中,37 ℃培养箱继续培养中3 h,以不加细胞和药物的孔为空白组,使用酶标仪测定450 nm处的OD值,计算各组细胞增殖率。各组细胞增殖率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.4 不同浓度ART对ACC-2细胞凋亡的影响观察 采用流式细胞术Annexin V-FITC/PI双染法。取生长状态良好的对数生长期ACC-2细胞,接种于6孔板。将ACC-2细胞分成4组,分别加入125、250、500 μg/mL的ART或等量0.1% DMSO培养液,记为125 μg/mL组、250 μg/mL组、500 μg/mL组、对照组。各组细胞于37 ℃、5% CO2饱和湿度的培养箱中继续培养24 h,PBS缓冲液洗涤细胞,胰蛋白酶消化后以无血清培养基重悬制备单细胞悬液,取细胞悬液置于5 mL流式管中,加入5 μL Annexin V-FITC,混合均匀后再加入5 μL PI,室温避光反应10 min,用流式细胞仪检测各组细胞凋亡率。
1.5 不同浓度ART对ACC-2细胞侵袭能力的影响观察 采用Transwell侵袭实验。细胞分组及药物干预方法同“1.4”。各组细胞药物干预后除去培养基,加入3 mL PBS洗涤细胞,用0.25%胰蛋白酶消化,收集细胞,1 000 r/min离心5 min,弃去上清液,PBS洗涤,稀释细胞浓度至1×105个/mL备用。Matrigel于4 ℃解冻,在冰上稀释至终浓度1 mg/mL。Transwell小室、24孔培养板和枪头在-20 ℃下预冷却过夜,将含有双抗体的培养基加入到24孔板中并置于Transwell小室中,将100 μL Matrigel垂直添加到Transwell小室上室底部中心,在37 ℃孵育4 h逐渐变成凝胶状。Transwell上室分别加入200 μL各组细胞悬液,下室加入500 μL含10%胎牛血清的DMEM培养基,常规培养24 h后取出小室,棉签擦拭去上室的细胞,用70%冰乙醇溶液固定细胞1 h,0.5%结晶紫染料溶液染色20 min,在显微镜下取10个视野观察拍照,计算各组下室侵袭细胞数目。
1.6 不同浓度ART对ACC-2细胞迁移能力的影响观察 采用Transwell迁移实验。除不铺Matrigel基质外,其他步骤同“1.5”,在显微镜下取10个视野观察拍照,计算各组下室迁移细胞数目。
1.7 不同浓度ART对ACC-2细胞HMGB1蛋白表达的影响观察 采用Western blotting法。细胞分组及药物干预方法同“1.4”。各组细胞置于37 ℃、5% CO2、饱和湿度的培养箱中继续培养48 h,PBS洗涤细胞,应用预冷的蛋白裂解液冰上裂解30 min,12 000 r/min离心15 min后提取细胞总蛋白,BCA蛋白定量法测定各组细胞蛋白浓度。各组细胞蛋白电转移到PVDF膜上,脱脂奶粉封闭2 h,加入β-actin、HMGB1多克隆抗体,TBST洗涤5次,每次5 min,加入羊抗小鼠二抗,37 ℃摇床中孵育2 h,制备胶片,BandScan扫描分析各组细胞HMGB1蛋白灰度值,以灰度值表示HMGB1蛋白的相对表达水平。
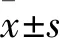
2 结果
2.1 不同浓度ART对ACC-2细胞增殖的影响结果比较 培养0、24、48、72、96 h时,125 μg/mL组细胞增殖率分别为100.7%±8.7%、77.5%±5.2%、61.0%±7.7%、50.6%±3.3%、39.0%±2.6%,250 μg/mL组细胞增殖率分别为99.5%±7.3%、63.3%±3.6%、50.4%±3.4%、38.1%±2.7%、25.5%±2.3%,500 μg/mL组细胞增殖率分别为101.5%±2.4%、56.0%±2.9%、38.2%±3.7%、28.9%±2.3%、11.0%±2.4%,对照组细胞增殖率均为100.0%,各组培养24、48、72、96 h时细胞增殖率相比,P均<0.01,提示随着药物作用时间的延长,ART抑制ACC-2细胞增殖的作用也愈发明显,呈浓度依赖性。
2.2 不同浓度ART对ACC-2细胞凋亡的影响结果比较 125 μg/mL组、250 μg/mL组、500 μg/mL组、对照组细胞凋亡率分别为21.98%±0.44%、34.76%±1.74%、49.94%±1.43%、2.30%±0.17%,组间相比,P均<0.01,提示ART对ACC-2细胞凋亡有显著的促进作用,且细胞凋亡促进作用随药物浓度的增加而增加。
2.3 不同浓度ART对ACC-2细胞侵袭能力的影响结果比较 125 μg/mL组、250 μg/mL组、500 μg/mL组、对照组侵袭细胞数目分别为(61±3)个、(39±3)个、(15±1)个、(99±8)个,组间相比,P均<0.01,提示ART可抑制ACC-2细胞的侵袭能力,且细胞侵袭能力抑制作用具有一定的浓度依赖性。
2.4 不同浓度ART对ACC-2细胞迁移能力的影响结果比较 125 μg/mL组、250 μg/mL组、500 μg/mL组、对照组迁移细胞数分别为(93±13)个、(69±3)个、(30±3)个、(164±16)个,组间相比,P均<0.01,提示ART可抑制ACC-2细胞的迁移能力,且随着药物浓度的增加,迁移的细胞数量减少。
2.5 不同浓度ART对ACC-2细胞HMGB1蛋白表达的影响结果比较 125 μg/mL组、250 μg/mL组、500 μg/mL组、对照组细胞HMGB1蛋白相对表达水平为0.798±0.064、0.667±0.079、0.424±0.019、0.887±0.045,组间相比,P均<0.01,提示ART可以降低ACC-2细胞中HMGB1蛋白的表达,且表达下调作用具有一定的浓度依赖性。
3 讨论
青蒿素是中国学者屠呦呦等人于1972年从草本植物青蒿中分离出来的化学物质,用于治疗疟疾[13]。近年来的研究[14,15]表明,青蒿素及其衍生物如ART、青蒿琥酯和双氢青蒿素等,不仅仅在治疗疟疾方面卓有成效,并且其在抑制肿瘤方面也表现出了巨大的潜力和前景。国内外研究[16]表明,对于体外培养的头颈部恶性肿瘤细胞,青蒿素及其衍生物均存在较强的抑制作用。双氢青蒿素可通过活性氧积累和线粒体依赖性凋亡途径促进破骨细胞凋亡来保护脂多糖诱导的骨丢失,从而达到治疗炎性骨丢失的作用[8]。青蒿琥酯可抑制白血病细胞K562细胞增殖,从而抑制肿瘤生长,达到治疗目的[9]。越来越多的基础和临床实验研究[17~20]发现,ART可以选择性地抑制某些肿瘤的生长、转移、血管生成以及炎症反应。
本研究将不同浓度的ART作用于ACC-2细胞,CCK8增殖检测结果显示,在药物作用24 h后ART即表现出对ACC-2细胞增殖的有效抑制,伴随作用时间的延长,抑制ACC-2细胞增殖的作用愈发明显,显示出浓度依赖性作用。Transwell小室实验常用于检测体外恶性肿瘤细胞的侵袭和迁移能力。本研究结果表明,ART在125、250、500 μg/mL浓度均可抑制ACC-2细胞的侵袭和迁移能力,且随药物浓度的升高抑制愈发明显。这一结果同HMGB1蛋白表达水平结果保持较高同步性和一致性,ART浓度越高,HMGB1蛋白表达水平下降的越明显,说明ART可以有效降低HMGB1的表达,提示ART可能是通过HMGB1蛋白的表达参与了调控过程,进而有效抑制ACC-2细胞的增殖、凋亡、侵袭和迁移。
综上所述,ART能够明显抑制SACC细胞的增殖、侵袭和迁移,促进其凋亡,对SACC细胞的生长起着明显的抑制作用,并且抑制作用与ART浓度有关,其机制可能与下调HMGB1蛋白的表达有关。本研究为ART在SACC治疗中的临床应用提供体外支持,为其治疗研究提供一个新的方向。
——青蒿素

