差速离心、密度梯度离心、超滤离心技术在骨髓间充质干细胞外泌体提取中的应用对比观察
罗靖莹,贺宏丽,郭阳,黄玮玮,黄晓波
(电子科技大学附属医院/四川省人民医院,成都610072)
间充质干细胞(MSCs)作为一种具有多向分化潜能的细胞,因其在再生医学领域和临床试验中对各种疾病的治疗效果受到广泛关注。骨髓间充质干细胞(BMSCs)常被作为细胞再生的理想供体细胞,主要的作用机制包括归巢、调节免疫、转分化及旁分泌[1~4]。外泌体是一种由脂质双分子层包裹的膜性囊泡,大小通常在20~100 nm。研究[5~9]显示,外泌体广泛存在于尿液、胸腹腔积液、乳汁、唾液等体液中,而且很多细胞可以分泌外泌体,如MSCs、血细胞、内皮细胞、神经细胞、肿瘤细胞等;外泌体内含有各种蛋白质、脂类和mRNA、miRNA、DNA片段等遗传物质,细胞间可以通过外泌体交换信息、相互作用,且免疫排斥风险较低,在各种病理状态及炎症反应中发挥着重要的作用。内皮细胞和上皮细胞受损是炎症反应中至关重要的环节,已证实MSCs可以通过外泌体修复受损的内皮细胞[10]。外泌体体积小且不稳定,因此如何快速有效地分离和提取外泌体是目前面临的主要挑战。分离和提取外泌体的方法主要有离心法、免疫磁珠法、PEG沉淀法、试剂盒法等,其中常用的离心法主要有差速离心技术、密度梯度离心技术和超滤离心技术[11]。差速离心技术主要是依据粒子大小和密度设置不同的离心力,通过平衡沉降原理来分离外泌体。密度梯度离心技术通常采用蔗糖作为分离介质,与重水一起配置成1.1~1.19 g/mL的密度垫,根据不同沉降系数物质在离心力作用下的分层分布,以此分离出外泌体[12]。超滤离心技术是在一定压力下使溶质通过不同孔径的滤膜,从而筛选出外泌体。2018年6月2日~2018年9月1日,本研究观察了差速离心、密度梯度离心、超滤离心技术在BMSCs外泌体提取中的应用,筛选外泌体最佳离心提取方法。
1 材料与方法
1.1 细胞、试剂及仪器 BMSCs、肺微血管内皮细胞(PMVECs)购自美国sciencell公司,DMEM/F12培养基、胎牛血清(FBS)购自美国Gibco公司,抗CD9、CD63、Alix、GAPDH购自R&D公司,山羊抗兔IgG-HRP、山羊抗鼠IgG-HRP购自美国 Abcam 公司,BCA蛋白试剂盒购自凯基公司,透射电子显微镜购自Philips公司,细胞恒温培养箱购自美国Thermo公司,超速离心机购自Beckman公司,荧光酶标仪购自美国Thermo公司。
1.2 细胞培养、分组及外泌体的提取 BMSCs、PMVECs分别在37 ℃、5% CO2细胞培养箱中,用含有10%胎牛血清(FBS)和5%双抗的DMEM/F12培养基进行培养。取第4~5代BMSCs培养至60%~70%融合时,更换为无血清培养基,继续培养48 h后收集细胞上清360 mL,平均分成A、B、C组,每组120 mL,分别使用差速离心技术、密度梯度离心技术、超滤离心技术提取外泌体。记录各组外泌体提取时间。①差速离心技术提取外泌体。取A组细胞上清以3 000×g离心20 min,去除细胞碎片和大分子物质,在4 ℃条件下100 000×g离心60 min,弃上清,加入4 ℃的PBS重悬,然后在4 ℃条件下100 000×g离心60 min,将沉淀物用200 μL预冷的PBS重悬,用0.22 μm滤过膜过滤,即得BMSCs外泌体。②密度梯度离心技术提取外泌体。取B组细胞上清以300×g离心10 min,去除细胞碎片和大分子物质,10 000×g离心30 min,去除微泡,延离心管壁缓慢加入4 mL 30%蔗糖溶液,形成一单层,在4 ℃条件下100 000×g离心90 min,弃上清,将蔗糖层重悬于PBS中,再在4 ℃条件下100 000×g离心90 min,将获得的沉淀物重悬于200 μL预冷的PBS中,即得BMSCs外泌体。③超滤离心技术提取外泌体。在超滤离心管中加入PBS缓冲液,室温条件下3 000×g离心15 min,去除甘油和其他保存剂;取C组细胞上清以17 000×g离心15 min,然后加入超滤离心管中以3 000×g离心30 min,用200 μL PBS重悬超滤膜上的沉淀物,即得BMSCs外泌体。
1.3 A、B、C组外泌体形态观察 采用负染色技术。向载样铜网上分别加入提取的A、B、C组外泌体混悬液20 μL,室温静置3 min后用滤纸吸干液体,再加入30 μL的3%磷钨酸溶液负染5 min,滤纸吸干、晾干,透射电镜下观察各组外泌体形态。
1.4 A、B、C组外泌体浓度及大小测算 取A、B、C组外泌体悬液100 μL稀释于2 mL PBS内,使用纳米颗粒跟踪分析仪(Nanosight)测算各组外泌体浓度,并根据每个粒子的布朗运动与斯托克斯-爱因斯坦(Stokes-Einstein)方程测算各组外泌体大小。
1.5 A、B、C组外泌体总蛋白及表面标志蛋白CD9、CD63、Alix的检测 ①采用BCA法测定A、B、C组外泌体总蛋白浓度。②采用Western blotting法检测A、B、C组外泌体表面标志蛋白CD9、CD63、Alix。取A、B、C组外泌体悬液100 μL,加入RIPA裂解液于冰上裂解10 min,使用超声破碎外泌体后于4 ℃条件下15 000×g离心10 min,制得各组外泌体蛋白样本。取各组外泌体蛋白样本与上样缓冲液混合煮沸5 min使蛋白变性,然后进行SDS-PAGE电泳,半干时转至PVDF膜上,用5%脱脂奶粉封闭,加入一抗,4 ℃过夜,TBST清洗3次,加入相应二抗,室温孵育1 h,TBST清洗3次,以GAPDH为内参,ECL化学发光系统检测各组外泌体表面标志蛋白CD9、CD63、Alix灰度值,计算各组外泌体表面标志蛋白CD9、CD63、Alix的相对表达量。外泌体表面标志蛋白的相对表达量=外泌体表面标志蛋白灰度值/GAPDH灰度值。
1.6 外泌体内皮细胞通透性检测 采用100 ng/mL的脂多糖(LPS)干预PMVECs 6 h构建内皮细胞损伤模型。采用Transwell小室进行葡聚糖渗漏实验。将PMVECs分成5组,EC组上室加入1×105个PMVECs以及100 μL完全培养基;LPS组上室加入1×105个PMVECs以及100 μL 含100 ng/mL LPS的完全培养基;A、B、C组上室加入方法同LPS组,下室分别加入A、B、C组外泌体100 μg,用不含酚红、血清的培养基重悬至400 μL。各组上室弃上清,加入不含酚红、血清的培养基配制的FITC-葡聚糖(40 kDa,0.5 mg/mL)100 μL,下室加入等浓度无FITC标记的葡聚糖100 μL,37 ℃、5% CO2、避光条件下培养40 min,吸取上、下室液体各100 uL,在激发光波长490/485 nm、发射光波长525/530 nm处,采用荧光酶标仪检测荧光强度,计算内皮细胞通透系数。内皮细胞通透系数=([A]/t)×(1/A)×(v/[L])。其中[A]为下室荧光强度;t为时间,单位为s;A 为滤过面积,单位为cm2;v 为下室液体量;[L]为上室荧光强度。各组外泌体内皮细胞通透性以各组内皮细胞通透指数表示。各组内皮细胞通透指数=各组内皮细胞通透系数/EC组内皮细胞通透系数。
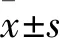
2 结果
2.1 A、B、C组外泌体提取时间比较 A、B、C组的外泌体的提取时间分别为(180±8)、(203±10)、(40±5)min,A、B组外泌体的提取时间与C组相比,P均<0.05;A组外泌体的提取时间与B组相比,P>0.05。
2.2 A、B、C组外泌体形态比较 如图1所示,各组外泌体均为大小不等的椭圆形或圆形的膜性结构,边界清晰,但仅A组外泌体可见到典型的杯状结构。

2.3 A、B、C组外泌体浓度及大小比较 A、B、C组的外泌体浓度分别为(4.46±0.38)×108/mL、(5.11±0.16)×108/mL、(2.18±0.17)×108/mL,A、B组与C组外泌体浓度相比,P均<0.05;A组与B组外泌体浓度相比,P>0.05。A、B、C组的外泌体大小均为20~100 nm。
2.4 A、B、C组外泌体总蛋白浓度及表面标志蛋白CD9、CD63、Alix的表达比较 如表1所示, A、B组外泌体总蛋白浓度及CD63、Alix的相对表达量均显著高于C组(P均<0.05)。
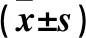
表1 A、B、C组外泌体表面标志蛋白CD9、CD63、Alix的表达比较
注:与C组相比,﹡P<0.05。
2.5 A、B、C、LPS、EC组内皮细胞通透指数比较 A、B、C、LPS、EC组内皮细胞通透指数分别为2.17±0.15、1.77±0.32、2.37±0.42、2.93±0.15、1.00±0.00,A、B、C、LPS组的内皮细胞通透指数与EC组相比,P均<0.05;a、b组的内皮细胞通透指数与LPS组相比,P均<0.05;其余各组间相比,P均>0.05。
3 讨论
BMSCs是成体干细胞的一种,具有高度自我更新能力和多向分化潜能,且具有免疫调节作用,是组织工程学中常用的种子细胞,其对临床上常见的急性肺损伤/急性呼吸窘迫综合征、心肌梗死、糖尿病、肝肾功能衰竭等多种疾病的治疗效果受到了广泛的关注。随着研究的深入进展,研究人员发现MSCs主要是通过旁分泌机制进行组织器官的保护[13]。胞外囊泡(EV)被认为是细胞间信息交流和物质传递的新机制[14]。根据粒径大小和分泌机制的不同,EV可分为100~1000 nm的微泡(MV)和20~100 nm的外泌体。研究[15]显示,外泌体易获取、易储存,无致瘤性,在再生医学、器官移植、疾病诊断和药物传递等方面发挥了不可或缺的作用,但目前并无标准的分离提取技术,如何提高浓度、保证纯度、维持活性、节约时间,是目前临床亟需解决的问题。
本研究首先采用差速离心技术、密度梯度离心技术和超滤离心技术提取BMSCs外泌体,随后对分离提取的外泌体进行了比较。各组外泌体提取时间对比显示,超滤离心技术提取外泌体用时最少;通过透射电镜和Nanosight观察到,3种方法均可以分离出大小不等的椭圆形或圆形的膜性结构,大小在20~100 nm;通过BCA蛋白定量法和NTA公式计算出,密度梯度离心技术提取的外泌体总蛋白和外泌体浓度最高,差速离心技术其次,超滤离心技术最低;3种方法提取的外泌体均可表达特异性表面标志物CD9、CD63、Alix,差速离心技术和密度梯度离心技术CD63和Alix的表达明显高于超滤离心技术,说明超滤离心技术分离出来的外泌体浓度和纯度均较低。
PMVECs既是急性肺损伤时的受害者,也是启动者,在急性呼吸窘迫综合征(ARDS)发生时,PMVECs的通透性显著升高。本研究通过LPS干预PMVECs构建了内皮细胞损伤模型,观察各离心技术提取的外泌体对受损内皮细胞的修复作用,结果显示,与LPS组相比,A、B组外泌体内皮细胞通透指数显著下降,说明差速离心技术和密度梯度离心技术提取的外泌体具有更强的内皮细胞修复能力,可能与差速离心技术和密度梯度离心技术提取的外泌体浓度和纯度更高有关,但后期仍需研究更多的内皮细胞功能实验验证。
差速离心技术步骤简单,产物纯度高。但差速离心技术也有一定的缺点,反复的离心提纯过程会造成外泌体丢失及影响囊膜的完整性,且易形成聚合物[16];密度梯度离心技术提取产物更纯,且不影响外泌体的活性,但是准备工作繁琐,程序复杂且耗时长。超滤离心技术过程简单、速度快,但可能存在杂蛋白污染,部分外泌体也可能黏附于滤膜上导致产物损失以及活性丧失[17]。
综上所述,密度梯度离心技术虽耗时较长,但提取的外泌体纯度、浓度较高,对内皮细胞的修复作用较强,可以作为科研和临床研究的首选外泌体离心提取方法。

