干旱诱导的海藻糖和脱落酸对苹果品质的影响
孙汉青,陶红霞,宋雪娜,郭延平,赵政阳
(西北农林科技大学 园艺学院,陕西杨凌 712100)
干旱是影响农业生产的重要环境因子之一。在中国西北地区,由于水资源缺乏,春旱、伏旱现象严重,会影响苹果树的正常生长发育,导致果实品质下降。有研究发现,适度干旱能够导致碳水化合物质量分数增加,但其与碳信号之间的相互作用关系仍然不清楚[1]。
苹果果实中含有的糖类主要是淀粉、蔗糖、果糖、葡萄糖和少量的山梨醇,其中除淀粉外均为可溶性糖,可溶性糖中以果糖最甜。果实风味及品质会受到果实总糖水平及果糖与葡萄糖的比值(F/G)的影响[2]。在苹果等蔷薇科植物中,山梨醇是光合产物运输的主要形式[3],苹果韧皮部中,转运过程中的碳水化合物中山梨醇占80%[4],起着其他植物中蔗糖的作用。
海藻糖(α-D-glucopyranosyl-1,1-α-D-glucopyranoside)是由2个葡萄糖分子组成的双糖,是一种安全、可靠的天然糖类,为非还原性糖,是糖类物质中性质最稳定的双糖之一[5]。海藻糖代谢途径包括:尿苷二磷酸葡萄糖(UDPG)和6-磷酸葡萄糖(G-6-P)在6-磷酸海藻糖合成酶(TPS)的作用下生成6-磷酸海藻糖(T6P),T6P在6-磷酸海藻糖磷酸酯酶(TPP)的作用下生成海藻糖,海藻糖在海藻糖酶(TRE)的作用下分解为葡萄糖[6]。海藻糖有调节生物合成的功能,因为海藻糖可以修饰蛋白激酶,与14-3-3蛋白相互作用,从而参与它们的信号分子功能[7]。也有研究表明,海藻糖前体T6P在植物生长发育中被作为一个重要的信号分子可以影响植物生长及对碳的利用,在糖代谢过程中起重要的调节作用[8]。T6P与蔗糖非酵解蛋白激酶1(SnRK1)能协同调节植物的生长与发育[9],当碳源缺乏时,植物体内T6P质量分数会减少,随后SnRK1活性增加,进而降低植物碳源消耗,增加碳同化进程和光合作用,最终使植物体内积累大量碳水化合物[10]。SnRK1是蔗糖非发酵(sucrose non-fermenting,SNF)相关的腺苷-磷酸蛋白激酶[adenosine 5’-monophosphate(AMP)-activated protein kinase,AMPK]家族中的一员,是调控细胞响应内源能量及碳状态的中枢[11],在T6P抑制SnRK1活性后,会进而影响bZIP11启动子调控相关基因表达[12]。bZIP在植物发育和代谢过程中起关键性调控作用,主要功能是调节基因表达的强度,或应答外源激素和环境的胁迫[如参与植物对脱落酸(ABA)、光等发育中各种信号的反应][13]。植物遭遇盐、干旱或低温等非生物胁迫时,会产生ABA同时激活ABA依赖途径和ABA非依赖途径2种信号传导通路[14],参与ABA依赖途径的基因不仅诱导ABA的生物合成,而且调节含有ABA响应元件(ABRE元件)的基因的表达。bZIP转录因子家族中的A亚族可以与ABRE元件结合[13]。
为了探讨在适度干旱条件下,苹果果实品质的提升与海藻糖及ABA在糖代谢途径中的共同调节作用关系。本试验主要研究在适度水分胁迫下,苹果果实风味及品质发生改变的过程中,海藻糖与ABA在其中的作用,为探究适度干旱条件下果实品质提升的原因提供新的思路。
1 材料与方法
1.1 试验材料
试验在西北农林科技大学北园艺场(34°20′N,108°24′E)进行,试材为7~8 a生的盆栽嘎啦Gala/M26苹果树。
1.2 试验方法
2016年3月选取生长状况基本一致且无病虫害的植株,栽于盆高50 cm×直径60 cm的塑料盆中,基质选用园地表层土壤、有机肥与种植基质混合而成,有机质的质量分数为5%,每盆基质约100 kg,栽后保持水分充足,并预防病虫害的发生。
处理1(干旱胁迫):花后100 d,即7月15日开始用土壤烘干法控水,分别为田间最大持水量的75%~80%(CK1)、60%~65%(A)、50%~55%(B),每株为1个重复,重复6次,每隔7~9 d采1次样,共5次。
采用土壤烘干法控制土壤水分:每天从盆中不同方位20 cm深处取土带回实验室,测定湿土及烘干后土质量,计算公式如下:田间持水量=(湿土质量-干土质量)/干土质量,根据所需控水程度补充定量水分。
处理2(外源ABA处理):最佳采收期前20 d,即7月24日选取果型端正,生长状况一致无病虫害的100个果实,用医用注射器将配置好的ABA溶液和蒸馏水从苹果果实萼端中心口注入果实气腔内,以没有机械损伤为成功,分为2个梯度,0(蒸馏水)(CK2)和1 mmol/L(ABA),每个果实为1次重复,重复6次,3~4 d采1次样,共5次。
1.3 测定项目及方法
将果实分为两份,一份用来测定品质指标,单果质量、横纵径、色度等外观品质,内在品质测定可滴定酸、可溶性固形物、硬度等;另一份用蒸馏水清洗后,将果实切块,用锡箔纸包裹置于液氮中带回实验室,存放于―80 ℃冰箱,用以测定葡萄糖、果糖、蔗糖、山梨醇、海藻糖的质量分数和相关酶活性及内源ABA质量分数。
1.3.1 果实品质指标 用万分之一分析天平测单果质量,电子数显卡尺guanglu牌,分辨率为0.01 mm的游标卡尺,测纵横径,果形指数为果实纵径与横径比值。用CR-400色度计测定果皮色度,L*表示亮度,a*表示红绿色度,b*表示黄蓝色度。取匀浆用PAL-BX迷你数显折射计测可滴定酸和可溶性固形物,削皮后使用果实硬度计GY-J测果实硬度。
果实含水量:分别测定果实鲜质量(m1);将果实置于65 ℃烘箱中烘8 h,取出冷却至室温,称此时的质量,再烘1 h后,取出冷却至室温再次称量,重复以上步骤,直到恒量即为果实干质量(m2),果实含水量=(m1-m2)/m1×100%。
1.3.2 可溶性糖质量分数 参照梁俊等[15]的提取方法及测定方法,并加以改进。具体为:准确称取1 g果实冻样,加入3 mL 超纯水,80 ℃水浴超声波提取30 min,重复3次,10 000 g离心10 min,合并上清液,用0.45 μm滤膜过滤待测。利用高效液相色谱(HPLC)测定4种可溶性糖,果糖、葡萄糖、山梨醇和蔗糖。色谱条件为-Sugar-PakTMI(Waters)色谱柱,柱温80 ℃,检测器为示差折光检测器(Waters 410),流动相为超V(纯水)∶V(甲醇)=200∶1。
1.3.2 海藻糖质量分数 果实中海藻糖质量分数的测定参考Garg等[16]的方法,并适当改变。具体为:准确称取冻干样1 g,用3 mLφ= 85%乙醇75 ℃超声提取海藻糖30 min,13 000 g离心15 min取上清液,沉淀再加3 mL乙醇重新提取,最后上清混合,样品烘干,加1 mL蒸馏水复溶,用0.45 μm滤膜过滤待测。加入海藻糖酶将海藻糖分解为2分子葡萄糖,用葡萄糖试剂盒Sigma Glucose(HK)Assay Kit测定葡萄糖质量分数。
1.3.3 TPS和TPP活性 参考Ilhan 等[17]的方法并加以改进。酶液提取:液氮速冷果肉研磨成粉末于―80 ℃贮存。提取时,称取0.5 g果肉粉末加入2 mL 50 mmol/L 氨丁三醇-盐酸(pH7.5)(Tris-HCl)缓冲液,其中含100 mmol/L NaCl,100 mmol/L 二硫苏糖醇(DTT)和100 mmol/L 苯甲基磺酰氟(PMSF),置研钵于4 ℃下研磨。13 000 g 以下离心5 min,上清液于4 ℃下存贮,用于酶活测定。
TPS活性:反应体系包括50 mmol/L N-三(羟甲基)甲基甘氨酸缓冲液(pH 7.0)(tricine),10 mmol/L 6磷酸葡萄糖,5 mmol/L 尿苷二磷酸葡萄糖(UDPG)和12.5 mmol/L MgCl2,加入酶液后共0.4 mL,35 ℃下孵育30 min后,沸水浴5 min停止反应;第2个反应取上清液加140 mmol/L tricine(pH 7.6),2 mmol/L磷酸烯醇式丙酮酸,0.31 mmol/L 烟酰胺腺嘌呤二核苷酸还原态(NADH)和5U乳酸脱氢酶,加入5 U丙酮酸激酶后开始反应,用紫外分光光度计在340 nm处测定计算释放尿苷二磷酸(UDP)质量分数,用单位时间内释放的UDP质量分数表示TPS活性。
TPP活性:反应体系包括1 mmol/L 6-磷酸海藻糖,10 mmol/L MgCl2,50 mmol/L Tris-HCl缓冲液(pH 7.5)加入酶液共2.5 mL体系,于37 ℃ 孵育30 min,沸水浴5 min停止反应;反应生成海藻糖,加入海藻糖酶后用葡萄糖试剂盒Sigma Glucose(HK)Assay Kit测定生成葡萄糖质量分数代表TPP活性。
1.3.4 TRE活性 参考Lopez等[18]的方法并加以改进。酶液提取:称取0.3 g果肉粉末,加入2 mL提取液[100 mmol/L 2-(N-吗啡啉)乙磺酸-氢氧化钾(pH 6.3)(MES-KOH)含2 mmol/L 乙二胺四乙酸二钠(EDTA)和2 mmol/L 交联聚维酮(PMSF)]并加适量PVPP研磨成匀浆,13 000 g 4 ℃以下离心5 min,取上清液用于酶活测定。
TRE活性:反应体系中酶液加入100 mmol/L 海藻糖,50 mmol/L MES-KOH(pH 6.3)缓冲液共0.6 mL,37 ℃孵育45 min后沸水浴5 min,反应生成的葡萄糖利用葡萄糖试剂盒(同上)测定生成葡萄糖表示海藻糖酶活性。
1.3.5 果实内源ABA质量分数 ABA提取参考杨方威[19]的方法:称取样品1 g,在冰浴下研磨成浆,加入φ=70%冷丙酮20 mL,保鲜膜密封,在4 ℃冰箱里冷浸过夜。离心分离,浸提液转入150 mL烧瓶中,加10 mL丙酮润洗离心管离心分离后与浸提液合并,40 ℃减压蒸发至没有丙酮残留,剩余水相完全移到三角瓶中,用30 mL石油醚萃取脱色2次,弃去醚层,水相调pH至3.0,用乙酸乙酯萃取3次,每次10 mL,收集酯相。水相调pH至8.0,再用乙酸乙酯萃取3次,每次10 mL,合并酯相,在40 ℃下减压蒸干。流动相定容至10 mL,用0.22 μm超微有机滤膜过滤,滤液即可作为样品液,进行高效液相色谱测定。色谱柱:XR-ODS 1.6 μm(2.0 mm×75 mm Column);以甲醇和φ=0.1%冰乙酸溶液体积比28∶72为流动相,测定样品中ABA质量分数。
1.4 数据分析
用WPS Excel 2010对试验数据进行处理,结果以“平均值±标准误”表示,结合SPSS 21.0软件进行方差分析,多个数据间差异显著性检验用新复极差法,2个数据间差异显著性检验用t检验,用Origin 9.0软件绘图。
2 结果与分析
2.1 干旱处理对苹果品质性状的影响
表1结果显示,在花后100 d开始干旱胁迫后,单果质量受到一定影响,干旱程度越强,单果质量显著下降,处理B条件下下降显著,处理A轻度干旱条件下较对照组单果质量有所下降,但并不显著。然而果实相对含水量并没有随干旱程度的加深而改变,果形指数也无显著变化。

表1 采收期不同程度水分胁迫条件下果实的品质性状Table 1 Fruit quality under different drought stresses during harvest time
注:同列不同小写字母表示差异显著(P<0.05)。
Note:Different lowercase letters in the same column indicate significant difference(P<0.05).
果实色度只有a*值随干旱程度的加深而降低,说明果皮红绿的变化受水分胁迫影响较大。果实硬度和可滴定酸在果实受到干旱胁迫后显著下降,可溶性固形物则显著升高,然而不同程度的控水处理间并无显著差异。
2.2 干旱和注果处理对果实糖分积累的影响
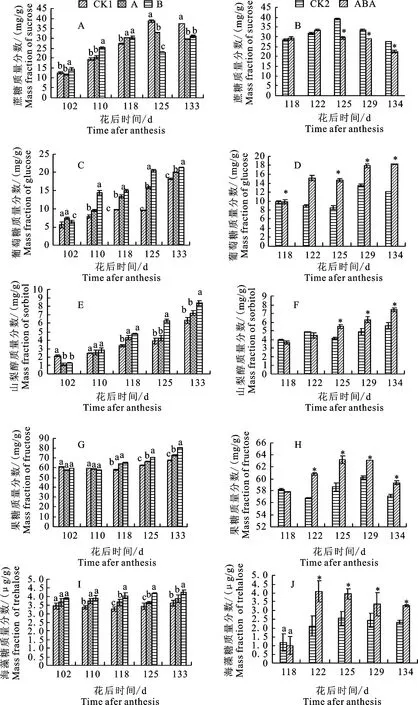
进入果实成熟期,果实中蔗糖处于缓慢积累过程中(图1-A);果实成熟前期水分胁迫显著促进蔗糖的积累,从花后125 d开始则显著抑制蔗糖的积累,说明成熟前期干旱促进了蔗糖的积累,后期则抑制蔗糖积累。在外源ABA处理的果实中,蔗糖的积累表现近乎相同的过程,但其中抑制蔗糖积累发生在花后125 d。蔗糖的抑制发生在干旱后20 d,外源ABA处理后8 d,说明蔗糖的积累对ABA质量分数更加敏感。
苹果果实中葡萄糖质量分数的积累受水分胁迫条件的影响而显著增加(图1-B),并且在花后110 d显著变化,水分胁迫程度越深,越能促进葡萄糖的积累,说明水分胁迫能促进成熟期果实葡萄糖的积累。在外源注射ABA的试验中,葡萄糖质量分数在花后122 d显著增加,这和干旱处理结果一致。
山梨醇的质量分数随果实进入成熟期而逐渐升高(图1-C),干旱处理后山梨醇质量分数显著增加,其中处理B山梨醇积累更加明显,这说明干旱可以提高山梨醇在果实中的质量分数。外源注射ABA的果实中,相对于对照组果实山梨醇质量分数显著升高,说明ABA能促进山梨醇的积累。
通过图1-D可以看出,干旱处理后果糖质量分数相对于水分充足条件下显著增加,并且水分亏缺程度越大,果糖质量分数增加越显著,说明干旱有利于果糖的积累。外源注射ABA后,果实中果糖质量分数也显著增加,这与干旱处理下的果糖质量分数变化是一致的,说明干旱条件下产生ABA能促进果糖的积累。海藻糖相比其他糖来说质量分数很低,并且在成熟期海藻糖质量分数波动不大(图1-E)。在干旱条件下,海藻糖质量分数比水分充足时显著升高,其中处理B中度胁迫条件下海藻糖质量分数增加的更为显著,说明干旱有利于海藻糖的积累。在注果试验中,注果之前海藻糖质量分数几乎持平,注果后海藻糖质量分数显著增加,这与干旱处理结果保持一致,说明ABA有利于海藻糖在果实中的积累。
2.3 干旱和注果处理对果实内源ABA质量分数的影响
由图2可知,注果后果实中ABA质量分数显著增加,外源添加ABA后促进了内源ABA的积累;干旱处理后内源ABA质量分数显著增加,最高可达正常情况的2倍。说明干旱处理和外源添加脱落酸对果实内源ABA的影响是一致的。
2.4 干旱和注果处理对果实中海藻糖代谢相关酶活性的影响
图3-A中,干旱处理花后118 d,TPS活性逐渐增加,但不同处理间无显著差别,到花后125 d后,经过干旱处理过的果实TPS活性显著增加,干旱程度越大酶活性增加越多,说明干旱可以促进TPS的催化功能。图3-B可以看出,外源添加脱落酸后, 花后129 d后TPS活性开始显著增加,说明ABA对TPS活性也有相同的作用。因为干旱可以促进果实中ABA的积累,所以可以推测果实中TPS活性的改变是因为干旱诱导了内源ABA的产生而变化的。
由图4-A可以发现TPP活性对水分胁迫十分敏感,开始控水后TPP活性开始显著增加,并且水分胁迫越严重,TPP活性增加越显著,图4-B中外源添加ABA后TPP活性同样显著增加,可以推测出:干旱后植物产生的脱落酸可能是影响TPP活性变化的重要因素。TPP活性越大越有利于海藻糖的形成,这也与图1-I和图1-J海藻糖质量分数的增加结果一致。
TRE催化海藻糖分解成葡萄糖,是植物体中海藻糖降解的重要途径,图5-A中花后118 d后TRE活性显著降低,并且水分缺少越严重的TRE活性下降的越显著。图5-B显示外源添加脱落酸后TRE活性也在花后125 d后开始显著下降。说明干旱条件下植物产生的脱落酸会导致TRE活性的降低,抑制海藻糖的分解。
从海藻糖质量分数与海藻糖代谢相关酶活性变化来看,在干旱胁迫下海藻糖质量分数与TPS、TPP活性呈正相关关系,尤其与TPP几乎在干旱胁迫后同一时间段受到了影响。与TRE则呈负相关关系。因此有利于海藻糖在干旱条件下积累。外源添加ABA后,内源ABA质量分数与TPS、TPP活性呈正相关的关系而与TRE则呈负相关,这与干旱条件下对海藻糖代谢酶的影响是一致的。
不同小写字母表示同一处理不同时期呈显著相关(P<0.01) Different lowercase letters show significant correlation among different periods(P<0.01),*表示差异显著(P<0.05) Indicates significant difference (P<0.05) ,**表示差异极显著 Indicates significant difference (P<0.01)
图1不同程度水分胁迫和外源添加ABA处理对苹果果实蔗糖、葡萄糖、山梨醇、果糖和海藻糖质量分数的影响
Fig.1EffectsofdroughtstressandexogenousABAtreatmentonapplesucrose,glucose,sorbitolfructoseandtrehalosemassfractions
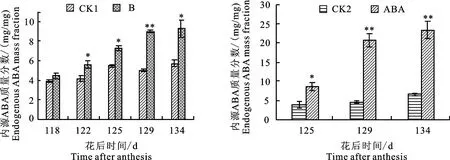
图2 不同程度水分胁迫和外源添加ABA处理对苹果果实内源脱落酸质量分数的影响Fig.2 Effects of drought stress and exogenous ABA treatment on apple endogenous ABA mass fraction

图3 不同程度水分胁迫和外源添加ABA处理对苹果果实TPS活性的影响Fig.3 Effects of drought stress and exogenous ABA treatment on apple TPS activity

图4 不同程度水分胁迫和外源添加ABA处理对苹果果实TPP活性的影响Fig.4 Effects of drought stress and exogenous ABA treatment on apple TPP activity
3 讨论与结论
当植物受到干旱胁迫时根系会产生脱落酸并通过木质部从根输送到地上部[20],在植物遇到非生物胁迫时提高植物的抗性。而海藻糖已被证明在高等植物体中存在,可以作为渗透调节物质帮助植物抵抗逆境[21],研究表明,一些耐旱生物在遇到胁迫环境时,生物体中海藻糖质量分数会增加[22],海藻糖具有很强的抗脱水作用,因此海藻糖可以在干旱、寒冷以及高盐碱等逆境条件下保护生物膜及蛋白质免受伤害[23]。
在本试验中,通过干旱处理和外源添加脱落酸,希望为干旱条件下苹果果实中糖质量分数升高,品质提升提供新的研究思路。进行比较后发现,2种处理均造成了果实中脱落酸质量分数的增加,这样的结果为探究脱落酸在干旱胁迫条件下对海藻糖代谢途径的影响提供了可能性。

图5 不同程度水分胁迫和外源添加ABA处理对苹果果实内TRE活性的影响Fig.5 Effects of drought stress and exogenous ABA treatment on apple TRE enzyme activity
本试验发现不仅是干旱条件下海藻糖质量分数会显著增加,外源增加ABA后海藻糖质量分数也显著提高,因此可以推测ABA可以促进海藻糖的积累。有研究发现:在干旱条件下,柳枝黍中海藻糖和ABA质量分数均会显著上升[24],在水稻的研究中也发现,ABA可以诱导miR162b来增加水稻的抗旱性,而miR162b的目标基因为OsTRE1,从而抑制了OsTRE1的表达[25]。在本研究中还发现,增加外源ABA后,抑制海藻糖酶的活性,减少海藻糖的分解,同时促进TPP、TPS活性,TPS催化UDPG和G6P反应合成T6P,TPP又将T6P脱磷酸形成海藻糖,酶活性的变化最终使果实中海藻糖质量分数显著增加,所以干旱条件下果实内海藻糖质量分数的升高与内源脱落酸质量分数的升高存在密切联系,这与Ilhan等[17]的研究结果一致。
有研究表明:海藻糖调节着糖代谢的途径,海藻糖代谢的基因调节与糖信号途径的相互作用,能增强光合能力,蔗糖的添加促进大豆根中蔗糖的合成,而加入海藻糖和有效霉素A(海藻糖酶的高效抑制剂),也刺激蔗糖的合成,而加入葡萄糖时,却没有这种促进作用[26]。豆科植物中海藻糖酶基因(PvTRE1)的表达受到RNA干扰(RNAi)而下降,除增加海藻糖质量分数外,还提高了参与碳代谢的相关基因的表达(PvSUS1、PvHXK1、PvSnRK1)[27]。本试验可以看出无论干旱还是外源增加ABA均会促进果实中葡萄糖、果糖和山梨醇的积累。T6P作为海藻糖的前体,与蔗糖有双向调节作用,植物保持着相对恒定的T6P:蔗糖的比值,这个比值是植物维持体内蔗糖水平的稳态机制的一部分[28],在本次试验中,外源添加脱落酸促进海藻糖的积累后,可能由于海藻糖质量分数的升高导致果实中葡萄糖、山梨醇、果糖质量分数的升高及蔗糖质量分数的降低,因此可以推测果实中海藻糖的积累可能与糖代谢有关。海藻糖在糖代谢途径中的作用仍需进一步研究。通过果实基本品质的测定发现,干旱会在一定程度上减少果实单果质量,但轻度干旱(土壤含水量达土壤最大持水量的60%~65%)条件下,果实单果质量下降并不显著,而中度干旱(土壤含水量达土壤最大持水量的50%~55%)则显著降低果实单果质量,其他方面如果实硬度和果实色泽a*,虽然干旱后都显著下降,但中度干旱条件下下降更为显著,并且轻度干旱时果实可溶性固形物的质量分数最大,比中度干旱时质量分数大但并不显著,所以成熟期轻度干旱提高果实品质。
综上所述,在果实成熟期控制土壤相对含水量使果树处于适度干旱条件下,促进果实中糖分的积累,结合干旱处理和外源注射ABA处理可以得出,干旱条件下促进内源脱落酸的积累,影响海藻糖代谢途径相关酶活性的改变,促进海藻糖的积累,有利于果实中可溶性糖质量分数的增加,而海藻糖的积累可能与内源ABA的积累有较大关系。

