矮牵牛海藻糖-6-磷酸合酶基因PhTPS6的克隆与表达分析
王 琦,刘同瑞,刘 娜,熊 枫,张水明,董丽丽
(安徽农业大学 园艺学院,合肥 230036)
海藻糖(Trehalose)是一类广泛存在于细菌、酵母、真菌、昆虫、无脊椎动物以及植物中的非还原性双糖[1]。植物中海藻糖主要以TPS/TPP途径合成:海藻糖-6-磷酸合酶(Trehalose 6-phosphate synthase,TPS)将尿嘧啶核苷二磷酸-葡萄糖(UDP-glucose)与6-磷酸葡萄糖催化生成海藻糖-6-磷酸,随后经由海藻糖-6-磷酸酯酶(Trehalose-6-phosphate phosphatase, TPP)催化生成为海藻糖[2](图1[3])。
TPS作为调节海藻糖合成的关键酶[4],其成员能够参与调节植物的抗逆[5]、成花转变[6]和分枝发育[7]。不同物种中TPS家族成员数量不同:如拟南芥、水稻、杨树[8]、橡胶树[9]等物种中分别含有11、11、12、14个成员。TPS成员通常分为ClassⅠ与ClassⅡ两个亚家族, 后者具有合酶和磷酸酶结构域,但其功能目前并不明晰[10]。TPS6及其他物种中的同源基因通常属于ClassⅡ[4,11-12]。有研究显示AtTPS6的过表达不能互补酵母tps1和tps2的突变体表型,表明其不具有活性或不能直接参与海藻糖代谢[13]。但也有研究发现拟南芥AtTPS6除了参与调控抗旱及株型,还能够调控植物的细胞形状和表皮毛分枝[14]。
矮牵牛不但是园林中应用较为广泛的重要观赏植物,同时由于矮牵牛再生容易,生活周期短,基因组已测序成功[15],遗传背景清晰,也是重要的模式植物。在矮牵牛栽培中,通常需要多次人工打顶促进侧枝发育以达到花朵繁茂的观赏效果,大大提高了生产成本,成为制约产业发展的瓶颈问题。因此,培育多分枝且抗逆性强的矮牵牛新品种是解决矮牵牛高效生产的关键所在。本研究从矮牵牛中分离TPS6同源基因PhTPS6,并对基因的生物信息以及在不同组织、不同处理下的表达特性进行分析。以期为丰富海藻糖合成酶调控植物分枝发育及抗逆机理奠定理论基础。
1 材料与方法
1.1 试验材料
以矮牵牛(P.hybridavar. Mitchell)为材料。矮牵牛材料种置于组织培养室中。光周期:16 h/8 h(光/暗),温度:25℃±2℃,光照度:3 500 lx。
1.2 PhTPS6的克隆
根据已公布的矮牵牛基因组序列(https://solgenomics.net/),设计上游引物F:ATGGTGTCAAGATCCTATTCCAAT, 下游引物R:CTATAGAGGTAACATTTGCTCAGC。提取矮牵牛叶片RNA,经反转录获得cDNA模板,使用上述引物克隆获得PhTPS6序列,并使用高保真酶对全长序列进行校正。将胶回收产物直接送由上海生工生物工程公司进行测序。
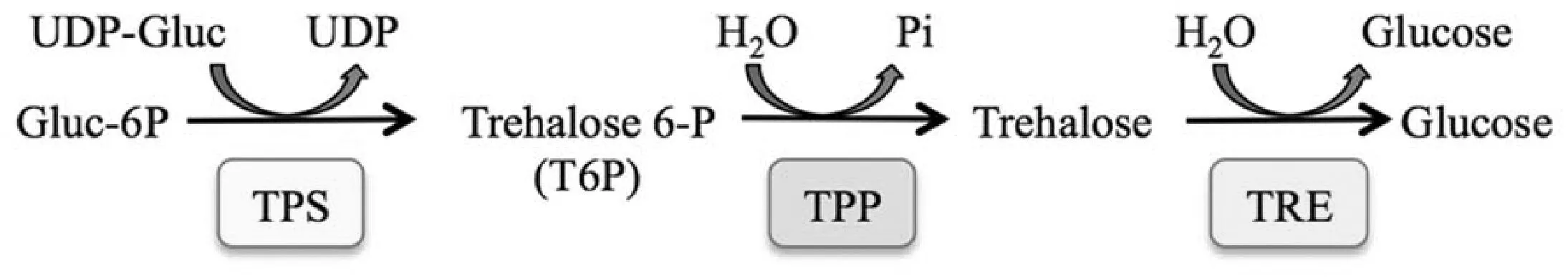
图1 海藻糖代谢[3]Fig.1 Trehalose metabolism[3]
1.3 PhTPS6的表达分析
分别取矮牵牛根、茎、叶、花、叶腋等部位,使用EZ-10总RNA小量提取试剂盒(上海生工生物工程有限公司)提取RNA,反转录后用于检测不同组织中基因的表达量;将矮牵牛去顶后分为2组:一组分别于6 h和24 h后取叶腋部位提取RNA,另一组去顶的同时施加10 μL 50 μmol/L 3-吲哚乙酸(IAA,indole-3-acetic acid),分别于6 h和24 h后取下方2~3个叶腋部位提取RNA,将提取的两组RNA反转录后用于检测去顶及IAA施加后基因的表达水平。该试验以未去顶的矮牵牛作为对照;对矮牵牛顶端向下的第4个叶腋部位施加10 μL 50 μmol/L 6-苄氨基嘌呤(6-BA),分别于6 h和24 h后取叶腋提取RNA,反转录后用于检测6-BA处理后基因的表达水平。该试验以未施加6-BA的矮牵牛作为对照;使用200 mmol/L的NaCl溶液浇灌矮牵牛,分别于12 h和24 h后取叶片提取RNA,反转录后用于检测盐胁迫下基因的表达水平。该试验中以正常浇水的矮牵牛作为对照;将矮牵牛置于8 ℃的光照培养箱中,分别于12 h和24 h后取叶片提取RNA,反转录后用于检测低温胁迫下基因的表达水平。以上每个处理12棵苗,共进行3次生物学重复。反转录及荧光定量PCR参照董丽丽等[16]的方法;荧光定量PCR引物为:PhTPS6-RT-F:GATGGCAGTAAAGGGTGGTT,PhTPS6-RT-R:GTCTTGCTCATTCGGGTGAA。使用Actin作为内参基因。
1.4 生物信息分析
利用DNAMAN 6.0软件,对不同物种的序列相似性进行比对。利用软件Protparam tool(http://web.Expasy.org/protparam/)对蛋白质的分子式、氨基酸组成等进行分析。
2 结果与分析
2.1 PhTPS6的克隆
根据已经公布的腋花矮牵牛(P.axillaris)基因组序列,设计引物扩增获得PhTPS6cDNA序列。该序列全长2 571 bp,编码856个氨基酸。利用Expasy对PhTPS6蛋白序列进行分析,推测PhTPS6蛋白的分子式C4342H6838N1154O1276S48,该蛋白中相对含量较多的氨基酸是10.4% Leu、7.9% Ser、7.6% Val、7.2% Glu、6.2% Asp;总的带负电荷的残基(Asp+Glu)为115,总的带正电荷的残基(Arg+Lys)为98。将PhTPS6与苜蓿、马铃薯、胡杨的蛋白序列进行比对,序列相似性分别为83.68%、95.92%和87.03%(图2)。
2.2PhTPS6的组织特异性表达分析
使用qRT-PCR对PhTPS6在茎、叶腋、叶片、根和花中的相对表达水平进行检测。结果表明PhTPS6在被检测的各个组织中均有表达。叶腋、茎和花中的表达量较高,而叶片中的表达水平最低,约为茎中的1/14(图 3)。
2.3 生长素及细胞分裂素调控PhTPS6的表达
为研究生长素对PhTPS6基因的调控作用,分别对矮牵牛进行去顶以及去顶后施加IAA。结果显示:相对于未去顶时,去顶6 hPhTPS6的表达水平上调约14倍。去顶24 h时,PhTPS6的表达水平显著下降,约为未去顶植株的5倍(图4-A)。而去顶后施加IAA 6 h后,PhTPS6表达水平约为完整植株中的2.7倍,显著低于去顶6 h未施加IAA时的表达水平。在24 h时,PhTPS6表达水平下降至完整植株中的1.67倍,显著低于去顶24 h未施加IAA时的水平(图4-B)。为研究细胞分裂素对PhTPS6的调控,对矮牵牛叶腋部位施加6-BA,分别于6 h和24 h后对PhTPS6的表达水平进行检测。结果表明:施加6-BA 6 h后,PhTPS6的表达水平上调约16倍,而24 h 时PhTPS6的表达水平下降为对照的水平(图4-C)。

图2 PhTPS6与其他物种的TPS6比对Fig.2 Alignment of PhTPS6 with other TPS6s
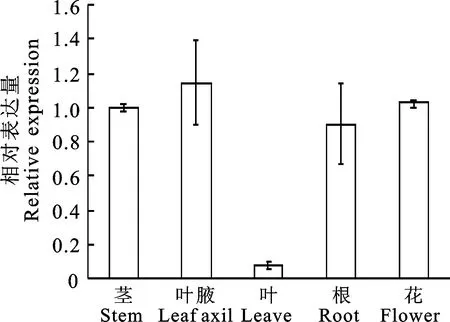
图3 矮牵牛不同组织中PhTPS6的表达水平Fig.3 The expression level of PhTPS6 in different tissues of P.hybrida
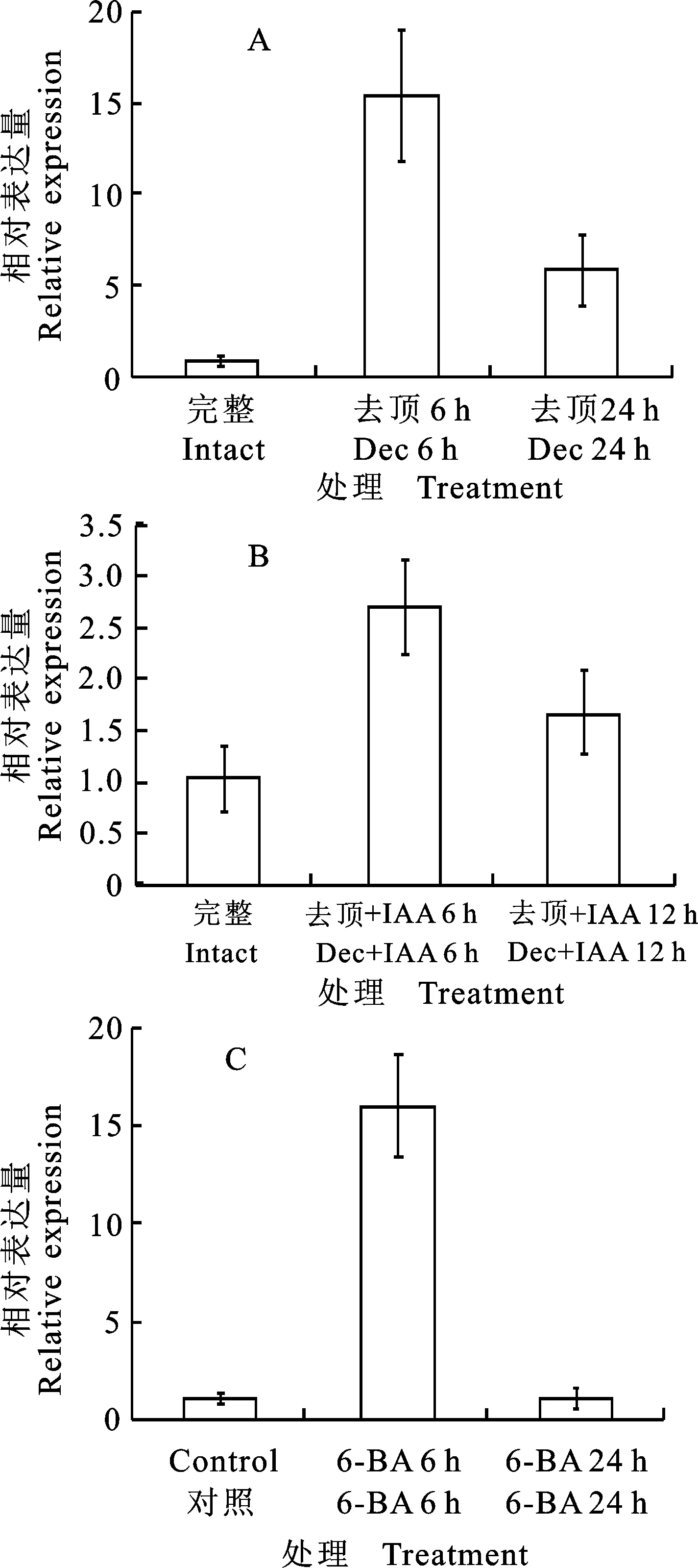
A.去顶促进PhTPS6的表达 Decapitation up-regulated the expression ofPhTPS6;B.IAA抑制PhTPS6的表达 IAA repressed the expression ofPhTPS6;C. 6-BA促进PhTPS6的表达 6-BA up-regulated the expression ofPhTPS6;Dec.去顶 Decapitatation
图4去顶、生长素及细胞分裂素对PhTPS6表达的调控
Fig.4TheexpressionofPhTPS6regulatedbydecapitatation,auxinandcytokinin
2.4 低温及盐胁迫诱导PhTPS6的表达
为研究低温及盐胁迫对PhTPS6的诱导,分别对矮牵牛进行低温及NaCl胁迫处理。结果表明:低温处理12 h后PhTPS6表达水平显著上调,为对照的18.9倍,处理24 h时PhTPS6表达水平升高为对照的28.7倍。NaCl处理12 h后PhTPS6表达水平升高为对照的21.4倍,处理24 hPhTPS6表达水平升高为对照的30倍(图5)。
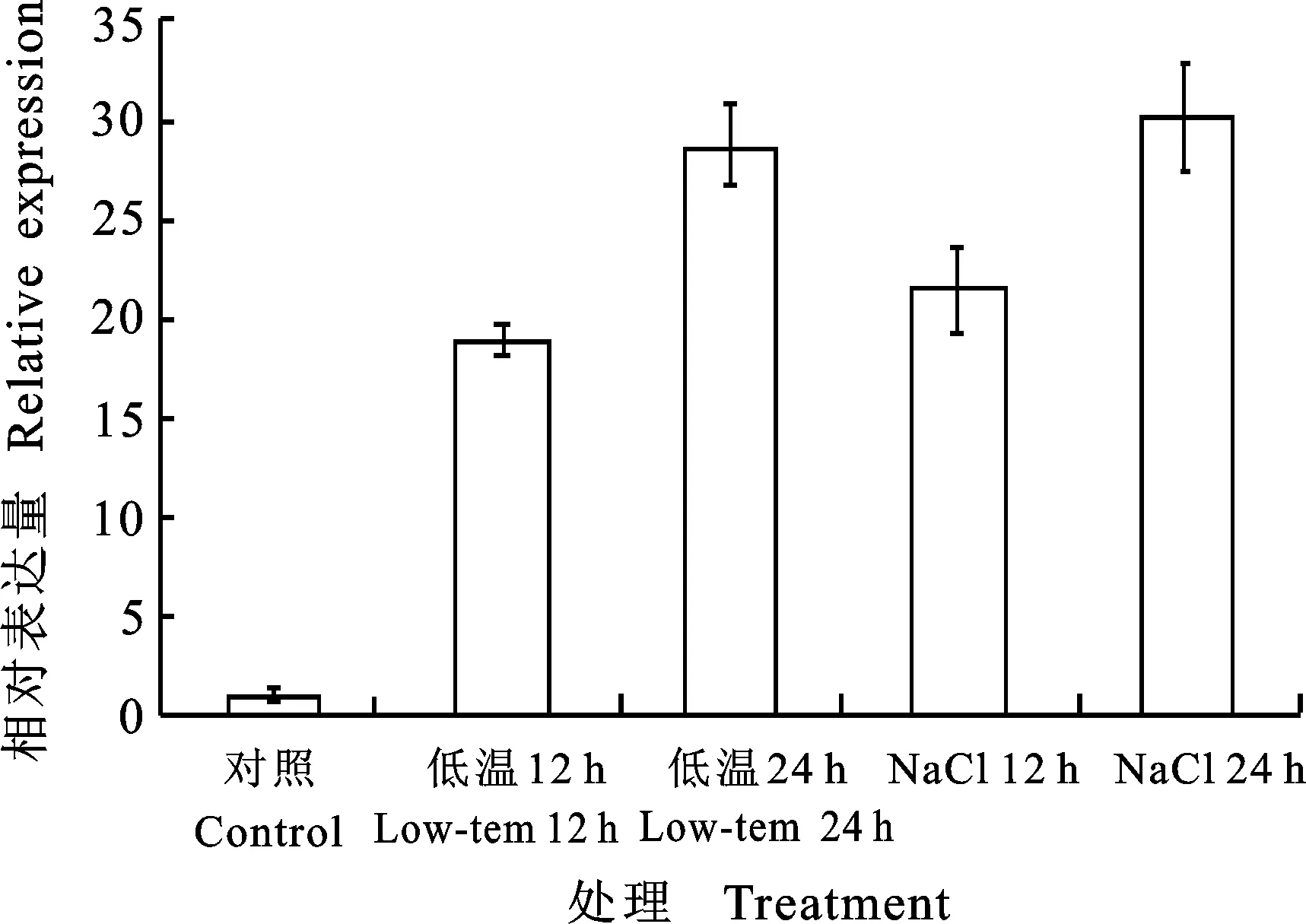
图5 低温及盐胁迫促进PhTPS6的表达Fig.5 The expression of PhTPS6 under low temperature and NaCl stress
3 讨 论
本研究克隆获得矮牵牛PhTPS6的全长序列。推测PhTPS6的氨基酸序列与苜蓿、马铃薯、胡杨等物种的序列相似性均在80%以上,说明PhTPS6是TPS6的同源基因。组织特异性表达分析显示PhTPS6在茎、叶腋、叶片、根和花等多个组织中均有表达,这与拟南芥AtTPS6在多个组织中表达的结论相类似[14],表明该基因可能在多个生长发育过程中起作用。PhTPS6在叶腋中的表达水平较高,预示PhTPS6可能在调控矮牵牛的分枝发育中具有重要作用。
去顶能够移除生长素源,导致激素平衡被打破[17]。因此,去顶引起PhTPS6的表达水平的快速上调,一方面可能是生长素能够抑制PhTPS6的表达。另一方面可能是PhTPS6蛋白能够作为信号分子起作用,而去顶直接调控了PhTPS6基因的表达。随着去顶时间的延长,PhTPS6的表达水平逐渐下降,说明PhTPS6可能在腋芽从休眠走向萌发的早期阶段中起作用。去顶后施加IAA,则有效抑制了去顶所引起的PhTPS6表达水平的上升。进一步验证了生长素能够抑制PhTPS6的表达。
细胞分裂素在促进腋芽的萌发中具有直接作用[18],施加6-BA 6 h后,PhTPS6的表达水平迅速上调,表明细胞分裂素能够促进PhTPS6的表达。随着处理时间的增加,PhTPS6的表达水平逐渐降低,并恢复为对照的表达水平。该研究进一步说明PhTPS6可能在促进腋芽萌发的早期阶段具有重要作用。而生长素及细胞分裂素直接还是间接调控PhTPS6的表达有待于进一步研究。
植物在遭受逆境胁迫时,体内海藻糖能够迅速合成,以保护植物机体[19]。低温处理12 h引起了PhTPS6表达水平的显著上调,随着处理的增加,PhTPS6表达水平呈上升趋势。这与小麦中低温能够诱导TPS6的表达的结论相一致[20], NaCl处理后PhTPS6表达水平具有同样趋势。说明PhTPS6在矮牵牛对低温及盐胁迫的响应中具有重要作用。
该研究为全面了解海藻糖合成基因PhTPS6在矮牵牛生长发育中的功能奠定了基础,同时为后续获得抗逆性强多分枝的矮牵牛新品种储备了基因资源。
——矮牵牛

