人源酸敏感离子通道1a介导酸引起细胞凋亡的研究
徐媛媛,李文娜,翟玉荣,莫镇涛,李意奇,李俊明,肖 璐,李彩兰
(遵义医科大学 珠海校区,广东 珠海 519041)
酸敏感离子通道(Acid-sensing ion channels,ASICs)是一类配体门控Na+通道,广泛分布于中枢和外周神经系统。能被酸激活产生内向电流,对阳离子透过能力Na+>Ca2+>K+>H+[1-2]。目前发现,ASICs有6个亚型(ASIC1a、ASIC1b、ASIC2a、ASIC2b、ASIC3以及ASIC4),其中,ASIC1a、ASIC2a、ASIC2b在中枢神经元表达较多[3-4]。前期研究发现,在大脑缺血过程中,ASIC1a被酸激活,引起细胞内钙超载,进一步引起神经元损伤,在大脑中动脉闭塞(MCAO)引起的脑缺血模型中,通过注射ASIC1a特异性阻断剂可以减少梗死面积,因此,ASIC1a是介导酸引起神经元损伤的关键亚型,ASIC1a有望作为减轻酸引起神经元损伤的新型分子靶点[5-7]。
研究发现,人源与小鼠源ASIC1a有98%氨基酸序列相同,另2%氨基酸决定人源与小鼠源ASIC1a在功能的差异:对CHO细胞转染人源或小鼠源ASIC1a基因,结果显示,与小鼠源ASIC1a相比,人源ASIC1a介导酸引起的膜电流增加,细胞内钙离子浓度升高,继而引起细胞损伤加重,导致这些功能存在差异的机制是由于人源ASIC1a的细胞膜转运效率更高,进一步发现第285位氨基酸是决定人源与小鼠源ASIC1a膜转运差异的关键氨基酸位点[8-9]。虽然人源ASIC1a比小鼠来源ASIC1a介导由酸引起的细胞损伤更大,但并没有进一步证明是何种损伤,细胞凋亡或细胞坏死?因此本课题旨在比较:在不同种类细胞中,人源与小鼠源酸敏感离子通道1a(ASIC1a)介导酸引起的细胞凋亡,为开发ASIC1a特异性阻断剂提供重要的理论依据。
1 材料与方法
1.1 材料 实验细胞及质粒:CHO细胞、COS7细胞(购于ATCC),新生小鼠品系为野生型C57BL/6(购于广东省医学实验动物中心),人源ASIC1a(hASIC1a)、小鼠源ASIC1a(mASIC1a)、GFP质粒(GFP)(美国南阿拉巴马大学查向明教授惠赠)。主要试剂:F12、DMEM培养基(Hyclone),碘化丙啶、磷酸钙转染试剂盒、Lipofectamine 2000(Thermo Fisher Scientific),Neurobasal、B27、Opti-MEM和胎牛血清(Gibco),Sulfo-NHS-Biotin和NeutrAvidin Beads(Pierce),MTT试剂盒(Sigma),山羊来源ASIC1和小鼠来源Tubulin一抗(Santa Cruz),二抗(Thermo Fisher Scientific)。主要仪器:荧光显微镜(Olympus),酶标仪(Molecular Device),免疫印迹实验仪(Bio-Rad)等。
1.2 细胞培养与转染 CHO细胞培养基为F12加10%的胎牛血清,COS7细胞培养基为DMEM加10%胎牛血清,置于37℃,5% CO2培养箱中培养。转染前1 d,对细胞进行传代,将细胞种植在96孔板或60 mm培养皿中,次日,用Lipofectamine2000混合目标质粒,按比例(2∶1)对CHO细胞或COS7细胞进行转染,ASIC1a与GFP 质粒DNA比例为(3∶1),总量为0.125~0.25μg /孔或2~5μg /60 mm培养皿。4~6 h之后,加入正常培养基,放回培养箱培养24 h,转染效率达到80%以上可用于后续实验。
1.3 原代皮层锥体神经元培养与转染 取新生鼠,分离皮层组织,加入0.075%胰酶,37℃,消化2 min。加入10%马血清终止消化,低速离心,弃上清。吹散种植液悬浮的组织团,收集上层细胞,低速离心,种植液重悬细胞沉淀,活细胞计数,种植神经元,3~4 h后,换培养液。后续每3天半量换液,7 d可进行转染。用CaCl2对神经元进行转染,按照转染试剂盒的实验方法,在EP管中加入15 μg 目标质粒,40 μL H2O,85 μL 50 M CaCl2,混合均匀后加到含125 μL HBS的EP管中,室温孵育30 min。将混合好的DNA、CaCl2混合物感染神经元,每孔25 μL,DNA量为1.5 μg/孔。转染时间为1 h,换为正常培养基,继续培养72 h,被转染过的神经元用于后续实验。
1.4 细胞酸处理与PI染色 对细胞或神经元进行酸处理,用pH7.4或pH6.0 ECF缓冲溶液处理COS7细胞和神经元,分别用pH7.4或pH6.0或pH6.0+PcTx-1 ECF缓冲液处理CHO细胞,酸细胞处理2 h、神经元1 h,酸处理之后换回正常培养基,次日PI染色、拍照。经酸处理的COS7细胞和神经元,加入PI溶液,孵箱孵育10 min,转染ASIC1a和GFP的细胞呈绿色荧光,凋亡细胞被PI标记呈红色荧光,统计PI阳性细胞比率=黄色细胞数量/绿色细胞数量。
1.5 荧光显微镜拍照 经过酸处理的CHO细胞,24 h之后绿色荧光细胞丢失,通过荧光显微镜拍照,计算细胞死亡率,实验方法见文献[8,10],计算公式为:细胞死亡率%=(pH7.4细胞数量-pH6.0细胞数量)/pH7.4细胞数量×100%,或(pH7.4细胞数量-pH6.0+PcTx-1细胞数量)/pH7.4细胞数量×100%。
1.6 MTT实验 在细胞培养液中加入500 μg/mL MTT溶液,3~4 h后,加入150 μL DMSO室温震荡15 min,测定在570 nm波长的吸光度。以正常对照组培养物吸光值作为100%,处理组培养物吸光度占对照组吸光度的比值反映细胞存活情况。
1.7 细胞膜蛋白表面生物素标记以及亲和素沉淀分离 经转染的CHO细胞,加入1.5 mL,0.5 mg/mL Suflo-NHS-LC-生物素溶液,4℃旋转孵育30 min,加入甘氨酸终止反应,加入300 μL NeutrAvidin缓冲液,4℃旋转孵育过夜。次日,其中200 μL混合蛋白的NeutrAvidin缓冲液再混合40 μL链亲和素琼脂糖珠,用于膜蛋白分离,另外100 μL为总蛋白,进行Western blot实验。经蛋白定量,加入上样缓冲液,制胶,电泳,电转,封闭,孵育一抗,抗体稀释比例:ASIC1(1∶1 000)、tubulin(1∶30 000),润洗,孵育二抗(anti-goat 1∶12 000,anti-mouse 1∶12 000),润洗,显影,进行蛋白定量分析。
1.8 统计学分析 实验分为采用成对T检验来检查两组数据的差异,数据的表示方式采用均值±标准误(MEAN±S.E.M)表示,P<0.05为差异有统计学意义。
2 结果
2.1 人ASIC1a与鼠ASIC1a介导酸引起的COS7细胞凋亡比较 结果显示(见图1),转染鼠ASIC1a的细胞经pH6.0处理之后,PI阳性细胞比率为(24.7±2.1)%,转染人ASIC1a的细胞经pH6.0处理之后,PI阳性细胞比率为(37.3±4.3)%,与鼠ASIC1a相比,PI阳性细胞比率显著性增加(P<0.05)。
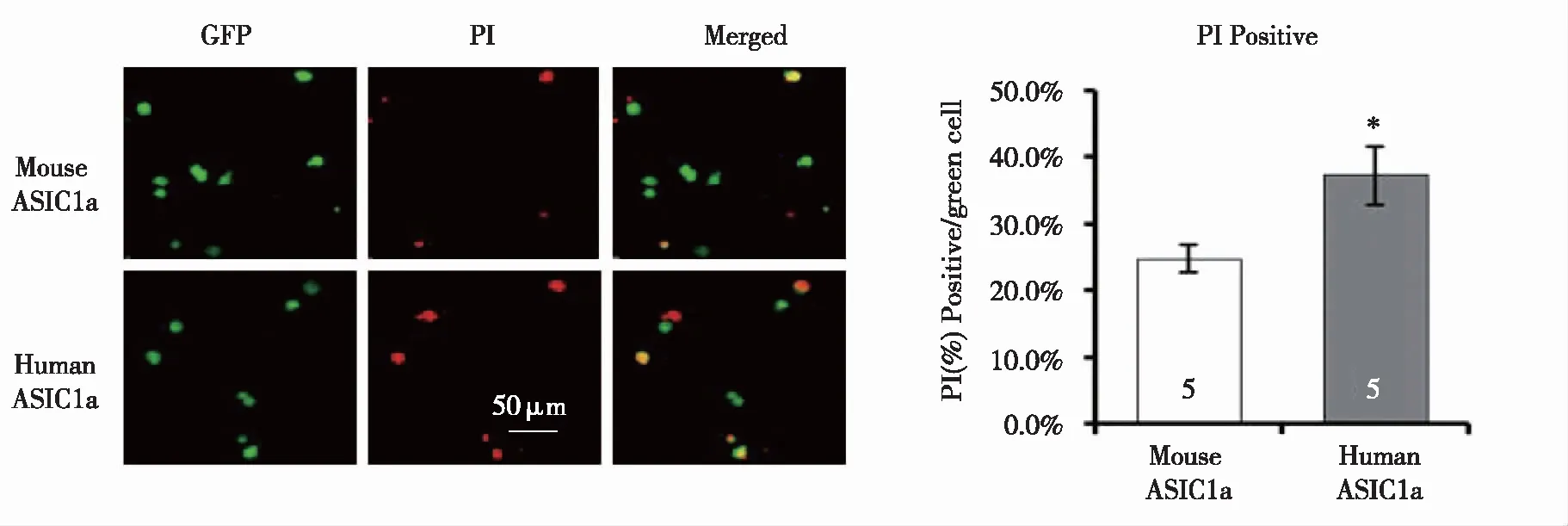
转染ASIC1a呈绿色,PI标记凋亡细胞为红色,颜色合并,与鼠ASIC1a相比,*:P<0.05;n= 5。图1 人ASIC1a与鼠ASIC1a介导酸引起的COS7细胞凋亡比较
2.2 人ASIC1a与鼠ASIC1a介导酸引起的神经元凋亡比较 结果显示(见图2),转染鼠ASIC1a的神经元经pH6.0处理之后,PI阳性细胞比率为(18.7±3.3)%,转染人ASIC1a的神经元经pH6.0处理之后,PI阳性细胞比率为(38.8±6.1)%,与鼠ASIC1a相比,PI阳性细胞比率显著性增加(P<0.05)。

转染ASIC1a呈绿色,PI标记凋亡细胞为红色,颜色合并,与鼠ASIC1a相比,*:P<0.05;n= 5。 图2 人ASIC1a与鼠ASIC1a介导酸引起的神经元凋亡情况比较
2.3 人ASIC1a与鼠ASIC1a介导酸引起的CHO细胞损伤比较 结果显示(见图3),转染鼠ASIC1a的细胞死亡率为(20.7±2.0)%,转染人ASIC1a细胞死亡率为(42.1±3.0)%,与鼠ASIC1a相比,细胞死亡率增加,且具有显著性差异(P<0.001);运用ASIC1a特异性阻断剂PcTx-1,可显著性减少人源与鼠源ASIC1a由pH6.0引起的细胞损伤(P<0.05,P<0.001)。

与鼠ASIC1a相比,###:P<0.001,n=10,19;鼠ASIC1a,与pH6.0相比,*:P<0.05,n=23;人ASIC1a,与pH6.0相比,***:P<0.001,n=14。图3 人ASIC1a与鼠ASIC1a介导酸引起的CHO细胞损伤情况比较
2.4 转染人源ASIC1a 的CHO细胞活力降低 结果显示(见图4),转染鼠源ASIC1a的细胞,细胞活力百分比为(78.9±2.1)%,转染人源ASIC1a的细胞活力百分比为(55.3±2.7)%,二者差异具有统计学意义(P<0.001);运用ASIC1a特异性阻断剂PcTx-1,可显著性增加细胞活力百分比(P<0.05)。
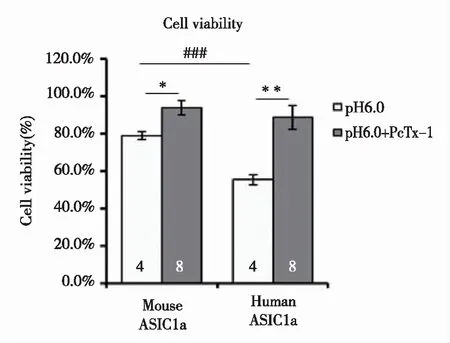
与鼠ASIC1a相比,###:P<0.001,n=4;鼠ASIC1a,与pH6.0相比,*:P<0.05,n=8;人ASIC1a,与pH6.0相比,**:P<0.01,n=8。图4 转染人源ASIC1a 的CHO细胞活力
2.5 人源ASIC1a在CHO细胞膜表达 结果显示(见图5),人ASIC1a膜蛋白表达量是鼠ASIC1a的3.5倍(P<0.05),说明人源ASIC1a细胞膜表达更多。

Surface ASIC1a表示细胞膜上的ASIC1a的量,Total ASIC1a表示总ASIC1a的量,surface除以 Total代表ASIC1a往细胞膜上转运率,与鼠ASIC1a相比,*:P<0.05,n=4。图5 人源ASIC1a比鼠ASIC1a在细胞膜表达
3 讨论
前期对ASIC1a的研究,主要集中在啮齿类动物,对人源ASIC1a的研究较少,动物实验研究中,ASIC1a阻断剂显著改善缺血性坏死,但却没有基于该药理作用的药物投入临床,原因是由于ASIC1a特异性阻断剂PcTx-1是南美一种蜘蛛提取的毒素,不宜大量运用于人体,并且 PcTx-1大量的合成、稳定性以及能否透过血脑屏障这些问题都给其临床应用带来困难[11]。此外,人源与小鼠源ASIC1a存在2%氨基酸序列的差异,ASIC1a在不同物种间的表达、分布、亚单位结合、生理性质以及药理学性质都存在差异[12]。
本文通过对COS7细胞/CHO细胞/原代皮层锥体神经元转染人或小鼠ASIC1a质粒,经酸pH6.0处理之后,对比细胞凋亡情况。发现与转染小鼠源ASIC1a的COS7细胞和神经元相比,转染人源ASIC1a的COS7细胞和神经元,由酸引起的细胞PI阳性细胞比率更大,细胞死亡率更高,细胞活力更低,且ASIC1a特异性阻断剂PcTx-1能显著逆转由酸引起的细胞凋亡。因此得出结论,人源ASIC1a比小鼠源ASIC1a介导由酸引起的细胞凋亡越大。
本文通过PI染色、MTT实验研究酸引起的细胞凋亡,最好再通过细胞流式或者检测细胞因子的水平,比如,IL-1β、TNF-α、Caspase3等[13],这都是未来我们需要完成的实验。此外,在脑缺血病理状态下,ASIC1a介导细胞内钙超载,可以通过钙成像实验比较人源与鼠源ASIC1a引起细胞内钙离子浓度变化情况。本文的图5结果说明人源ASIC1a比鼠ASIC1a在细胞膜表达更多,那么我们可以假设人源ASIC1a比鼠源ASIC1a介导的膜电流更大,介导细胞内钙离子浓度更高,这些假设都将在我们接下来的实验中进行验证。
通过这一系列的基础研究,我们明确ASIC1a介导酸引起的细胞凋亡,进一步通过研究ASIC1a介导细胞凋亡的分子机制,对药物的理性筛选更有指导意义,为防治缺血性脑卒中提供重要的理论依据。

