基于“脑-肠互动”理论探究脑肠肽在运动抗抑郁中的作用机制
薛香莉,刘微娜,漆正堂,娄淑杰*
(1. 上海体育学院“运动健身科技”省部共建教育部重点实验室 上海200438;2. 上海体育学院 运动科学学院,上海200438;3. 华东师范大学青少年健康评价与运动干预教育部重点实验室,上海200241)
应激引发一系列神经、内分泌和行为反应以促进机体对环境变化或威胁的稳态适应。一定强度的慢性心理生理应激被证实是抑郁的直接诱发因素。流行病学研究显示,一方面,应激或抑郁会影响胃排空、胃动力、食欲和摄食平衡,诱发肠易激综合征等胃肠道疾病或肥胖等代谢性疾病;另一方面,功能性胃肠病患者或代谢疾病人群伴有抑郁、焦虑等精神疾病。这提示,抑郁症等精神疾病与胃肠道疾病、代谢性疾病在发病机制上可能有同源性。同时,Pearse 等(1979)指出,胃肠道的肽类分泌细胞和脑内的肽类神经元在胚胎发生上共同起源于神经外胚层,这使“脑-肠互动”理论进一步成为可能。
“脑-肠互动”是脑肠轴最主要的调控方式,是在脑肠轴结构基础上发生的脑肠间的交互作用。脑肠轴是大脑与胃肠道之间由神经-内分泌介导的双向应答系统,连接着大脑情感认知与外周胃肠道的功能(游懿君等,2017)。例如,胃肠道内分泌细胞可产生神经递质,通过迷走神经影响中枢神经系统(CNS);肠道微生物通过调节肠道内激素的分泌,如脑肠肽、瘦素等物质可直接作用于脑。脑-肠互动主要通过4 个主要途径:迷走神经和脊髓传入神经元,循环细胞因子,循环肠道激素和微生物菌群(Holzer,2016)。其中,微生物菌群也可通过血液循环到达大脑,还可直接与其他3 种途径相互作用。值得注意的是,胃肠道与CNS 之间的每一个互动途径均涉及脑肠肽及相关生物活性物质。脑肠肽(Brain-gut peptides,BGP)是脑肠轴发挥作用的重要物质基础,其具体是指在大脑和胃肠道中双重分布,具有神经递质和激素双重功能的小分子多肽。脑肠肽在外周和中枢的异常表达,介导了应激反应、胃肠动力亢进/不足、食欲和摄食异常、肠道微生态失衡等,导致抑郁、焦虑、胃肠道疾病和代谢性疾病等。
规律运动作为一种非药物治疗手段,其改善抑郁的有效性得到了广泛证实,但潜在机制尚不完全清楚。运动能够调节中枢/外周胃饥饿素(ghrelin)、神经肽Y(NPY)、胆囊收缩素(CCK)等脑肠肽的表达,因此,脑肠肽很可能介导运动的抗抑郁作用。本文基于“脑-肠互动”理论,重点阐释脑肠肽在运动抗抑郁中的神经生物学机制,以新视角探索大脑和胃肠道之间的双向信息交流、功能整合。
1 胃饥饿素(ghrelin)
ghrelin 由Kojima 等在大鼠的胃中首次发现,是一种28 个氨基酸的肽,主要通过激活促生长激素释放受体(GHS-R1a)在体内发挥作用,能够影响食欲和机体能量平衡,是首个被确定的饥饿激素或食欲增强激素,因此又称作胃饥饿素。其受体GHS-R1a 属于G 蛋白偶联受体,在脑内的多个区域都有表达,主要分布在下丘脑、海马、杏仁核和中脑腹侧被盖区等调节情绪和奖赏的关键脑区,提示ghrelin 及其受体可能参与抑郁的发病过程。值得注意的是,外周ghrelin 可以经血液循环透过血脑屏障以及迷走神经传入孤束核在中枢发挥作用,也就是说循环ghrelin 可成为中枢GHS-R1a 的另一种天然配体。
人体和动物研究表明,ghrelin 参与抑郁的病理生理机制。Nakashima 等(2008)发现,Ghrl/GHRL 基因外显子区Leu72Met 多态性与抑郁症密切关联。重度抑郁患者血浆ghrelin 水平更低,注射ghrelin 后产生抗抑郁效应(Monteleone et al.,2003)。暴露于慢性不可预见性温和应激(CUM-S)的小鼠腹腔或侧脑室注射ghrelin 或GHRP-6(GHS-R 激动剂)持续2 周,均可缓解CUMS 引起的焦虑和抑郁行为;且CUMS 小鼠胃、海马ghrelin mRNA 水平显著上调,海马ghrelin 受体蛋白水平增加。这些结果提示,CUMS 激活的内源性ghrelin/GHS-R1a 通路在应激的稳态控制中发挥作用。此外,ghrelin 受体敲除小鼠在经历慢性社会失败应激(CSDS)后表现出食欲降低以及更严重的社交障碍(Lutter et al.,2008),热量限制的抗焦虑和抗抑郁作用被阻断。一次性侧脑室注射ghrelin 即可逆转小鼠双侧嗅球切除(OB)诱发的抑郁行为(Carlini et al.,2012)。综上,人体和啮齿类动物研究都表明当ghrelin 水平上调,抑郁症状缓解。由于ghrelin 水平可以通过内源性和注射增加,因此,将ghrelin 作为抑郁治疗的一个候选靶点显得更有意义。
以上研究表明,ghrelin 与GHS-R 结合产生抗抑郁效应,注射适宜剂量ghrelin 可产生抗抑郁/抗焦虑行为。另一些研究结果与此形成对比:大鼠注射反义DNA 抑制ghrelin 表达,可产生抗抑郁和抗焦虑效应(Kanehisa et al.,2006),连续4 周侧脑室注射ghrelin 产生致焦虑作用(Hansson et al.,2011)。其他研究报道了伏隔核微量注射ghrelin 增强自发活动度(Jang et al.,2013);而下丘脑注射诱发焦虑行为(Currie et al.,2012)。值得注意的是,这些是在无应激的正常动物进行的研究。尽管在未应激的生理条件下,ghrelin-/-小鼠有着更低焦虑行为,但其对急性束缚应激的反应更为焦虑(Spencer et al.,2012)。综上,ghrelin 可能在不同的生理或病理条件下对抑郁发挥不同的调节作用,并且注射剂量、部位、时间及注射后行为测试的时间、检测的脑区、老鼠应激类型、种属等也是造成差异的原因。临床研究发现,抑郁患者血浆ghrelin 水平存在升高、降低以及无改变的结果。导致这种不一致的原因可能是,无法检测未经药物治疗抑郁患者的基线ghrelin水平。此外,在抑郁厌食症患者ghrelin 分泌增加,但在抑郁肥胖个体降低,并随恢复到理想体重ghrelin 的分泌正常。长期能量不足和食物摄入较低个体,如神经性厌食症患者,其血浆基础ghrelin 浓度增加,提示可能存在ghrelin 抵抗,这与ghrelin 促进能量平衡作用减弱相关。关于ghrelin抵抗在抑郁中的研究有待开展。总之,ghrelin信号通路在对慢性应激的应答时被激活,这成为机体应对应激的一种稳态适应,但似乎以刺激食欲、增加能量摄入为代价。
作为一种新型内源性抗抑郁剂,ghrelin 抗抑郁的具体机制备受关注,主要如下:1)ghrelin 与抑郁的单胺类神经递质假说密切相关。中枢5-羟色胺能系统功能异常是抑郁症发病的重要机制之一。中缝背核(DRN)的神经元,尤其是5-HT 神经元,可能参与ghrelin 介导的抑郁发病机制。急性中枢注射ghrelin,增加小鼠DRN 5-HT 及其受体表达(Alvarez-Crespo et al.,2012)。GHS-R1a 基因敲除小鼠DRN 5-HT 受体表达下降(Hansson et al.,2014),提示ghrelin 在中枢发挥作用的一个靶点是5-羟色胺能系统。ghrelin 受体不仅与5-HT 受体互相作用,也与多巴胺受体相关(Ogaya et al.,2011)。ghrelin 在与奖赏和情感情绪行为密切相关的中脑腹侧被盖区参与多巴胺能神经元放电和多巴胺代谢,这一过程依赖于GHS-R1a 通过谷氨酸能神经元投射(Jiang et al.,2006)。ghrelin 通过影响谷氨酸的释放或N-甲基-D-天冬氨酸受体(NMDAR)受体的表达,进而间接影响突触可塑性。据报道,谷氨酸和多巴胺能末端共同定位于同一树突棘。因此,GHS-R1a 信号调节海马功能可能依赖于多巴胺受体的协同作用。基于单胺类神经递质假说,ghrelin 与其他神经递质受体之间的关联将在未来得到关注,可能是抑郁症一个潜在的研究领域;2)脑源性神经营养因子BDNF 及其相关信号转导通路在ghrelin 抗抑郁中扮演重要角色。研究发现,ghrelin 上调脑内BDNF 及其下游环磷腺苷效应元件结合蛋白(CREB)和p-CREB 的表达(Cuellar et al.,2011),而后三者均参与调节抑郁相关的神经可塑性。BDNF 敲除小鼠进食行为异常,抗抑郁药物治疗后缓解了异常的摄食行为并伴随BDNF 水平的增高,推测ghrelin 在这一过程中对BDNF 水平产生影响。然而,BDNF 的受体TrkB 是否受ghrelin 影响目前仍不清楚,对其他神经营养因子(如成纤维细胞生长因子FGF、血管内皮生长因子VEGF 等)的研究也有待于深入;3)ghrelin 治疗增强海马神经发生。应激引起的海马神经发生减少是诱发抑郁的一个重要机制,传统抗抑郁治疗后成年海马神经发生增强。已经发现ghrelin 增强胚胎大鼠脊髓和成年大鼠孤束核、迷走神经背侧运动核的神经发生;ghrelin 治疗可以逆转应激引起的海马在内的许多脑区BrdU 标记增殖细胞数目的减少(Chung et al.,2013)。另有研究发现,ghrelin 可诱导神经元活动标志物c-Fos 和Egr-1 的 表 达(Hewson et al.,2010;Kobelt et al.,2008);4)ghrelin 调节下丘脑-垂体-肾上腺轴(HPA 轴)对应激的反应。促肾上腺皮质激素(ACTH)、促肾上腺皮质激素释放激素(CRH)是HPA 轴应激反应的主要参与者,暴露于慢性应激表现出HPA 轴的过度激活。在内源性ghrelin 缺乏小鼠,急性应激后,下丘脑室旁核(PVN)不能正常分泌CRH 以刺激垂体释放ACTH。因此,ghrelin 调节应激反应通过间接作用于PVN 的CRH 神经元,直接促进垂体释放ACTH(Kadar et al.,2010)。OB 抑郁模型小鼠血浆ACTH 浓度升高,一次性侧脑室注射ghrelin 后,ACTH水平下降;而在非OB 小鼠,侧脑室注射更高剂量的ghrelin,ACTH 浓度升高,产生焦虑行为(Poretti et al.,2015),再次提示ghrelin 发挥抗抑郁或致抑郁作用基于动物基本状况。内源性和外源性皮质醇增多症患者血浆ghrelin 水平显著降低(Otto et al.,2004),表明ghrelin 分泌和HPA 轴活性之间可能存在反馈机制。最后,ghrelin 对抑郁的作用可能通过调节中枢炎症介导。GHS-R 可表达于免疫细胞,ghrelin 或ghrelin 类似物可通过抑制促炎性细胞因子如IL1-β、IL-6 和TNF-α,发挥免疫抑制作用,而IL-1β 和TNFα 被视作抗抑郁治疗效果的预测因子。综上,ghrelin 通过参与调节单胺类神经递质及其受体、海马神经发生、神经营养因子、HPA 轴活性以及中枢炎症反应等多个环节,在抑郁的发生发展中扮演重要角色。
研究证实,运动可通过调节ghrelin/GHS-R1a 通路调节抑郁行为。2 周自主运动即可显著上调海马和下丘脑GHS-R 蛋白表达(Gomez-Pinilla et al.,2010)。新近研究表明,GHS-R 敲除小鼠海马区细胞增殖和存活降低,齿状回细胞凋亡增加,且在CSDS 后诱发更严重的抑郁行为;P7C3,一种神经保护氨基咔唑,能够增强神经发生,并在GHS-R 敲除小鼠发挥抗抑郁作用(Walker et al.,2015)。有趣的是,据报道P7C3 可以模拟运动增强海马神经发生的效应。提示,运动预防抑郁行为至少部分通过刺激ghrelin/GHS-R 信号诱导海马神经发生。Liu 等(2015)研究发现,CUMS 模型抑郁大鼠前额皮层ghrelin 及其受体表达增加,伴随GSK-3β 的活性和NLRP3 表达增加;4 周中等强度游泳运动逆转上述过程,提示运动改善抑郁行为可能与ghrelin 及其受体、GSK-3β 活性以及NLRP3 有关。此外,大鼠海马内ghrelin 给药呈剂量依赖性地增加齿状回一氧化氮合酶(NOS)活性进而增加一氧化氮(NO)的合成,促进海马长时程增强(LTP)(Carlini et al.,2010);而在运动训练和未经训练的动物,NOS 活性显著不同;在皮质酮给药联合高脂膳食喂养的抑郁模型中,运动模拟药物AICAR 发挥抗抑郁作用需要增加内皮型NOS 活性并增加NO 产生(Liu et al.,2016)。因此,推测ghrelin 激活NOS 增加NO 合成进而增强突触可塑性是介导运动抗抑郁的重要途径。事实上,当前关于运动调控ghrelin 的表达集中于代谢疾病,检测样本多为血液,关于运动调节ghrelin 在不同脑区的变化这一方向仍有大量工作待完成。
2 神经肽Y(NPY)
NPY 由Tatemoto 于1982 年首先从猪脑中提取,是一种含有36 个氨基酸的多肽,源自NPY 前体。作为一种增食欲肽,NPY 参与调节机体心血管、呼吸道、免疫器官、胃肠道等功能,同时与应激导致的摄食异常、抑郁焦虑及学习记忆等多种生理过程有关。NPY 广泛分布于中枢及外周组织,中枢NPY 在前脑的边缘脑区表达丰富,如终纹床核、杏仁核、海马,在下丘脑表达最丰富。NPY 的生理作用至少由4 种G 蛋白偶联受体亚型介导,分别为Y1、Y2、Y4 和Y5。其中,Y1 和Y2 受体(即Y1R 和Y2R)在大脑中表达最丰富,而Y4 和Y5 受体(即Y4R 和Y5R)表达水平较低。因此,不同受体亚型对CNS NPY 活性的调节可能是治疗抑郁的潜在靶点。
基础医学和临床研究均已证实NPY 与应激、抑郁之间的相关性。preproNPY 基因遗传变异被证明与不同的应激反应、情绪有关。NPY 单倍型可预测尸检大脑组织中NPY mRNA和血浆NPY水平(Zhou et al.,2008)。NPY 基因启动子rs16147 单核苷酸多态性与伴焦虑抑郁患者抗抑郁治疗有效性下降密切相关(Domschke et al.,2010)。临床研究显示,与健康对照组相比,抑郁个体血浆和脑脊液NPY 浓度降低。有自杀企图史的抑郁患者血浆NPY 降低,且近期自杀未遂个体的血浆NPY 水平最低(Westrin et al.,1999)。抑郁患者经治疗后,脑脊液NPY 水平升高、CRH 降低,从而支持NPY 在临床治疗中发挥有效作用。在啮齿动物抑郁模型中,中枢注射NPY 呈剂量依赖性减少大鼠/小鼠强迫游泳实验中的不动时间并增加游泳时间,使用Y1R 激动剂与Y2R 拮抗剂均产生抗抑郁作用,而Y1R 拮抗剂阻断注射NPY 的抗抑郁作用(Stogner et al.,2000;Redrobe et al.,2002)。习得无助抑郁模型大鼠海马区注射NPY,可产生抗抑郁作用,这种作用被联合注射YIR 拮抗剂阻断,但NPY 与Y2R 拮抗剂的联合注射则无法阻断抗抑郁作用。海马区注射Y1R/Y5R 激动剂或Y2R拮抗剂,均对习得无助抑郁大鼠产生抗抑郁作用(Ishida et al.,2007)。提示NPY 可通过Y1R 产生抗抑郁作用,并通过Y2R 减弱这种作用。基因敲除鼠的相关研究进一步验证该结论:Y1R-/-小鼠出现抑郁表型(Karlsson et al.,2008);Y1R-/-和Y2R-/-小鼠则表现出抑郁行为减少,且与单一敲除任一受体相比,Y2R 和Y4R 双敲除可增强抗抑郁作用(Tasan et al.,2009;Painsipp et al.,2008)。有研究提出,Y2R 发挥致抑郁作用可能是因为其定位于突触前以及作为抑制性自身表达的受体,能够减少NPY 释放(Caberlotto et al.,2000)。另外,氟西汀与电休克抗抑郁治疗增加弗林德斯敏感系(FSL)抑郁大鼠海马和下丘脑NPY mRNA 水平,上调杏仁核Y1R 结合位点(Caberlotto et al.,1998,1999)。值得注意的是,Y5 受体在CNS 的表达远低于Y1、Y2 和Y4 受体,其在额叶皮质、外侧隔、终纹床核、PVN、杏仁核、海马等应激相关区域有弱表达。药理学研究发现,选择性Y5R 拮抗剂具有抗抑郁和抗焦虑作用(Walker et al.,2009),但Y5R 激动剂可降低焦虑行为(Sorensen et al.,2004)。矛盾的结果表明,NPY 通过Y5R 的信号转导似乎在应激反应中发挥较微弱的作用,需要Y5R基因敲除动物进一步明确。
NPY 及其受体在调节抑郁和应激行为中发挥重要作用,主要通过以下机制:1)NPY 可调节单胺类神经递质水平。抑郁患者的应激相关脑区单胺类神经递质绝对或相对不足。NPY 改善抑郁行为,同时增加杏仁核和下丘脑去甲肾上腺素和血清素(5-HT)水平,降低5-HT 的代谢(Song et al.,1996);2)NPY 可调节神经可塑性,并维持神经元的增殖存活。海马神经发生的主要区域齿状回亚颗粒细胞层富含NPY-Y1R,中间神经元释放NPY 激活其受体从而刺激神经发生。在NPY 敲除及NPY-Y1R 敲除小鼠均发现海马齿状回细胞增殖减少(Howell et al.,2007)。NPY 可逆转ACTH 引起的海马神经发生受损及可塑性下降(Antunes et al.,2015);3)NPY 通过调节HPA 轴活性改善抑郁行为,且这种调节可能具有性别依赖的方式(Forbes et al.,2012),因为不同性别NPY 敲除小鼠其HPA轴对应激的反应性不同。NPY 通过抑制CRH、ACTH 和皮质醇的释放降低HPA 轴活性(Antonijevic et al.,2000)。另外,免疫组化显示在PVN NPY/Y1 受体与CRH 神经元共定位,在基底外侧杏仁核(BLA)表达同时表达NPY 和CRH 的受体,推测NPY 与CRH 在调节情感障碍中发生重要的相互作用;4)海马NPY 可通过降低吲哚胺2,3-双加氧酶(IDO)活性,发挥神经保护作用,从而抵抗抑郁。这已在ACTH 腹腔注射模拟三环类抗抑郁药治疗抑郁模型小鼠中验证(Antunes et al.,2015)。IDO 活性增加,可催化色氨酸循犬尿氨酸途径分解,5-HT 代谢为5-HIAA,其结果为神经毒性产物喹啉酸累积,而5-HT 合成降低,说明NPY 抑制IDO 的过度激活可介入与抑郁相关的单胺能失调;5)表观遗传修饰代表了慢性应激介导抑郁的一种机制。CUMS 增加小鼠扣带回皮质组蛋白脱乙酰基酶类2型(HDAC2)的活性,降低与NPY 基因相关的组蛋白H3K9 乙酰化(H3K9ac)水平(Lomazzo et al.,2017),提示NPY 基因表观遗传改变是导致抑郁的潜在机制之一。
有研究证实NPY 介导运动的抗抑郁作用。自主跑轮运动或自主跑轮联合使用抗抑郁药物均能上调FSL 大鼠海马区NPY 及Y1R 表达,伴随海马新生细胞增殖增加以及抑郁行为改善,且海马NPY 水平与BrdU 免疫阳性细胞数量呈正相关(Bjornebekk et al.,2010),提示运动可能通过激活NPY/Y1R 促进海马细胞增殖和神经发生,从而发挥抗抑郁效应。游泳运动逆转CUMS 引起的海马区NPY、BDNF 及VGF mRNA 水平下降,并使抗凋亡蛋白Bcl-xl、凋亡前蛋白Bax 的表达接近于正常水平,可见运动发挥抗抑郁效应与NPY 调节神经营养因子及抗凋亡机制有关(Jiang et al.,2014)。此外,运动激活NPY 基因的表观遗传重编程发挥抗抑郁作用。具体来说,运动增加FSL大鼠海马NPY mRNA 水平,并下调Hdac5 mRNA 水平,导致H3K18 乙 酰化 水 平升高(Melas et al.,2013)。已知EP300 是维持体内H3K18ac 水平所需的主要组蛋白乙酰转移酶,EP300 可调节环氧合酶-2(COX-2),COX-2 功能异常可引发炎症反应并被认为是抑郁研究的靶点之一。基于NPY 受体在抑郁发病机制中的重要作用,未来研究需深入探讨急性或长期运动对抑郁相关脑区NPY 受体亚型的影响。
3 胆囊收缩素/缩胆囊素(CCK)
CCK 作为一种典型的脑肠肽,最初从十二指肠发现并提取,进食后由小肠I型细胞及神经元分泌。CCK 被认为具有广泛生物学活性,既是胃肠道主要调节激素之一,也作用于CNS,起着神经递质或调质的作用。CCK 可参与摄食、胃肠运动、镇痛、情绪、记忆和睡眠等活动的调节。大脑中具有生物活性CCK 的主要形式是硫酸化CCK-8。CCK 广泛分布在除小脑皮层外的中枢神经及外周神经,尤以大脑皮层、边缘系统的杏仁核、海马、垂体和延髓的孤束核等部位含量较高。在中枢内,CCK 与多巴胺、催产素、内啡肽、ACTH、神经降压素等神经递质或激素共存于神经细胞中。在大脑边缘区域,CCK 通常与参与情绪调节的5-HT3 和CB1 受体共同定位。CCK 受体有两种,分别为外周型CCK-A 受体(又称CCK1)和中枢型CCK-B(又称CCK2)受体。
研究发现,应激或抑郁与CCK 水平密切相关。一方面,临床研究发现,抑郁患者脑脊液中CCK 与抑郁严重程度和自杀行为呈正相关(Löfberg et al.,1998)。CCK 基因的多态性与自杀行为的易感性相关(Shindo et al.,2005)。首次自杀未遂者血液CCK 水平高于健康对照者,但与较高的抑郁评分无关,这项研究没有评估摄食量、食欲,尽管它们可能是影响CCK 水平的潜在变量(Jahangard et al.,2018)。因此,未来研究应评估研究对象的食欲和摄食量。另一方面,临床前研究中,在不同应激类型的抑郁模型中,CCK 均扮演重要角色。系统注射CCK2-R 拮抗剂减少CSDS 模型鼠强迫游泳实验的不动时间(Berna et al.,2007)。小鼠内侧前额叶(mPFC)注射CCK-8 后产生抑郁行为,伴随c-Fos mRNA 水平变化,提示神经元活性降低可能参与抑郁发病机制(Vialou et al.,2014);而mPFC 内注射CCKB-R 的拮抗剂,可逆转CSDS 小鼠的社交回避和糖水偏好受损。研究还发现,应激复原小鼠CCKB mRNA水平显著低于应激易感小鼠,这可能是一种潜在恢复性的分子适应。敲减BLA CCK,小鼠表现出较低的绝望样行为,提示BLA 中表达的CCK 是导致抑郁的关键物质之一(Del et al.,2012)。成年雄性大鼠接受7 周慢性温和应激(CMS)后,眶额皮质腹侧眶中CCK 阳性神经元密度显著增加。Shen 等(2019)发现,杏仁核CCK 阳性神经元投射到伏隔核的抑制性神经元是一条新的参与抑郁症发病的神经环路,在CSDS 抑郁动物模型中,该环路的突触活动显著增强,利用光遗传技术抑制此神经环路的突触活动可改善抑郁症状。另有研究通过转录组学发现,21 天CMS 诱导小鼠抑郁样行为,同时雄性应激小鼠下丘脑CCK mRNA 水平上调,提示应激对下丘脑CCK 转录水平的 调 节存 在性 别差 异(Karisetty et al.,2017)。Kim 等(2003)发现,8 周CMS 大鼠表现出抑郁样行为,PVN、下丘脑室周核、丘脑室旁核和弓状核几个亚区CCK 合成增加,相比之下,NPY 合成降低,推测NPY 与CCK 在调节应激反应过程中扮演相反的作用。
研究表明,CCK 及其受体通过多种机制参与抑郁发生、发展的病理过程。大鼠经历慢性重复社会失败应激(RSDS),引发抑郁行为,伴海马体积减少,齿状回细胞增殖减少,HPA 轴过度激活以及额叶皮质CCK 释放增加(Becker et al.,2008);而长时间阻断CCK2 受体可逆转上述过程;长期使用三环类抗抑郁药丙咪嗪治疗可逆转RSDS 导致的抑郁行为及额叶皮质CCK 释放增加。这些结果提示,CCK 系统可能通过调节HPA 轴活性及海马细胞增殖影响抑郁行为。与此相一致,在早期“母子分离”(MS)抑郁模型中也证实CCK 参与调节早期生活应激对HPA 轴功能的长期影响。静脉注射CCK-4 使MS 抑郁模型大鼠血清皮质酮水平升高,而对非抑郁模型大鼠无显著影响,提示CCK 可使MS 应激大鼠HPA 轴反应增强(Greisen et al.,2005)。此 外,CCKB 受 体 拮 抗 剂 而 非CCKA 受体拮抗剂可逆转抗抑郁行为,这一效应被CCK-8或选择性CCKB 受体激动剂逆转,也可被多巴胺受体拮抗剂逆转(Hernando et al.,1994);使用低于临床有效剂量的CCKB 受体拮抗剂与诺米芬苷(一种选择性阻断多巴胺再吸收机制的非典型抗抑郁药)联合处理可产生抗抑郁作用,提示单独或联合使用CCKB 受体拮抗剂治疗抑郁症的可能性。另有研究表明CCK 对其他神经递质也有调节作用,如γ-氨基丁酸(GABA)、谷氨酸和乙酰胆碱,然而CCK 的这种调节作用是否在抑郁的病理机制中扮演重要角色还有待明确。有研究发现,CCK 可调节不同营养状态下的突触可塑性。在禁食状态下,ghrelin 通过其受体GHR 激活腺苷酸活化蛋白激酶(AMPK)进而抑制雷帕霉素靶蛋白(mTOR)并阻断LTD 的诱导;再给食时,迷走神经兴奋可激活CCK 并作用于NMDAR-ERK 通路,改变AMPK 和mTOR 之间的平衡并因此易化孤束核LTD 的诱导(Khlaifia et al.,2017)。Crosby 等(2018)证实,CCK 将大鼠下丘脑背核GABA 突触的可塑性从在生理条件下的长时程抑制(LTD)转变为LTP,这一过程需要激活CCK2受体,后者作用于星形细胞上代谢型谷氨酸受体以触发胞内钙浓度的升高,并释放胶质递质ATP,ATP 随后作用于GABA 上的嘌呤能受体以促进GABA 的释放。而CCK 调节突触可塑性的相关研究仅在食欲、饱腹信号方面,由于慢性应激可调控突触可塑性,未来需进一步探索抑郁动物模型中CCK 与突触可塑性的关系。有趣的是,CCK 调控抑郁可能涉及其他脑肠肽。侧脑室注射CCK-4 诱发小鼠在强迫游泳实验不动时间增加,CCK 的致抑郁效应被联合注射NPY Y1 受体拮抗剂增强,被联合注射NPY、NPY Y1 受体激动剂减弱(Desai et al.,2014),提示NPY 及其受体可能介导了CCK-4 的致抑郁作用。
运动可作为独立的调节因素影响外周CCK 代谢。一次性运动持续升高血浆CCK 水平,这与血浆游离色氨酸转化为支链氨基酸的比例增加相关(Bailey et al.,2001)。相比之下,4 周运动虽使血浆CCK 水平略有下降,但无显著性,提示,外周CCK 代谢对急性运动可能比慢性运动更敏感或4 周运动不足以改变外周CCK 水平。一次性剧烈运动后,肠道激素(胃泌素、CCK 和胰多肽)和应激激素(去甲肾上腺素、皮质醇、生长激素)的释放即刻增加,且这种增加独立于进食效应(Sliwowski et al.,2001)。一次性跑台运动可以缓解注射CCK-4 诱导的惊恐症状(Strohle et al.,2005)。综上,当前运动对CCK 表达的影响大多关注于其对食欲的调节作用,且多集中于外周,CCK 在运动抗抑郁中扮演的角色在很大程度上是未知的。
4 其他脑肠肽
与NPY 一样,肽YY(PYY)同属胰腺多肽家族的成员,二者的一级和三级结构具有高度同源性。由于其可与某些NPY 的Y 受体亚型结合,因此超生理剂量PYY 给药可能会模拟NPY 的功能。肠内分泌L 细胞可分泌PYY到肠道管腔和循环血液中,作为一种饱腹信号,减少机体的食物摄入量,并引发胃肠道运动减慢,肠细胞对营养物质的吸收增加。在CNS 和胃肠道中,PYY 作为神经递质和体液因子发挥作用。当前,在大脑的下丘脑和皮层、边缘系统均发现PYY 分布。基因敲除小鼠研究表明,雌性和雄性NPY-/-和PYY-/-小鼠在强迫游泳实验中抑郁行为增强,NPY 和PYY 参与调节结肠炎诱发的焦虑和抑郁行为(Painsipp et al.,2011)。与健康个体相比,伴体重下降的抑郁患者空腹血浆PYY 水平增加,但空腹血浆ghrelin、酰化ghrelin 和BDNF 水平无显著性改变(Gimenez-Palop et al.,2012)。另有研究表明,脑脊液NPY 和PYY 分别作为重度抑郁症和精神分裂症的标记物,精神分裂症患者脑脊液中PYY 浓度降低,使用抗精神病药物治疗不会影响脑脊液中PYY 的水平,这可能反映了PYY 的合成、转换或降解异常(Widerlov et al.,1988)。这些研究结果提示,PYY 具有抗抑郁作用,PYY 的缺失可能会增强抑郁样行为,进一步支持了脑肠肽可以影响情感情绪行为的观点。
胃泌素释放肽(GRP)被认为参与或介导了应激反应,一般通过与G 蛋白偶联受体超家族成员GRP 受体结合发挥生物学效用。GRP 及其受体广泛分布于哺乳动物的大脑和胃肠道,其中,脑内在下丘脑、海马、杏仁核等应激相关脑区表达较高。药理学和遗传学研究表明,啮齿类动物的海马背侧和杏仁核等脑区GRP 信号可调节突触可塑性并与抑郁、焦虑、精神分裂症、孤独症的行为改变相关(Roesler et al.,2006)。已有研究表明,自杀死亡的抑郁患者脑内GRP 表达紊乱(Merali et al.,2006)。在应激条件下,脑内GRP 水平显著升高;系统给药或侧脑室注射GRP或受体激动剂后,可产生类似于应激引起的神经内分泌和行为学改变,这种作用可被GRP 受体拮抗剂逆转,提示GRP 信号通路可以作为治疗应激相关疾病的靶标(Merali et al.,2002)。Yao 等(2016)发现,3 周慢性应激小鼠海马GRP 受体mRNA 和蛋白表达升高;腹腔注射氟西汀3 周显著逆转这一指标,提示GRP 受体可能介导了氟西汀的抗抑郁作用。Monje 等(2011)研究发现,GRP 受体敲除小鼠在强迫游泳和糖水实验中表现出抑郁样行为增加,微阵列分析显示BLA 中几种糖皮质激素反应的相关基因表达下调,提示GRP 受体敲除引起糖皮质激素信号不足可能诱发抑郁行为。Merali 等(2009)的另一研究表明应激暴露增加GRP 的表达,刺激垂体释放ACTH,进而可能介导ACTH 释放激素应激反应,提示应激引发的GRP 表达升高,并能够激活HPA 轴。Garrido 等(2002)研究发现,束缚应激增加PVN 应激激素ACTH 和皮质醇的升高以及5-HT活性,侧脑室注射GRP 可产生类似效应,而GRP 受体拮抗剂阻断5-HT 能神经元活化和应激激素升高。综上,GRP及其受体参与调节应激条件下5-HT 能神经元活性、ACTH 和皮质酮水平/HPA 轴活性。
当前研究表明,运动可调节PYY 和GRP 表达。关于运动对PYY 的影响,有限的研究得出了相对一致的结论。从运动方式上,抗阻和有氧运动均可增加血浆PYY 浓度,且这种增加在运动期间及运动后短时间内均有发现(Li et al.,2011)。从运动持续时间上,短期和长期运动均增加血浆PYY 浓度。从运动强度上,血液PYY 的增加水平取决于运动强度(Ueda et al.,2009)。GRP 相关研究发现,健康个体运动后循环GRP 水平几乎无显著变化(Nicholls et al.,1992)。2 周自主跑轮运动下调野生小鼠和钙调蛋白依赖性蛋白激酶IIα 杂合子敲除小鼠GRP mRNA 水平,同时上调野生小鼠海马DG 区细胞增殖,提示运动维持神经元生存和发育可能依赖于GRP 信号(Walton et al.,2014)。总之,运动对PPY 和GRP 的影响与运动方式、时间及受试者的个体因素有关,还有待于证实运动改善抑郁行为与纠正紊乱表达的PPY、GRP 有关。
需注意的是,除脑肠肽外,肠道微生物是脑-肠轴的重要组成部分,并可通过调控血脑屏障,进而影响脑肠肽介导的外周与中枢之间传递信息。已经发现,抑郁症、双相情感障碍、创伤后应激障碍及自闭症谱系障碍等多种心理疾病患者,其肠道微生物群的组成发生显著变化。而服用含乳酸杆菌和双歧杆菌的益生菌后,健康人群和抑郁患者均显示改善抑郁、焦虑和认知功能。肠道微生物通过多种途径与大脑进行“crosstalk”,其中包括HPA 轴、免疫调节、色氨酸代谢以及各种神经活性化合物的产生。有研究表明,增强体力活动可以增加机体有益菌群种类的丰度,且运动对肠道微生物群组成和身体成分的影响可能取决于运动开始时机体所处的发育阶段。例如,与成年雄性大鼠相比,运动对未成年大鼠肠道微生物组成和瘦体重的改变更有效(Mika et al.,2015)。基于运动能够改善健康个体、肥胖人群/动物模型肠道菌群组成(Allen et al.,2018;Campbell et al.,2016),未来研究需进一步阐明肠道微生物在运动抗抑郁中的作用及机制,并在大规模临床和临床前实验中验证。
5 总结
各种形式的应激可使脑肠肽的分泌、释放紊乱,进而影响单胺类神经递质水平、HPA 轴活性、神经营养因子表达和神经可塑性、细胞凋亡、神经毒害物质代谢、表观遗传等,参与抑郁的发生发展。运动可纠正外周或中枢脑肠肽的异常表达,伴随抑郁行为的改善。因此脑肠肽可能是运动抗抑郁的重要中介因子。本文综述了ghrelin、NPY、CCK、PYY、GRP 与抑郁症之间的相关性,并阐释了其介导抑郁的神经生物学机制(图1)。遗憾的是,以当前被广泛接受的抑郁假说为药物靶点开发的新药出现较大药物抗性和副作用,且仍缺乏特定抑郁亚型的有效治疗手段。基于“脑-肠互动”理论以及脑肠肽在胃肠道和大脑中均扮演重要角色,尤其针对抑郁伴功能性胃肠道疾病或抑郁伴代谢性疾病这类“抑郁亚型”,本文提出抑郁的“脑肠肽紊乱假说”,有助于更好地阐释抑郁症状的多样性、复杂性和异质性。运动对某些脑肠肽的调节作用仍不清晰或尚存争议,有待后续使用新的动物模型或研究技术(如新的体内成像技术)进一步明确脑肠肽及其受体的脑区特异性表达/活性。
6 展望
虽然现有研究支持脑肠肽在运动抗抑郁中发挥重要作用,关于抑郁的“脑肠肽紊乱假说”,仍有以下问题值得进一步明确或深入探究:1)应激或抑郁时,与情感调节高度相关的脑区、循环血液、胃肠道的脑肠肽表达是否会发生一致性改变?参与抑郁发病机制的脑肠肽是脑组织原位产生、原位在脑组织发挥作用,还是胃肠道源性通过血脑屏障进入脑内发挥作用?2)脑肠肽也是调节食物摄取的重要胃肠激素,在脑肠轴调控摄食行为中起关键作用。ghrelin、NPY、CCK 等能够调节食欲、体重,提示其可能成为肥胖与抑郁共病机制的中介分子,但这一观点有待于通过药理学或基因工具等手段验证;3)在调节摄食行为中,NPY 是增食欲素,CCK 是抑食欲素。在应激反应中,NPY 是应激复原因子,CCK 与应激损伤相关,已有研究证明NPY 及其受体参与CCK-4 的致抑郁作用,提示二者在调控抑郁行为中存在拮抗关系。那么,各种脑肠肽之间是否存在相互调节作用(协同或拮抗)?4)不同的运动方式、强度和持续时间对抑郁人群和动物模型的脑肠肽水平影响如何?5)CNS 脑肠肽的不同受体亚型可能对其表达/活性的影响不同,可能是治疗抑郁的潜在靶点,因此未来研究应将脑肠肽及其受体作为整体探讨。
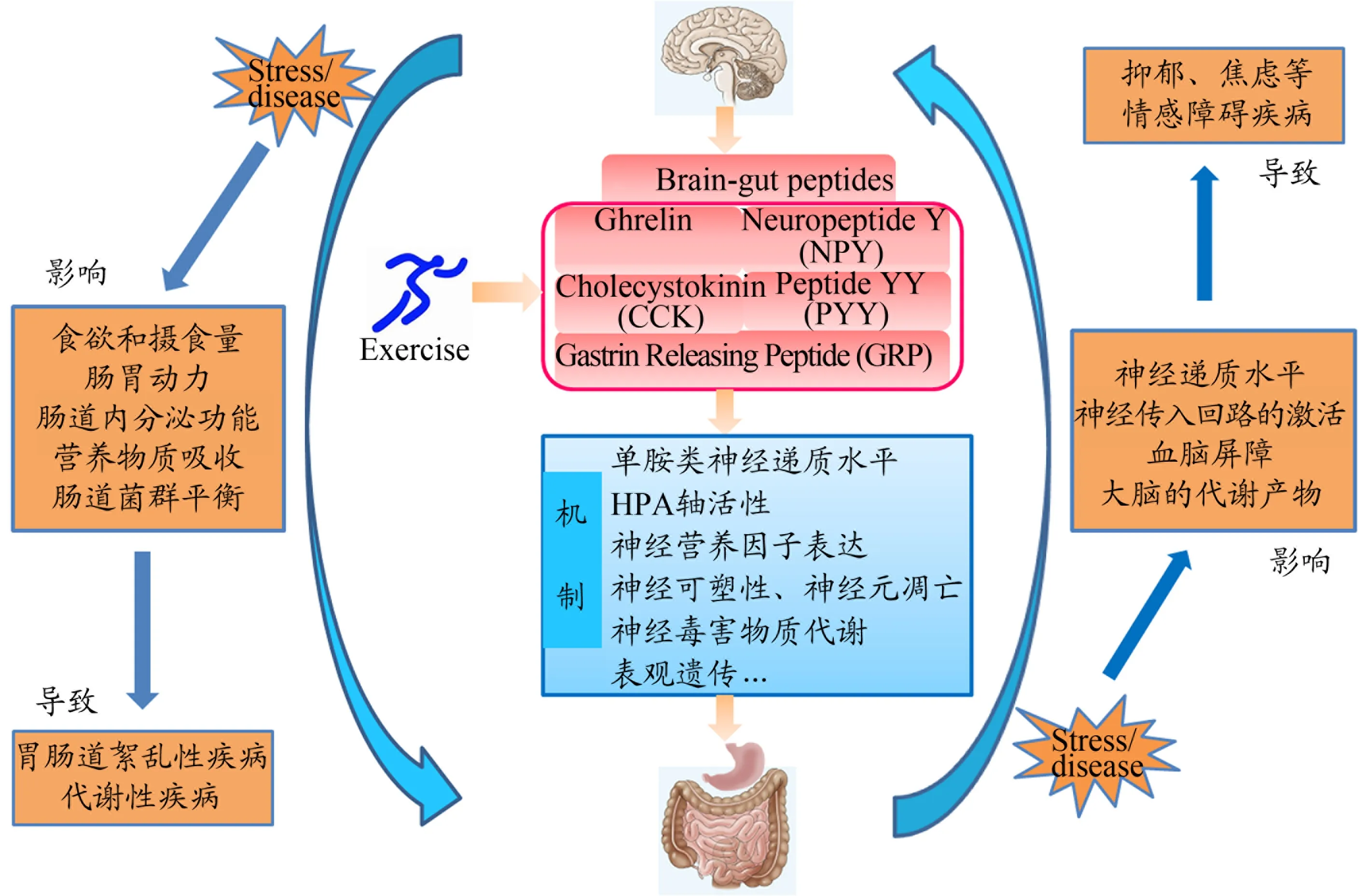
图1 基于“脑-肠互动”理论探讨脑肠肽在运动抗抑郁中的作用机制Figure 1. The Roles and Mechanisms of Brain-Gut Peptides in the Antidepressant Effects of Exercise Based on the“Brain-Gut Interaction”Theory
越来越多的学者认识到大脑与胃肠道之间的相互作用可能在人类的健康和行为中扮演着重要的角色。脑肠肽能够以自分泌、旁分泌、内分泌、神经递质和神经内分泌的方式在胃肠道和大脑发挥广泛的调节作用。运动调节机体各器官分泌的因子,可成为不同器官之间“crosstalk”的中介分子以调节机体的功能,其本质是基于整合生理学的观点揭示运动促进健康机理的最新理论。运动对脑肠轴及其相关脑肠肽的调控作用可部分解释运动抗抑郁的神经生物学机制。未来的研究基于“多因子网络”阐释运动抗抑郁的作用机制将成为一种科学范式。

