12周有氧跑台运动对APP/PS1小鼠海马细胞自噬活性的影响
赵 娜,张宪亮,夏 杰,闫清伟,徐 波*
(1. 华东师范大学“青少年健康评价与运动干预”教育部重点实验室,上海200241;2. 华东师范大学 体育与健康学院,上海200241;3. 山东大学 体育学院,山东 济南250061;4. 西藏民族大学 体育学院,陕西 咸阳712082)
阿尔茨海默病(alzheimer’s disease,AD)是一种与年龄相关的神经退行性疾病,β-淀粉样蛋白(β-amyloid peptides,Aβ)在脑组织内的异常聚集和沉积所产生的神经毒性是AD 发病的中心诱因(Hardy et al.,1992)。近期研究发现,AD 脑内自噬体标志蛋白微管相关蛋白3II(microtubule associated protein light chain 3II,LC3II)和自噬底物蛋白P62 表达均被上调,大量包裹有Aβ 的自噬体和自噬溶酶体出现聚集,提示,AD 脑细胞自噬活性降低可阻碍Aβ清除,是造成Aβ 聚集的重要原因(Hara et al.,2006;Lee et al.,2010;Li et al.,2018;Ntsapi et al.,2018)。
另外,AD 脑内细胞自噬启动的关键因子丝氨酸/苏氨酸蛋白激酶(UNC-51 like kinase 1,ULK1)表达降低,溶酶体降解酶组织蛋白酶D(cathepsin D)和溶酶体成熟相关蛋白Ras 相关GTP 结合蛋白7(Ras related GTP binding protein 7,Rab7)表达降低,提示,AD 脑细胞自噬启动受阻和溶酶体降解功能受损是导致细胞自噬活性降低的重要原因(Abd-Elrahman et al.,2018;Bordi et al.,2016)。更重要的是,包裹有Aβ 的自噬体异常堆积,可引发神经轴突肿胀,诱使神经营养不良,进而加快神经元凋亡(Nilsson et al.,2014;Sanchez-Varo et al.,2012)。有研究发现,通过提高AD 脑细胞自噬活性可减少Aβ 沉积,并可抑制神经凋亡(Aminyavari et al.,2019;Yuan et al.,2018)。因此,改善细胞自噬障碍可能是AD 的潜在治疗策略。
现研究已证实,运动可以减少Aβ 沉积,抑制神经元丢失,以延缓AD 的发病进程(Choi et al.,2018;Elahi et al.,2016;Lourenco et al.,2019),但其具体机制尚未完全阐明。He 等(2012)首次发现运动不仅可以提高外周组织的自噬活性,还可以提高脑细胞自噬活性。随后研究证实,运动可以通过提高衰老鼠、神经损伤模型鼠的细胞自噬活性,抑制神经元凋亡,并改善认知功能障碍(Bayod et al.,2014;Zhang et al.,2013)。但运动是否可通过调节细胞自噬活性改善AD 需深入探讨。
本研究旨在通过采用APPswe/PS1E9(APP/PS1)双转基因AD 模型小鼠为实验对象,观察12 周有氧跑台运动对APP/PS1 小鼠学习记忆能力、海马内Aβ 聚集、神经元凋亡及细胞自噬活性的影响,以揭示细胞自噬在运动预防AD中的作用。同时,探讨12 周跑台运动对APP/PS1 小鼠海马细胞自噬启动、自噬溶酶体融合降解的影响,以阐明运动调节APP/PS1 小鼠海马细胞自噬活性的机制。
1 实验材料与方法
1.1 实验动物与分组
3 月龄的SPF 级C57BL/6 雄性野生小鼠18 只和APP/PS1 转基因AD 雄性小鼠18 只,均购于南京大学生物模式实验动物中心,合格证书:SCXK(2015-0001)。动物房温度23℃~26℃,湿度50%~65%,12 h 光照/12 h 黑暗,采用SPF 级转基因动物标准饲料喂养,自由饮水,适应性饲养1 周,随机分为4 组:C57BL/6 野生型小鼠随机分为野生安静组(WTC,n=9)和野生运动组(WTE,n=9);APP/PS1 小鼠随机分为转基因安静组(ADC,n=9)和转基因运动组(ADE,n=9)。
1.2 运动干预方案
运动方案主要参考Baker 等(1999),运动强度为45%~55% V. O2max,属长期有氧运动。WTE 和ADE 组小鼠从3月龄开始进行为期12 周的有氧跑台运动干预:首先进行为期1 周的适应性训练,第1、2 天的运动速度为5 m/min,第3、4 天速度为8 m/min,第5、6 天速度为12 m/min,第7 天休息。随后,进入12周的正式训练,每周训练5天,每天训练45 min,每天训练时间固定为18:00-20:00,周四、周日休息,在运动训练时间内,将安静组至于静止跑台。运动组正式训练的具体方案为:每天首先以5 m/min、8 m/min的速度先后各运动5 min,随后以12 m/min 的速度运动30 min,最后以5 m/min 的速度运动5 min,直至训练结束。
1.3 Morris 水迷宫测试
Morris 水迷宫实验(morris water test,MWT)测试小鼠的学习记忆能力。水迷宫实验主要包括5 天定位航行实验和1 天的空间探索实验。定位航行实验主要评价小鼠的空间学习能力,空间探索实验主要评价小鼠的空间记忆能力。水迷宫的圆形水池直径为1.5 m,高为0.5 m,水池可分为4 个象限,将第1 象限设为目标象限。实验前1 天,将小鼠置于水池中适应10 min。在前5 天的定位航行实验中,将直径为10 cm 的平台置于目标象限,并隐藏于水下1 cm,分别将小鼠从第1、2、3、4 象限放入水中,电脑软件记录小鼠入水至寻找并爬上平台的时间和路程,即潜伏期时间、潜伏期游泳路程,60 s 为限,评价小鼠的学习能力。在第6 天的空间探索实验中,撤去平台,将小鼠从各象限放入,记录各组小鼠在60 s 内穿越原平台位置的次数、游泳总路程及路径轨迹,评价小鼠的空间记忆能力。
1.4 取材
水迷宫测试结束24 h 后,各组小鼠均禁食12 h,于次日腹腔注射10%的水合氯醛麻醉,各组随机取3 只进行心脏灌注,快速取全脑置于4%的多聚甲醛固定,随后制作石蜡切片,以用于免疫荧光检测。各组其余6 只小鼠麻醉后断头处死,迅速取出双侧海马,置于液氮中保存。一侧海马提取组织总蛋白,用于Western blotting 和ELISA 实验;另一侧海马提取组织总RNA,用于Real-time PCR 实验。
1.5 实验试剂、仪器及方法
1.5.1 免疫荧光检测
从4%多聚甲醛中取出固定好的全脑进行切割,将海马部位分离,并制作石蜡切片。使用切割机(上海徕卡,RM2016)切割蜡块,切片厚度为4 μm,在每只小鼠脑立体定位坐标前卤后1.7~2.7 mm 区间内,选取3 张切片,每张切片间隔100 μm。每张切片在海马区域内随机选取3 个视野。将石蜡切片脱蜡至水,进行抗原修复。玻片置于pH=7.4 PBS 洗涤3 次后,将切片甩干。用组化笔画圈并加入自发荧光淬灭剂5 min,流水冲洗后滴加BSA 孵育封闭20 min。随后进行一抗孵育,一抗为Aβ(abcam,ab2539,稀释比例1:100)、LC3(proteintech,18725-1-AP,稀释比例1:100),一抗孵育过夜,次日避光进行二抗(Servicebio,GB21301/GB25303,稀释比例1:300/1:400)孵育。使用DAPI 复染细胞核后封片,镜检拍照。DAPI 紫外激发波长330~380 nm,发射波长420 nm,蓝光;FITC 激发波长465~495 nm,发射波长515~555 nm,绿光;利用Image-Pro Plus version 6.0(IPP)图像分析软件分析:Aβ 的沉积水平主要采用Aβ 斑块面积所占视野区域面积的百分比计算;LC3 的免疫荧光强度主要采用视野区域单位面积内的积分光密度(Integral Optical Density,IOD)计算,并对各组数据归一化处理后(normalization)进行统计学分析。
1.5.2 Western blotting检测
取各组一侧海马加入140 μl 的含有PMSF 的RIPA 裂解液(Beyotime Biotechnology)进行匀浆离心,获取上清液,随后使用BCA 蛋白质浓度测定试剂盒(Beyotime Biotechnology,P0010)按照说明书对蛋白进行定量。随后依次上样、电泳、转膜、封闭、一抗孵育过夜,对应的二抗孵育60min,使用ECL 发光试剂盒(Beyotime Biotechnology,P0018A)在Alpha:FluorChen HD2 凝胶系统拍照,并分析积分灰度值,结果用蛋白相对表达量进行计算。
一抗稀释比例:Aβ(abcam,ab216436,1:1 000),Bax(abcam,ab32503,1:1 000),Bcl2(abcam,ab182858,1:2 000),caspase3(abcam,ab32351,1:5 000),ULK1(CST,#6439,1:1 000),p-ULK1ser555(CST,#5869,1:1 000),LC3(proteintech,18725-1-A,1:1 000),P62(abcam,ab109012,1:1 000),Cathepsin D(abcam,ab75852,1:2 000),Rab7(abcam,ab137029,1:1 000),GAPDH(abcam,ab8245,1:5 000)。
1.5.3 酶联免疫(ELISA)检测
采用Aβ40 和Aβ42 的酶联免疫试剂盒(上海生工生物工程有限公司),按照说明书操作。使用酶标仪在450 nm波长下测定吸光度(OD)值,最后通过标准曲线计算各组小鼠海马组织Aβ40 和Aβ42 的浓度。
1.5.4 Real-time PCR检测
取一侧海马(约20 mg),按照硕盟生物公司的Trizol试剂说明书(硕盟生物,A211-01)经过匀浆、分相、分离、洗涤、提纯等步骤提取总RNA。采用MyCycler PCR 扩增仪按照TOYOBO 反转录试剂盒(TOYOBO,FSQ-101)的操作说明书的详细步骤进行反转录,随后按照Real-time PCR 试剂(TOYOBO,QPK-201)说明书配置20 μl 反应体系,利用StepOneTMReal-Time PCR 仪完成检测。最后根据检测的Ct 值,以β-actin 为内参基因,采用2-∆∆CT的方法计算目的基因mRNA 的相对表达量,随后进行统计分析,并对数据进行归一后作图。
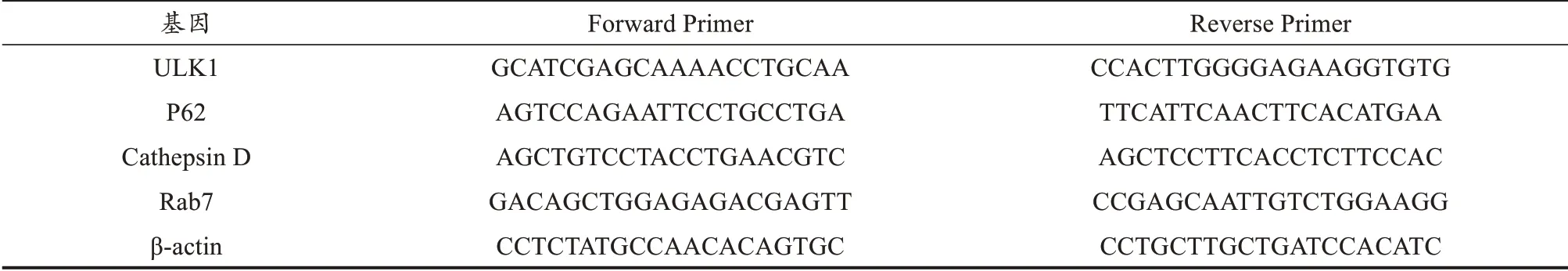
表1 目的基因引物序列Table1 Primers Sequence of Target Genes
1.5.5 数据处理方法
使用Graphpad Prism 7.0 软件进行数据统计与作图,统计方法采用双因素方差分析(two-way ANOVA),事后检验采用LSD 法,所有数据采用均值±标准误(M±SEM)表示,以P<0.05 表示具有显著性差异,以P<0.01表示具有非常显著性差异。
2 研究结果
2.1 运动对小鼠学习记忆能力的影响
定位航行实验结果显示,各组小鼠的潜伏期时间、潜伏期游泳路程均随着学习天数的增加逐渐缩短。如图1A所示,实验前2 天各组小鼠的潜伏期时间和潜伏期游泳路程均无显著性差异。第3 天,ADC 组小鼠潜伏期游泳路程显著高于WTC 组(P<0.01);而与ADC 组相比,ADE 组小鼠潜伏期时间(P<0.05)和潜伏期游泳路程(P<0.05)均显著降低。第4 天,ADC 组小鼠潜伏期时间(P<0.05)和潜伏期游泳路程(P<0.01)依然显著高于WTC 组;而与ADC 组相比,ADE 组小鼠潜伏期时间(P<0.05)和潜伏期游泳路程(P<0.01)均显著降低。第5 天,与WTC 组相比,WTE组小鼠潜伏期游泳路程显著缩小(P<0.05),ADC组小鼠潜伏期时间(P<0.01)和潜伏期游泳路程(P<0.01)均显著增加;而与ADC 组相比,ADE 组小鼠潜伏期时间(P<0.05)和潜伏期游泳路程(P<0.01)均显著降低。
空间探索实验结果显示,如图1C 所示,与WTC 组相比,ADC 组小鼠穿越平台次数显著减少(P<0.01);与ADC组相比,ADE 组小鼠穿越平台次数显著增加(P<0.01)。如图1D 所示,与WTC 组相比,WTE 组小鼠的平台象限时间百分比显著增加(P<0.05),而ADC 组小鼠的平台象限时间百分比显著减少(P<0.05);而与ADC 组相比,ADE 组小鼠平台象限时间百分比显著增加(P<0.05)。如图1E所示,各组小鼠的游泳总距离无显著性差异(P>0.05),这提示各组小鼠的游泳能力无差别。
2.2 运动对小鼠海马Aβ聚集的影响
采用DAPI 对细胞核进行染色,采用抗体染色标记Aβ,采用日本成像系统对切片进行拍照,DAPI 阳性呈蓝色荧光,Aβ 阳性呈绿色荧光(图2A)。Aβ 沉积面积结果显示(图2B),与WTC 组相比,ADC 组小鼠海马Aβ 沉积面积显著增加(P<0.01),与ADC 组相比,ADE 组小鼠海马Aβ 沉积面积显著减小(P<0.01)。Western blotting 结果显示(图2C),与WTC 组相比,ADC 组小鼠海马Aβ 蛋白表达水平增高(P<0.01),与ADC 组相比,ADE 组小鼠海马Aβ 蛋白表达水平降低(P<0.01)。

图1 各组小鼠MWM测试结果(n=6)Figure1. Results of Morris Water Maze Test

图2 小鼠海马Aβ聚集水平检测结果Figure 2. Results of Aβ Deposition Levels in Hippocampus of Mice
ELISA 结果显示,如图2D、E 所示,与WTC 组相比,ADC 组小鼠海马内的可溶性Aβ40 和Aβ42 的表达增加(P<0.01),与ADC 组相比,ADE 组小鼠海马内的可溶性Aβ 40 和Aβ42 的表达均降低(P<0.01)。
2.3 运动对小鼠海马细胞凋亡相关蛋白的影响
Aβ 聚集可诱发神经过度凋亡,因此本研究也检测了凋亡相关蛋白B 淋巴细胞瘤-2 基因(B-cell lymphoma 2,Bcl2)、Bcl2-associated X 的蛋白质(Bcl2-associated X protein,Bax)和含半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase 3,caspase3)的表达。如图3A 所示,与WTC 组相比,ADC 组小鼠海马内Bax 表达显著增高(P<0.01);与ADC 组相比,ADE 组小鼠海马内Bax 表达显著降低(P<0.01)。如图3B 所示,与WTC 组相比,WTE 组小鼠海马内Bcl2 表达显著增高(P<0.05),ADC 组小鼠海马内Bcl2 表达显著降低(P<0.05)。与ADC 组相比,ADE 组小鼠Bcl2 表达显著增高(P<0.01)。如图3C 所示,与WTC 组相比,ADC 组小鼠海马Bax/Bcl2的比值显著增加(P<0.01);与ADC 组相比,ADE 组小鼠海马Bax/Bcl2 的比值显著降低(P<0.05)。如图3D 所示,与WTC 组相比,ADC 组小鼠海马内caspase3 表达显著增高(P<0.05);与ADC 组相比,ADE 组小鼠海马内caspase3 表达显著降低(P<0.05)。

图3 小鼠海马细胞凋亡蛋白的检测结果Figure 3. Results of Apoptosis-related Protein Levels in Hippocampus of Mice
2.4 运动对小鼠海马细胞自噬的影响
2.4.1 运动对小鼠海马细胞自噬活性的影响
如图4A 所示,采用DAPI 对细胞核进行染色,采用LC3抗体染色标记自噬体,采用日本成像系统对切片进行拍照,DAPI 阳性呈蓝色荧光,LC3 阳性呈绿色荧光。如图4B所示,与WTC 组相比,WTE 组小鼠海马LC3 荧光强度增强(P<0.01),ADC 组小鼠海马LC3 荧光强度增强(P<0.01)。与ADC组相比,ADE组小鼠海马LC3荧光强度增强(P<0.01)。同时,如图4C所示,与WTC组相比,WTE组小鼠海马LC3II/I蛋白比值显著增加(P<0.05),ADC 组小鼠海马LC3II/I 蛋白比值增加(P<0.01),而与ADC 组相比,ADE 组小鼠海马LC3II/I 的比值进一步增加(P<0.01)。

图4 小鼠海马自噬活性相关蛋白的检测结果Figure 4. Results of Autophagy Activity-related Protein Level in Hippocampus of Mice
如图4D 所示,与WTC 组相比,ADC 组小鼠海马P62 mRNA 表达水平显著增加(P<0.01),而与ADC 组相比,ADE 组小鼠海马P62 mRNA 的表达水平显著降低(P<0.01)。同时,如图4E 所示,与WTC 组相比,WTE 组小鼠海马内P62 蛋白表达显著降低(P<0.01),ADC 组小鼠海马P62 蛋白表达水平显著增加(P<0.01);而与ADC 组相比,ADE 组小鼠海马P62 表达显著降低(P<0.01)。
2.4.2 运动对小鼠海马细胞自噬启动阶段的影响
如图5A、B 所示,与WTC 组相比,WTE 组小鼠海马ULK1 mRNA 和ULK1 蛋白表达水平均显著增高(P<0.05),而ADC 组小鼠海马ULK1 mRNA 和ULK1 蛋白表达水平均未见显著性差异(P>0.05);与ADC 组相比,ADE 组小鼠海马ULK1 mRNA 和ULK1 蛋白表达水平均显著增 高(P<0.05)。如图5C 所示,与WTC 组相比,WTE 组小鼠海马p-ULK1 ser555 的水平显著增高(P<0.05),而ADC 组小鼠海马p-ULK1 ser555 的表达水平未见显著性差异(P>0.05);与ADC 组相比,ADE 组小鼠海马p-ULK1 ser555 的水平显著增高(P<0.05)。
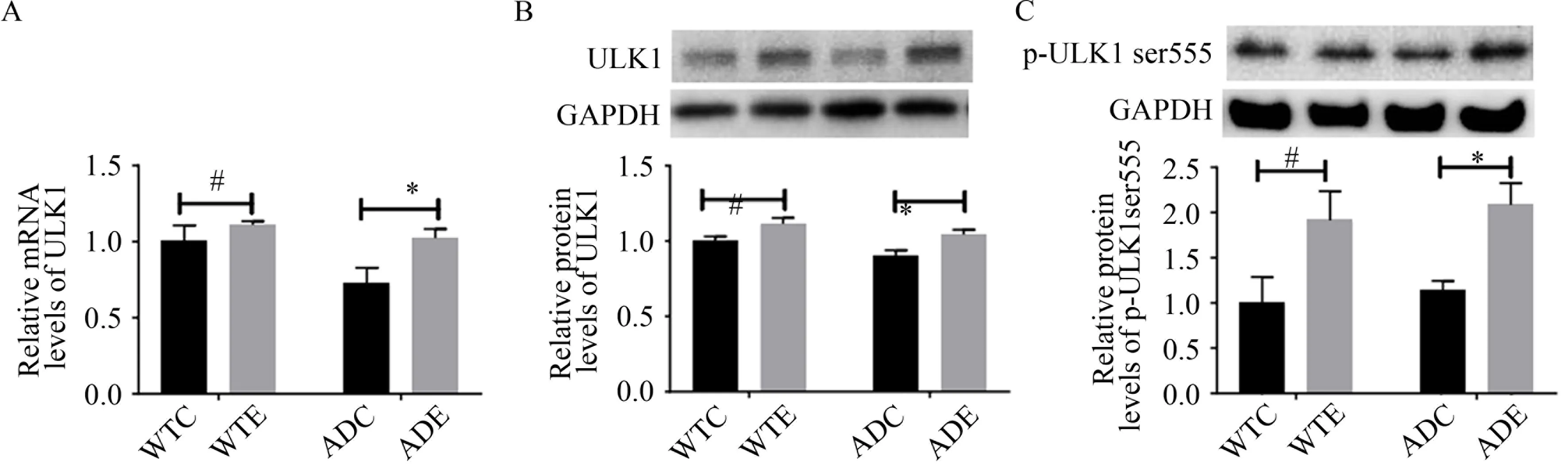
图5 小鼠海马自噬启动相关蛋白的检测结果(n=6)Figure 5. Results of Autophagy Initiation-related Protein Levels in Hippocampus of Mice
2.4.3 运动对小鼠海马细胞自噬溶酶体融合阶段的影响
如图6A、B 所示,与WTC 组相比,WTE 组小鼠海马cathepsin D 的mRNA(P<0.01)和Cathepsin D 蛋 白(P<0.05)的表达水平均显著增高,ADC 组小鼠海马cathepsin D的mRNA 水平显著降低(P<0.05),但Cathepsin D 的蛋白表达水平无显著性变化(P>0.05);与ADC 组相比,ADE 组小鼠海马Cathepsin D mRNA 和蛋白表达水平均显著增加(P<0.01)。如图6C、D 所示,与WTC 组相比,WTE 组小鼠海马Rab7 的mRNA 和蛋白表达水平均显著增加(P<0.01),ADC 组小鼠海马Rab7 mRNA 和蛋白表达水平均显著降低(P<0.01);与ADC 组相比,ADE 组小鼠海马Rab7 mRNA和蛋白表达水平均显著增加(P<0.01)。

图6 小鼠海马自噬溶酶体融合相关蛋白的检测结果(n=6)Figure 6. Results of Autolysosome Fusion-related Protein Levels in Hippocampus of Mice
3 讨论与分析
3.1 运动可改善APP/PS1小鼠海马病理变化
AD 是一种常见的神经退行性疾病,认知功能障碍是其主要的临床表现。海马是大脑边缘系统的一部分,在空间记忆以及方向定位等脑生理功能方面起重要作用,海马萎缩是导致AD 学习记忆能力下降的重要原因(Barinov,2017)。研究表明,脑内Aβ 异常聚集是导致海马萎缩的重要诱因,Aβ 在脑内聚集产生的神经毒性可诱发炎症反应、突触损伤、线粒体功能障碍等一系列的病理改变,以上病理改变相互作用共同导致神经元轴浆运输功能受损,神经元能量代谢发生障碍,最终造成神经元死亡,引发认知功能障碍(Hardy et al.,1992)。本研究采用Morris水迷宫实验检测小鼠的学习记忆能力,结果显示,安静组APP/PS1 小鼠的潜伏期时间和游泳总路程均高于野生型小鼠,穿越平台次数和平台象限时间百分比均显著低于野生安静组小鼠,提示6 月龄APP/PS1 小鼠的空间学习能力和记忆能力受损。本实验结果还显示,伴随学习记忆能力的降低,6 月龄APP/PS1 小鼠海马内Aβ 斑块以及可溶性Aβ40 和Aβ42 的表达均增加,促凋亡相关蛋白Bax、caspase3 的表达被上调,抗凋亡蛋白Bcl2 的表达被下调,Bax/Bcl2 比值增高,这表明APP/PS1 小鼠海马内Aβ 聚集水平增加,细胞凋亡被上调。以上结果表明,本实验所采用的APP/PS1 小鼠成功模拟了AD 的学习记忆能力降低,Aβ 沉积增加,神经元过度凋亡等病理改变。
近年来,体育锻炼抵御脑神经病理学的作用得到广泛关注。有研究先后证实,运动可有效预防和缓解AD 的发病进展,成为AD 早期干预的重要手段。人体实验发现,经常参与体育活动可以显著降低AD 的发病风险,并且对AD 患者脑内淀粉样斑块水平、海马体积及糖代谢产生有益影响(Buchman et al.,2012)。动物实验也发现,运动可以有效减少AD 模型小鼠海马内Aβ 沉积,抑制神经元死亡,延缓小鼠学习记忆能力下降(Um et al.,2011;Zhang et al.,2018)。本研究发现,运动增加了C57BL/6 小鼠的潜伏期路程和平台象限时间百分比,提示运动可以提高野生型小鼠的空间学习记忆能力。有研究发现,运动可以促进海马神经元的发生和增强突触可塑性(Choi et al.,2018;Tharmaratnam et al.,2017)。同时,本研究结果显示,运动上调了C57BL/6 小鼠抗凋亡蛋白Bcl2 的表达,而对促凋亡蛋白Bax、csapase3 未产生显著影响。以上提示,在健康的生理状态下,运动诱导的Bcl2 表达升高可能有利于提高海马神经元的抗凋亡能力,以促使海马神经元抵御病理变化。
与先前研究一致,本实验结果显示,运动显著降低了APP/PS1 小鼠的潜伏期时间和潜伏期路程,提高了APP/PS1 小鼠穿越平台次数和平台象限时间百分比,提示运动可以延缓APP/PS1 小鼠的学习记忆能力降低。同时,本研究结果也显示,运动减少了APP/PS1 小鼠海马内的Aβ 沉积斑块和可溶性的Aβ40 和Aβ42 的含量,抑制了促凋亡蛋白Bax、caspsase3 的表达,提高了抗凋亡蛋白Bcl2 的表达,降低了Bax/Bcl2 的比值。综上结果,进一步表明,运动可有效减少APP/PS1 小鼠海马内Aβ 沉积,抑制神经元凋亡,改善学习记忆,起到改善和预防AD 的作用。
3.2 运动可提高APP/PS1小鼠海马细胞自噬活性
细胞自噬(autophagy)是一种依赖溶酶体帮助机体清除和降解受损变性的蛋白质、衰老及失去功能的细胞和细胞器,以此维持蛋白质代谢平衡和细胞内环境稳定的生理过程(Klionsky,2014)。细胞自噬是一个连续的动态过程,其主要分为自噬启动阶段、自噬体形成及成熟阶段、自噬体与溶酶体融合降解3 个阶段。自噬活性(autophagy activity)被用来描述自噬过程中清除待降解物的速率。包裹有待降解物的自噬体能被快速地清除,则表明自噬活性高。细胞自噬过程中的任一阶段受阻,均可导致自噬活性降低。自噬活性降低,则会导致错误折叠蛋白及自噬体的聚集,这与神经退行性疾病的发生密切相关(Menzies et al.,2015)。
LC3 是Atg8 的同源蛋白质,新合成的LC3 可被半胱氨酸蛋白酶Atg4 处理后形成胞浆蛋白LC3I,LC3I 经Atg7和Atg3 催化后,与磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)结合形成LC3II,LC3II 与自噬体膜紧密相连,以促进自噬囊泡的延伸和自噬体成熟。因此,LC3II/I 被用来评价自噬体的形成情况(Yoshii et al.,2017)。P62 是一种泛素化蛋白,其一端可通过泛素化连接待降解物,一端连接自噬体膜上的LC3 蛋白,P62 会随着待降解物的降解被降解,在一定范围内,P62 与自噬活性呈负相关(Jiang et al.,2015)。Nixon 等(2000,2008)发现,在营养丰富的健康神经元内自噬体极少,但在AD 患者脑神经元肿胀处,存在大量包裹有Aβ 的自噬体及自噬溶酶体聚集,表明AD 脑内细胞自噬降解受阻,自噬活性降低。动物实验也发现,APP 突变小鼠、SAMP8、3XTg-AD 等多种AD 模型鼠脑内P62 表达增高,自噬体聚集,提示AD 脑细胞自噬活性降低(Chen et al.,2019;Huang et al.,2017;Reddy et al.,2018)。Yuan 等(2018)给SD 大鼠注射Aβ42 造模发现,Aβ42 可 上 调LC3II 表 达,增 加P62 表 达,并 上 调 了Bax、caspase3 等促凋亡蛋白的表达,提示AD 脑细胞自噬活性降低与Aβ42 的神经毒性作用密切相关。Caccamo 等(2010)通过给3xTgAD 小鼠注射自噬激活剂发现,小鼠海马细胞自噬活性提高,小鼠海马Aβ 沉积减少,改善了小鼠学习记忆能力。这些研究均表明,海马细胞自噬障碍参与AD 的发病过程,提高细胞自噬活性可能是改善AD的重要潜在策略。本研究结果显示,与野生型小鼠相比,APP/PS1 小鼠海马内LC3 荧光强度增强,LC3II/I 蛋白水平表达增加,提示APP/PS1 小鼠海马内自噬体增多。同时,本研究还发现,APP/PS1 小鼠海马P62mRNA 和蛋白表达水平均增加。这提示,APP/PS1 小鼠海马细胞自噬活性降低,自噬体出现聚集。
Zhang 等(2014)发现,为期2 周的跑台运动可显著抑制脑缺血模型大鼠神经元凋亡,并显著降低P62 的表达,提示运动抑制脑细胞凋亡与自噬活性变化有关。Marques-Aleixo 等(2016)发现,SD 大鼠腹腔注射阿霉素可上调神经元内LC3II 表达,增高细胞凋亡标志蛋白Bax/Bcl2 的比值,降低学习记忆能力,而为期12 周的跑台和跑轮运动可以显著下调LC3II 的表达,降低P62 的表达,抑制细胞凋亡,改善大鼠的学习记忆能力,表明运动可通过提高自噬活性改善学习记忆功能受损。这些研究提示,运动可通过提高神经损伤模型鼠海马细胞自噬活性,抑制神经元死亡,保护脑健康。本研究发现,运动显著增强了APP/PS1 小鼠海马LC3 的荧光强度,并提高了小鼠海马LC3II/I 的表达,降低了P62 的表达。这提示,运动可提高APP/PS1 小鼠海马细胞自噬活性。综合上述结果表明,运动提高海马细胞自噬活性可能加快了Aβ的降解。
有意思的是,健康野生型鼠脑内并未出现自噬异常和Aβ 病理变化,运动也能在基础水平上提高其自噬活性。Bayod 等(2014)发现,为期9 个月的跑台运动可以显著提高10 月龄SD 大鼠脑内LC3II/I 的比值,降低P62 表达,提示运动可以提高野生成年大鼠脑细胞自噬活性。Rocchi等(2017)也发现,为期2 周的跑轮运动和跑台运动均能提高C57BL/6 小鼠脑细胞自噬活性。与先前研究一致,本研究结果显示,运动显著增强了野生型C57BL/6 小鼠海马LC3 的荧光强度,并上调了LC3II/I 的比值,下调了P62 的表达。以上研究提示,运动可以提高健康野生型鼠的海马细胞自噬活性。综合本研究上述结果,运动对C57BL/6小鼠学习记忆和细胞凋亡的积极影响,提示,健康状态下,运动提高细胞自噬活性可能有利于维持神经元存活和脑健康适应。
3.3 运动可提高APP/PS1小鼠海马细胞自噬启动
根据自噬机制可知,自噬活性主要由自噬启动和自噬溶酶体融合降解共同决定(Ntsapi et al.,2018)。为了进一步阐明运动调节小鼠海马细胞自噬活性的机制,本研究分别对细胞自噬启动和自噬溶酶体融合降解阶段进行了检测。
细胞在缺血、缺氧、高温等外部条件或细胞器受损、错误折叠蛋白聚集等内部条件的刺激下,均可激活细胞自噬。细胞自噬启动主要依赖于ULK1 的Ser555 位点复合体的磷酸化激活。ULK1 可在上述刺激下激活,活化后的ULK1 可通过磷酸化Atg13、FIP200 形成ULK1 复合物,随后可通过磷酸化Atg9 等底物,募集自噬体形成关键蛋白LC3,以促进自噬体的形成。同时,ULK1 复合物将从胞质转移至内质网,形成自噬体原核,并诱导自噬启动(Papinski et al.,2014)。Abd-Elrahman 等(2018)发现,3XTg AD 小鼠海马内Aβ 沉积增多,神经元凋亡增加,自噬体出现聚集,而代谢性谷氨酸受体5 的抑制剂通过激活ULK1 的磷酸化,上调细胞自噬活性,减少了Aβ 沉积及抑制了神经元凋亡。本实验结果显示,APP/PS1 小鼠海马ULK1m-RNA 和蛋白表达水平出现下降趋势,但并未发生显著性变化,p-ULK1 的磷酸化水平略有升高,但也未见显著性差异。这提示,APP/PS1 小鼠海马自噬启动未发生明显损伤。
本研究发现,运动显著增加了C57BL/6 小鼠和APP/PS1 小 鼠 海 马ULK1 的mRNA 和 蛋 白、p-ULK1ser555 的 蛋白表达水平,这表明运动可促进ULK1ser555 位点的磷酸化,激活野生型小鼠和APP/PS1 小鼠海马细胞自噬启动,促进自噬体形成。Marques-Aleixo 等(2015)发现,12 周的跑台运动和跑轮运动均可提高SD 大鼠海马内的自噬体形成的关键蛋白Beclin1 的表达,表明运动促进了SD 大鼠皮层的自噬体形成。Herring 等(2016)采用7 月龄的TgCRND8 雌性AD 小鼠进行为期5 个月的跑轮运动发现,运动显著增加了大脑皮层和海马内Beclin1 和Atg5 的表达,表明运动增加了AD 小鼠的自噬体形成。研究表明,在细胞能量充足时,ULK1 的活性被抑制,进而保证自噬处于基础水平。当细胞处于饥饿等能量需求增加,ATP 产生不足时,便可激活AMPK 的表达,AMPK 激活可以磷酸化ULK1,ULK1 被磷酸化激活后可促进自噬体形成,以启动自噬(Tian et al.,2015)。现有研究表明(Azimi et al.,2018;MacPherson et al.,2015),运动可以提高AD 模型小鼠脑内AMPK 表达。以上提示,运动作为调节能量的重要干预手段,可通过上调AMPK 激活ULK1,以诱发小鼠海马自噬启动。
3.4 运动可增强APP/PS1小鼠海马溶酶体的降解功能
自噬是一种依赖于溶酶体的降解途径,自噬体与溶酶体的正常融合以及溶酶体正常的降解功能也是限制自噬活性的重要因素。若自噬溶酶体融合降解障碍,即使诱发自噬启动,也不能改善自噬活性,并可能加重自噬体聚集,造成神经元死亡(Mindell,2012)。在生理条件下,溶酶体功能正常,可迅速降解自噬体内包裹的Aβ、线粒体等待降解物,但在AD 病理条件下,溶酶体内过多的Aβ 神经毒性增大,便可破坏溶酶体膜的稳定性,造成溶酶体酶泄露,减少溶酶体内的降解酶含量(Ling et al.,2014)。本研究结果已经表明,APP/PS1 小鼠海马细胞自噬启动并未发生显著变化,这提示,APP/PS1 小鼠海马细胞自噬活性可能与自噬下游的自噬溶酶体融合降解障碍有关。因此,为了验证这一推测,本研究对溶酶体降解酶及自噬溶酶体融合关键蛋白进行了检测。
Cathepsin D 作为溶酶体内重要的水解酶,其正常表达是维持溶酶体降解功能的基础(Koike et al.,2000)。Tian等(2014)表明Aβ 沉积可减少Cathepsin D 的表达,抑制溶酶体降解功能。Song 等(2018)发现,使用富硒酵母可提高3×TgAD 小鼠脑内Cathepsin D 蛋白表达水平,降低P62的表达,减少Aβ 沉积,表明增强溶酶体功能可提高自噬活性改善AD。本实验结果显示,APP/PS1 小鼠海马溶酶体降解酶Cathepsin D 的mRNA 水平显著降低,但其蛋白表达水平未发生显著变化。6 月龄APP/PS1 小鼠海马内的Cathepsin D 基因表达水平降低,提示AD 小鼠海马内的溶酶体降解酶有受损趋势。但本实验并未发现APP/PS1小鼠海马内Cathepsin D 蛋白水平的改变,这可能与小鼠的病程长短有关。Kaur 等(2017)发现,12 月龄的APPE693Q转基因AD 小鼠脑自噬活性下降,神经元凋亡增加,但并未发现Cathepsin D 蛋白表达水平的改变。而随着病程的发展,在24 月龄时自噬溶酶体出现聚集。这提示,6 月龄的APP/PS1 小鼠处于发病早期,Cathepsin D 的蛋白变化不明显,仅出现受损趋势,而随着病情发展至后期,AD 小鼠脑内溶酶体功能损伤加重。本实验结果显示,运动显著提高了APP/PS1 小鼠海马Cathepsin D mRNA 和蛋白表达水平,提示,运动可增加APP/PS1 小鼠海马溶酶体降解酶的含量。此外,运动组C57BL/6 小鼠海马Cathepsin D mRNA 和蛋白表达水平也同样被上调。以上提示,运动可以上调海马溶酶体酶含量,继而增强溶酶体的降解功能。
Rab7 是晚期溶酶体成熟及促进自噬体与溶酶体融合的调控蛋白之一(Wang et al.,2011)。研究发现,C57BL/6小鼠的神经元内Rab7 表达下降,可导致溶酶体功能受损,降低小鼠神经元内自噬活性,并出现类AD 样的神经元肿胀等病理变化(Lee et al.,2011)。Zhang 等(2015)在注射有Aβ42 的SH-SY5Y 细胞中发现,Rab7、Cathepsin D 表达下降,LC3II 表达上调,提示Aβ42 可以损害溶酶体功能,抑制自噬体溶酶体融合。本实验结果显示,APP/PS1 小鼠海马内Rab7 的mRNA 和蛋白表达水平均降低,提示APP/PS1 小鼠海马溶酶体成熟障碍,自噬体与溶酶体融合受阻。而运动显著提高了APP/PS1 小鼠海马内的Rab7 mRNA 和蛋白的表达水平,同样,运动组C57BL/6 小鼠海马Rab7 mRNA 和蛋白的表达水平也被上调,表明运动可促进溶酶体成熟,加快自噬体与溶酶体融合。已有研究也支持了这一发现,Luo 等(2017)发现,利用自噬抑制剂氯喹阻断自噬体和溶酶体融合,可减弱运动提高SD 大鼠海马自噬活性的作用。Zhao 等(2018)发现,6 月龄APP/PS1 小鼠海马内溶酶体膜相关蛋白1(Lysosomal-associated membrane protein 1,Lamp1)表达上调,提示APP/PS1 小鼠海马内溶酶体出现聚集,而为期3 个月的跑台运动显著降低了Lamp1 的表达,表明运动可减少AD 小鼠海马内溶酶体聚集,加快溶酶体的降解速率。以上提示,APP/PS1小鼠海马溶酶体功能受损,是导致细胞自噬活性降低的重要原因。而运动可以通过促进海马内溶酶体的成熟,增加溶酶体降解酶含量,加快自噬体与溶酶体的融合,以增强溶酶体的降解功能。
4 研究结论
6 月龄APP/PS1 小鼠与C57BL/6 小鼠相比,海马Aβ 聚集增加,神经元过度凋亡,学习记忆能力受损,并伴随着海马细胞自噬活性降低。而12 周的跑台运动可以通过激活APP/PS1 小鼠海马细胞自噬启动,并同时增强溶酶体降解功能,以提高APP/PS1 小鼠海马细胞自噬活性,加快自噬溶酶体降解Aβ 速率,继而抑制神经元凋亡,起到预防和改善AD 的作用。

