绿色木霉对花生黄曲霉毒素污染的防治
徐杨玉,刘付香,洪彦彬,陈小平,李海芬,温世杰,李杏瑜,周桂元,梁炫强
(1.广东省农业科学院 作物研究所,广州 510640;2.广东农垦热带农业研究院有限公司, 广州 511365;3.广东省中山市实验中学,广东 中山 528404)
20世纪60年代,英国报道的10万只火鸡中毒事件,让人们第一次认识到了黄曲霉毒素(Aflatoxins,AFT)的严重危害。近年来,国内外学者对AFT开展了大量深入而广泛的研究,发现AFT是由曲霉属真菌(Aspergillus)特别是黄曲霉(A.flavus)和寄生曲霉(A.parasiticus)分泌的一类以二呋喃香豆素为基本构成的次级代谢产物[1],同时特异曲霉(Aspergillusnomius)、假溜曲霉(Aspergilluspseudotamarii)、Aspergillusbombycis、Emericellaastellata等其他曲霉真菌同样可以产生AFT[2-6]。黄曲霉具有繁殖速度快、孢子数量庞大以及传播远等特点,因此粮食等农作物在种植、收获、贮藏和加工过程中极易受到AFT污染。花生是我国主要的油料作物和经济作物,受高温高湿多雨气候影响,极易感染黄曲霉,导致AFT污染,严重影响到花生的品质、风味、外观及食用安全等,对人和动物具有很强的致癌作用[7]。AFT污染已成为全球花生产业发展的主要限制因子,是国内外学者关注和研究的重点课题。近年来,全球加大对AFT预防和控制力度,并制定和实施了严格的安全限量标准。解决花生AFT污染的方法包括田间管理、病虫害控制及物理化学生物去毒方法等[8-9], 其中,生物防治AFT污染较物理、化学等方法具有安全系数高、特异性强、绿色清洁等独特优势,被视为最具发展前景和潜力的降解方法[10]。 AFT的生物防治主要以微生物、植物或其产生的代谢物为研究对象, 筛选多种微生物及药用植物达到降解AFT的目的[11]。其中,以具有生物防治潜力的木霉属(Trichodermaspp.)真菌为典型代表,如哈茨木霉(T.harzianum)、绿色木霉(T.viride)、康氏木霉(T.koningii)、钩木霉(T.hamatum)以及长枝木霉(T.longibrachiatum)等[12]。据不完全统计,木霉菌至少对18属29种植物病原真菌有拮抗作用[13]。本研究旨在通过分析生防真菌绿色木霉(T.viride)对花生黄曲霉的抑菌活性以及AFT污染的降解活性,为研究其活性物质的抗菌机制以及大田生产中防治花生AFT污染提供理论依据。
1 材料与方法
1.1 供试菌株与植物供试花生(ArachishypogaeaL.)‘粤油7号’(感黄曲霉品种)、绿色木霉(Trichodermaviride)均由广东省农业科学院作物研究所花生室提供;黄曲霉(AspergillusflavusL.)菌株GIM3.17 引自中国科学院微生物研究所,该菌株侵染能力和产毒能力均较强。
1.2 试剂与试剂盒Tween20、氯仿、甲醇、丙酮以及三氯甲烷等试剂均为进口分装或国产分析纯试剂。AFB1标准品(Invitrogen) 、黄曲霉毒素B1含量测定酶联免疫定量测试盒(ELISA KIT)购自江苏省微生物研究所。
1.3 常用溶液与培养基PD液体培养基(PDA 固体培养基另加琼脂15 g·L-1)∶200 g·L-1马铃薯、 20 g·L-1葡萄糖,加ddH2O,pH6.8,115 ℃高压灭菌20 min。PBS缓存液∶15 g十二水磷酸氢二钠、1 g 磷酸氢二钾、40 g氯化钠、1 g 氯化钾,定容至5 L,pH 7.0。
1.4 平皿拮抗作用-两点对峙培养法将绿色木霉和黄曲霉菌种在PDA培养基中28 ℃条件下培养7 d,分别吸取5 mL 0.05%的Tween20溶液,加入到2个培养菌种的斜面中,充分振荡,用灭菌滤纸过滤到2个50 mL高压灭菌的三角瓶中,血球计数板计数,将孢子悬浮液稀释到1.0×105mL-1,做好标记,放入4 ℃冰箱保存备用。将相同数目的绿色木霉孢子和黄曲霉孢子使用点接种法接种于同一PDA平板中,两者相距2 cm,置于28 ℃下进行对峙培养,每天观察记录结果,并测量拮抗带宽度。
1.5 不同培养时间的绿色木霉发酵液抑制黄曲霉活性的影响将绿色木霉单菌落接种到10 mL新鲜的PD液体培养基中,28 ℃,200 r·min-1活化24 h,将活化的菌液全部接种于1 L PD液体培养基中,28 ℃,200 r·min-1振荡培养,分别培养1 ,2 ,3 ,4 ,5,6 ,7,8 d,取出1 mL于1.5 mL离心管中10 000 g离心15 min,保留上清液,用无菌过滤器抽滤灭菌,测定其对黄曲霉的抑菌活性:将1 μL黄曲霉孢子(3.6×106mL-1)涂布于PDA平板中,28 ℃培养1 d后,孔中加入100 μL无菌绿色木霉发酵液(简称发酵液,下同),28 ℃培养4 d后,测定抑菌圈直径。
1.6 不同培养浓度的绿色木霉发酵液抑制黄曲霉产毒效果的影响将绿色木霉菌株接种到新鲜的PD液体培养基中,每个250 mL三角瓶中装有50 mL培养基,接种量为4×104mL-1孢子培养基,28 ℃,200 r·min-1振荡培养7 d后,4 ℃,10 000 g 离心15 min,取上清液,再用无菌过滤器抽滤灭菌,真空冷冻浓缩100倍后,将其与无菌水配成终浓度为0.5 %,10 %,30 %,50 %和80 %的悬液,4 ℃保存备用。
取上述不同浓度的悬液和pH7.0,50 mmol·L-1Na2HPO4-NaH2PO4缓冲液(PBS)各5 mL,分别与20 mL黄曲霉(1 d液体培养物)混合,28 ℃,200 r·min-1振荡培养7 d后,参照ELISA-Kit试剂盒说明书提取毒素进行测定。通过检测黄曲霉毒素残余量,分析不同培养浓度发酵液抑制黄曲霉产毒的效果。
1.7 绿色木霉发酵液对花生收获前黄曲霉污染的影响花生种子常规消毒后,盆栽于大田,荚果生长后期将植株移回温室大棚,并对其进行干旱胁迫处理以及干旱胁迫和黄曲霉人工接种处理。
(1)黄曲霉孢子溶液的制备:黄曲霉菌株制备成孢子浓度为4×106mL-1的溶液,接种于PDA 培养基上,置于28 ℃培养箱下黑暗培养2周。
(2)黄曲霉侵染载体的制备:将上述培养的黄曲霉人工接种在玉米颗粒上,加入适当水分,28 ℃暗培养,直到玉米颗粒完全被黄曲霉侵染,以此作为花生的侵染材料。
(3)将黄曲霉孢子接种于花生的种植土壤中,孢子接种量为6×1010个·株,并干旱处理2周后,分别将不同浓度的发酵液喷洒于已接种黄曲霉的花生种植土壤中,每株花生喷洒100 mL,隔5 d 喷洒1次,对照组则喷洒相同体积的无菌水,每个处理组和对照组均设置3个重复。处理2周后,将花生收获、晒干,检测AFB1含量;同时采取土样,检测土壤中黄曲霉种群数。
1.8 薄层层析法定性测定绿色木霉发酵液对AFB1的降解效果取上述浓度为5%的发酵悬液、等体积pH7.0,50 mmol·L-1PBS缓冲液与1 mL浓度为60 ng·mL-1的AFB1标准品混合,28 ℃恒温箱中放置5 h后,加入等体积氯仿抽提毒素,真空干燥后,加入1 mL甲醇水(1∶1)溶解抽提物。将实验组和对照组的抽提物各取1 μL点在薄层层析板上,以丙酮-三氯甲烷(8+92)作为扩展剂,展开10~12 cm,取出,在紫外灯下观察结果。
2 结果与分析
2.1 平皿拮抗作用-两点对峙培养法PDA平板在28 ℃恒温下静置培养8 d,每天观察记录的结果见图1。由图1可见,绿色木霉对黄曲霉的拮抗作用很强,对峙培养第3 天即可见拮抗效果,且随着培养天数的增加,拮抗活性越强,绿色木霉向黄曲霉扩张逐渐形成包围趋势,测量拮抗带宽度为5.5 mm。
2.2 不同培养时间的绿色木霉发酵液对抑制黄曲霉活性的影响取不同培养时间的发酵液,测定其对黄曲霉的抑菌活性,规定抑菌活性最强的相对抑制率为1。结果(图2)表明,绿色木霉发酵液抑菌活性随着培养时间的延长而增强,培养至第7天达到最强,以后抑菌活性几乎没有变化。
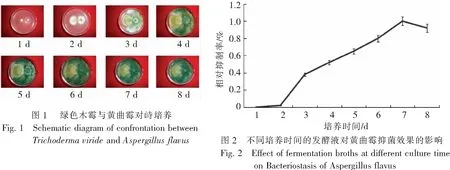
2.3 不同培养浓度的绿色木霉发酵液对抑制黄曲霉产毒效果的影响取培养时间为7 d的发酵液,用无菌水配制成0.5 %,1 %,3 %,5 %和8 %共5个不同浓度的悬液,分别取上述不同浓度的悬液及pH7.0,
50 mmol·L-1PBS缓冲液各5 mL,分别与20 mL黄曲霉(1 d液体培养物)混合,28 ℃,200 r·min-1振荡培养7 d后,用ELISA-Kit试剂盒测定毒素残余量。结果(图3)表明,与对照组相比,随着发酵液浓度的升高,毒素残余量降低,直至发酵液浓度为5 %时,毒素残量达到最低值,此后,随发酵液浓度升高,毒素残量基本没变化。结果表明,绿色木霉发酵液具有抑制黄曲霉产毒的效果,可能是通过抑制黄曲霉生长,导致黄曲霉毒素产出减少。
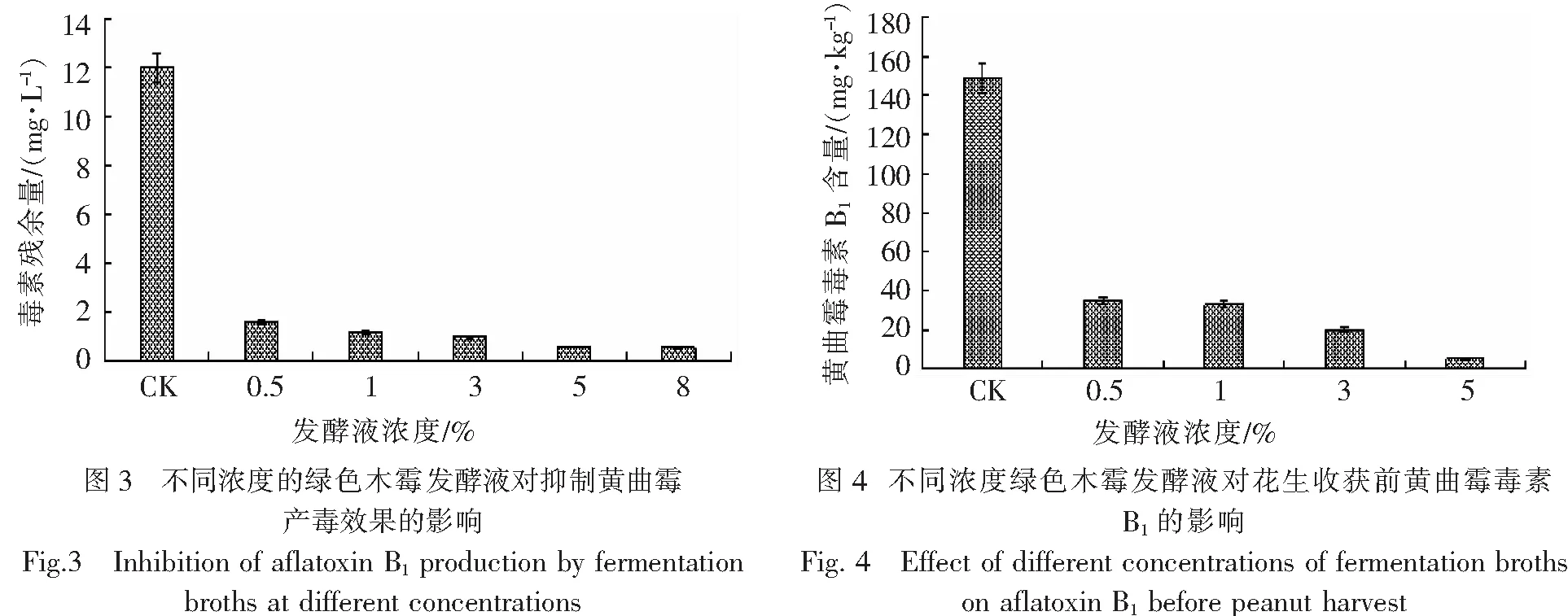
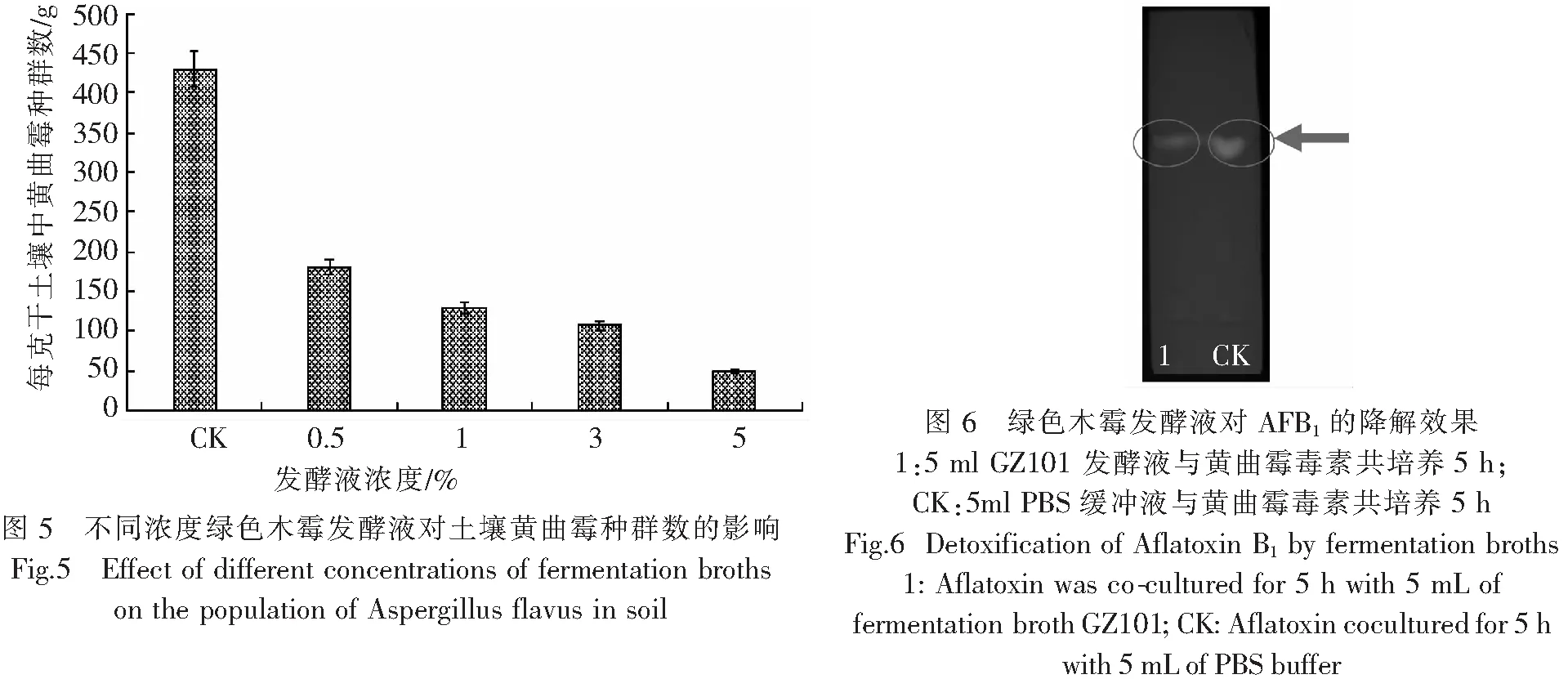
2.4 不同浓度绿色木霉发酵液对花生收获前黄曲霉污染的影响将黄曲霉孢子接种于花生种植土壤中,孢子接种量为6×1010个·株,干旱处理2周后,将不同浓度的发酵液分别喷洒于已接种黄曲霉的花生种植土壤中,每株花生喷洒100 mL,隔5 d喷洒1次,对照组则喷洒相同体积的无菌水,每个处理组和对照组均设置3个重复。处理2周后,将花生收获,晒干,检测AFB1含量;同时采取土样,检测土壤中黄曲霉种群数。结果(图4,5)表明,该发酵液能有效降低花生收获前黄曲霉毒素污染,降低率达97%,同时能较大程度地抑制土壤中黄曲霉菌的生长,且发酵液浓度越高,抑制效果越佳。
2.5 薄层层析法定性测定发酵液对AFB1的降解效果薄层层析定性检测发酵液对AFB1的降解作用,结果(图6)表明,发酵液对AFB1的降解作用明显,与对照组相比,毒素残余量明显降低,说明发酵液能有效降解AFB1。
3 讨 论
3.1 木霉菌生防作用绿色木霉是木霉菌中具有重要经济意义的一种,对植物致病真菌具有拮抗作用,据报道,木霉可抑制约29种植物病源真菌,其中研究最多的是灰霉菌、腐霉菌、丝核菌、炭疽菌和镰刀菌[14-15]。国内近几年利用木霉在许多病害上做了大量试验,防治效果明显[16]。黄曲霉真菌广泛存在于土壤中,其孢子可扩散至空气中传播,化学防治难度较大。本试验研究表明,绿色木霉菌株对黄曲霉具有明显的拮抗作用,说明该菌是一种较强的广谱性拮抗真菌,因而在花生黄曲霉病的生物防治中具有广阔的开发应用前景。
3.2 木霉抗菌机理木霉菌是一种资源丰富的拮抗微生物,在植病生防中具有重要的、不可忽视的作用。其抗菌机制包括产生抗生素、重寄生作用、溶菌作用以及竞争作用(主要为对生存空间和营养的竞争)。本研究结果表明,在平皿对峙培养中,绿色木霉菌可以抑制花生黄曲霉菌落的生长,表现为:(1)产生抑菌带;(2)营养竞争作用,即覆盖或深入花生黄曲霉菌落中生长,占领大部分营养空间。
在抗生作用中,木霉可以产生拮抗性化学物质来毒害植物病原真菌,这些物质包括抗生素和一些酶类。Brukner 等[17]从绿色木霉分离提纯了1组特殊的抗菌肽,分别为trichobrachin 和trichovirin。Sonia 等[18]研究发现绿色木霉能产生可挥发性的次级代谢产物,通过这种物质影响其他真菌的蛋白质合成和生长速度的方式,从而起到抑菌作用。本研究结果表明,绿色木霉发酵液中可能含有抗菌活性物质,能显著抑制黄曲霉,导致产毒能力降低。大田试验结果表明,该发酵液能显著降低花生收获前黄曲霉毒素污染,降低率达97%,同时能较大程度地抑制土壤中黄曲霉的生长,这与Brukner 等[17]、Sonia 等[18]的结果相一致。
3.3 生防制剂AFT的生物脱毒主要采用微生物和微生物产生的酶来进行,多种微生物,包括细菌、放线菌、酵母菌、霉菌和藻类都能或多或少降解AFT,AFT解毒酶是目前降解效果较好的一类酶[19],但该酶的产量较低,限制了其在生产上的广泛应用。绿色木霉发酵液能显著抑制AFB1的产生,抑制率达95%,因此,绿色木霉发酵液具有大田生产中防治花生AFT污染的潜力,抑制效果优胜于同类生防制剂。
3.4 薄层层析法与ELISA薄层层析法、酶联免疫吸附法测定黄曲霉毒素残余量是食品中最常用的鉴定方法,薄层层析法具有直观、成本低廉等优点,而酶联免疫法则具有快速、精确等优点,本实验将2种方法结合起来检测黄曲霉毒素B1的残余量,使实验结果更具可靠性。
研究结果表明,生防真菌绿色木霉对花生黄曲霉具有拮抗作用,其发酵液能够抑制黄曲霉生长及降解黄曲霉毒素,并且能降解AFT污染。该发酵液中可能含有抗菌活性物质,可进一步研究其抗菌机制,为在大田生产中防治花生AFT的污染提供理论依据。

