一株锌抗性菌株强化印度芥菜修复锌污染土壤的可行性研究
杜宪正,王 涛,邹路易,郁红艳,张海利,滕 跃
(江南大学 环境与土木工程学院,江苏 无锡 214122)
随着工业农业生产规模的不断扩大,土壤重金属污染日益严重。锌是动植物生长发育所必需的微量元素,但是土壤中锌含量过多时,会在食物链中积累、迁移和传递,最终会对人体健康带来极大威胁[1-2]。目前,传统的污染土壤修复技术如客土法、土壤淋洗、电动修复、电热修复、稳定化/固化等,不但治理费用高,还严重破坏土壤结构,易引起土壤肥力下降,治理过程中使用的化学试剂可能导致土壤二次污染。而通过植物(特别是超积累植物)结合相关微生物从污染环境中吸收、富集和转移重金属,从而降低环境中污染重金属的浓度的生物修复技术,是一种投资少、成本低、不引起二次污染、可美化景观的新兴技术,逐渐成为国内外研究的热点[3]。
迄今为止,国外已发现的锌超积累植物达20余种,国内也发现东南景天、黑麦草、木贼、香附子及蓖麻、印度芥菜等锌超富集植物[4-5]。但是这些已发现的重金属超积累植物由于生长周期长、生物量小等因素,严重限制了它们用于工程修复重金属污染土壤的潜力[6]。研究发现,根际微生物一方面可以为植物生长提供生长所需的营养元素以促进植物生长,如一些根际促生菌(PGPR)具有固氮、溶磷、解钾的作用,可以保证植物在污染环境中生长发育所需营养物质的供给[7];另一方面,根际微生物可以通过自身分泌物土壤环境中重金属提高锌在土壤中的活性和生物有效性,促进植物对锌的吸收和富集[8]。同时,根际微生物还具有固氮、溶磷、供铁及增强植物激素产生的能力,从而为植物生长提供所需的营养物质,直接影响植物的代谢过程[9]。当前学术界应用根际促生菌联合超积累植物修复Cd 等重金属污染土壤的研究较多,并取得很好的治理效果[10-11]。然而,有关根际微生物与植物联合修复重金属Zn 污染土壤的研究相对较少。本文通过锌抗性菌株微紫青霉菌Penicillium janthinellum BC109-2对难溶态锌的溶解能力和植物促生能力进行评价,并结合印度芥菜对锌污染土壤进行修复效果研究,评价其潜在应用效果。
1 材料与方法
1.1 供试材料
1.1.1 供试菌株及保存条件 本试验选用本课题组从土壤中分离纯化得到的锌抗性菌株微紫青霉菌BC109-2(Genbank 登录号:KX891188)作为实验用菌株;菌株BC109-2 保存在含有5 mM ZnSO4·7H2O 的马铃薯葡萄糖琼脂(PDA)培养基中。CAS:购自上海阿拉丁生化科技股份有限公司。印度芥菜种子:购自武汉安谷科技有限公司。
1.1.2 主要试剂和培养基 1-氨基环丙烷羧酸(ACC)和吲哚乙酸(IAA)购自上海阿拉丁生化科技股份有限公司。
金属离子贮藏液:8.61 g ZnSO4·7H2O 溶于1 L超纯水中制成30 mmol/L 的贮藏液,用0.22 μm 的滤膜过滤后保存在4 ℃冰箱中保存,实验中经过灭菌后加入培养基中并使之达到所设计的浓度。
CAS 蓝色检测液按照文献[12]的方法配制。
马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂15~20 g,超纯水1 000 mL,自然pH,1×105Pa 灭菌20 min。PDB 培养基即为不加琼脂的PDA 培养基。
DF 培养基按照文献[13]的方法配制。在经过高温灭菌的DF 液体培养基中,准确加入终浓度为3.0 mmol L-1 的ACC(1-氨基环丙烷-1-羧酸)即为ADF 培养基。
PKO 培养基[14]:葡萄糖10.0 g,(NH4)2SO40.5 g,MgSO4·7H2O 0.3 g,NaCl 0.3 g,KCl 0.3 g,FeSO4·7H2O 0.036 g,MnSO4·4H2O 0.03 g,Ca3(PO4)32.0 g,总体积1 000 mL,pH 7.0。
SA 液体培养基配方:蔗糖20.0 g,L-天门冬酰胺2.0 g,K2HPO40.5 g,MgSO4·7H2O 0.5 g;pH 7.0。
1.2 实验方法
1.2.1 锌抗性菌株对难溶性锌的溶解作用 将供试菌株转接到含难溶性ZnCO3的PDB 培养基(1 000 mg/L ZnCO3)中,30 ℃,摇床振荡培养72 h,每隔18 h 取一次样,10 000 r/min 离心5 min,测定上清液中的锌含量及溶液pH。
1.2.2 菌株BC109-2 的促生特性研究
1)检测菌株利用氨基环丙烷羧酸(ACC)作为唯一氮源的能力。
将微生物菌株于含有不同浓度Zn2+(0,1,2,3 mmol/L)的ADF 培养基中,28 ℃培养24 h 诱导其产生ACC 脱氨酶,离心洗涤后破碎细胞得粗酶液,每个浓度做3 组重复试验。菌株ACC 脱氨酶活性参照龚凤娟和张宇凤的方法[15]测定α-酮丁酸在540 nm处吸光度值。粗酶液中总蛋白质含量用考马斯亮蓝蛋白试剂盒测定。将每分钟形成1 μmol α-丁酮酸的量定义为1 个酶活力单位。
2)吲哚乙酸(IAA)的产生能力测定。
将菌株接种到添加了0.5 mg/mL L-色氨酸以及不同浓度Zn2+(0,1,2,3 mmol/L)的PDB 液体培养基中28 ℃摇床震荡培养48 h,每个浓度做3 组重复试验[16],对照组不接种菌株。取2 mL 菌液,10 000 r/min 离心15 min,准确移取2 mL Salkowski试剂[17](0.5 mol/L FeCl3溶液10 mL、35%高氯酸500 mL,于使用前混合摇匀,避光保存)加入到1 mL 上清液中,于暗处显色30 min,测定波长530 nm 处的吸光度值。配制纯IAA 溶液(质量浓度梯度为0、7、14、21、28、35 ug/mL)测定对应波长下的吸光值,绘制标准曲线,计算不同Zn2+浓度下微生物的IAA 产生量。
3)铁载体产生量测定。
菌株铁载体产生量采用通用CAS 检测法[18]测定。将新鲜菌种于限铁SA 液体培养基中,28 ℃摇床培养(150 r/min)48 h,对照组接种相同量的死菌;菌悬液经10 000 r/min 离心15 min 取3 mL 上清液,将菌液和CAS 检测液1∶1 的体积充分混匀,1 h 后测定630 nm 处的吸光度(A),另取3 mL 对照组的培养基上清液加入到3 mL CAS 蓝色检测液中,测得吸光值作为参比值(Ar),A/Ar的比值作为定量指标。
4)溶磷能力测定。
取1 mL 菌悬液接种于含有不同浓度Zn2+(0,1,2,3 mmol/L)的PKO 液体培养基中,置28 ℃摇床(150 r/min)振荡培养48 h,以死菌菌悬液作为对照实验,每个浓度做3 组重复试验。采用钼锑抗比色法[19-20]定量测定微紫青霉菌BC109-2 的溶磷能力,取2 mL 培养液1 500 r/min 离心后取上清液加入20 mL NaHCO3浸提剂及一勺无磷活性炭粉,摇床振荡30 min 充分浸提,过滤后取10 mL 滤液加入35 mL 蒸馏水及5 mL 钼锑抗试剂,混匀,室温静置30 min,测定700 nm 处吸光度。
1.2.3 根伸长实验 将种子浸在乙醇∶30% H2O2(1∶1)溶液中消毒15 min,后用蒸馏水洗涤两次。根伸长实验根据Patten C L 所描述的方法[21]在滤纸上进行。菌种在含有0.5 mg/mL 色氨酸的LB 培养基中28 ℃,150 r/min 培养24 h,离心收集菌体后将0.1 mL OD600为0.2 的菌体培养液悬于9.9 mL 无菌生理盐水中制成细胞悬液(约2.0×108CFU mL-1)加入滤纸上。放种子之前,不同浓度Zn2+以ZnSO4·7H2O形态(0,1,2,3 mmol/L)加到滤纸上。每天加水保持滤纸湿润,室温黑暗条件下培养5 d 后测量种子根伸长量。
1.2.4 印度芥菜与抗锌菌株联合修复锌污染土壤试验
1)土壤染毒处理。
供试土壤取自江苏省无锡市15 cm 深的花园土,经过风干,研磨过2 mm 筛,然后121 ℃高压灭菌锅内灭菌15 min,土壤背景值如表1 所示。
土壤染毒处理根据文献[11]操作。灭菌后的土壤风干后做5 种处理:分别外加0、2、4、8、16 mmol/kg ZnSO4·7H2O 溶液,搅拌混合均匀,放置约一个月,使金属稳定,期间保持土壤湿润,含水率在60%左右。

表1 花园土的理化性质Table 1 Physical and chemical properties of garden soil
2)盆栽试验。
将印度芥菜种子浸在乙醇∶30% H2O2(1∶1)溶液中消毒15 min,后用蒸馏水洗涤两次备用。试验均采用外口直径18 cm,内口直径15.5 cm,高11 cm的花盆种植印度芥菜。每盆装入处理后风干的土壤2 kg,播种前,每种浓度土壤做接种菌和不接种菌两种处理,共10 种处理,每种处理做3 组重复,使形成106cfu/g 的土壤。每盆播种经过消毒处理的饱满的印度芥菜种子10 粒,出苗后2、4、6 周再各接种一次相同浓度菌悬液,培养期间,用稀释后的化肥施肥。生长8 周后收获植物,洗涤干净,分为根和茎两部分,80 ℃条件下烘箱烘24 h 至恒重,酸4∶1(HNO3∶HClO4)消解后用火焰原子吸收法测锌含量。结果表示为μg/g 植物干重。
1.2.5 数据统计与分析 用SPSS 23.0 软件进行统计分析及差异显著性检验,然后用origin 9.0 作图。
2 结果与讨论
2.1 锌抗性菌株对难溶性锌的溶解作用
根际微生物从土壤中和植物分泌物中获取营养物质,并通过其自身的代谢产物,如有机酸、氨基酸等促进土壤重金属的溶解[22],提高土壤重金属有效性,促进植物吸收和富集,从而减少土壤中的重金属。
图1 为锌抗性菌株BC109-2 对难溶态重金属的溶解性,可以看出菌株BC109-2 在培养18 h 时,培养基中可溶性锌含量有所降低,可能是由于细胞对Zn 的吸附作用从而暂时降低了培养液中可溶性锌含量;18 h 后随着细胞数量的增多,菌株代谢能力增强,培养液中可溶性锌含量逐渐增加;并在培养时间达到54~72 h 时,培养液中可溶性锌含量增加的趋势开始减缓。培养时间达到72 h 时,与接种灭活菌的对照组相比,接种菌株BC109-2 的培养液中可溶性锌含量增加了213%,同时菌株BC109-2降低了培养液中的pH,由最初的7.0 下降到了5.7,文献[23]也发现内生菌可以通过产有机酸酸化土壤环境,活化土壤中的重金属,提高其生物有效性,从而促进植物对重金属的提取效率。菌株BC109-2 的培养液pH 降低说明其对锌的活化作用主要是由代谢产酸引起的,因此该菌株对难溶态锌具有较强的溶解能力。

图1 菌株BC109-2 对碱式碳酸锌的促溶作用Fig.1 Solubilization of ZnCO3 by strain BC109-2
2.2 菌株BC109-2 的促生特性
大量研究结果表明,植物体内及根际土壤存在一些可以促进植物生长的促生菌,它们能够产生促植物生长激素吲哚乙酸(IAA)[24],1-氨基环丙烷-1-羧酸(ACC)脱氨酶和铁载体等物质[25],降低土壤中重金属对植物的毒害作用,刺激植物根系的发育,促进植物的生长,从而增强植物对土壤中重金属的富集效率[26]。
由表2 可知,菌株BC109-2 在不同锌浓度下均具有ACC 脱氨酶活性,且随着锌浓度升高活力逐渐降低,培养基中无锌存在时,酶活力最大为0.58 U/mg pro。该菌株具有分泌植物生长素的能力,但能够产生生长素的量不大,其中在培养环境中锌浓度为1 mmol/L 时产生量最大为1.504 mg/L。而文献[27]筛选出的16 株菌株IAA 产量在0.78~30.48 mg/L之间,与已报道的产IAA 菌株相比,菌株BC109-2的产IAA 能力相对较弱。此外,菌株BC109-2 具有铁载体产生能力,且在锌浓度为0 的培养基中铁载体产生能力达到2+水平。菌株BC109-2 在含有不同浓度锌的PKO 培养基中溶磷能力差异较小,且在不含锌的PKO 培养基中溶磷量达到最大值0.487 8 ug/mL。由此可见,锌抗性菌株BC109-2 是一株能够为植物提供矿质营养元素,同时能分泌植物激素、合成特异性酶的促生菌,其表现出的促生特性有可能促进印度芥菜根系的生长和植株的发育,为其联合印度芥菜修复锌污染土壤提供了依据。

表2 不同锌浓度下菌株BC109-2 的促生特性Table 2 Promoting characteristics of the strain BC109-2 under different zinc concentrations
2.3 锌抗性菌株对印度芥菜根伸长量的影响
在一般情况下,根伸长有助于提高植物富集土壤中重金属的能力。根伸长量是植物根际促生菌(PGPR)的重要指标[28]。图2 为不同锌浓度下是否接种微生物菌株对印度芥菜种子5 d 的根伸长量的影响。在没有接种菌株的情况下,随着锌浓度的不断增加,培养5 d 后,印度芥菜种子根伸长量逐渐降低,表明重金属锌胁迫对植物生长有一定的抑制作用,且锌浓度越高该抑制作用越强,这也与文献[29]和文献[30]的研究结果一致。
在接种根际促生菌BC109-2 后,与对照组相比,接种菌株BC109-2 的印度芥菜种子根伸长量在不同锌浓度(0,1,2,3 mmol/L)下分别增加了9.3%、4.14%、44.83%和9.78%,这说明根际促生菌BC109-2 可以促进印度芥菜种子的根伸长量,并且在锌污染的胁迫下该菌株也可以缓解锌对印度芥菜根伸长的抑制作用。
锌抗性菌株菌株BC109-2 在锌污染胁迫下能够产生IAA,而IAA 对诱导植物细胞的增殖与分化具有重要作用[31],因而接种根际促生菌的印度芥菜种子的根伸长量比对照组明显,这不仅可以提高印度芥菜对营养物质的吸收效率,也可以促进印度芥菜对土壤中重金属锌的富集与吸收。
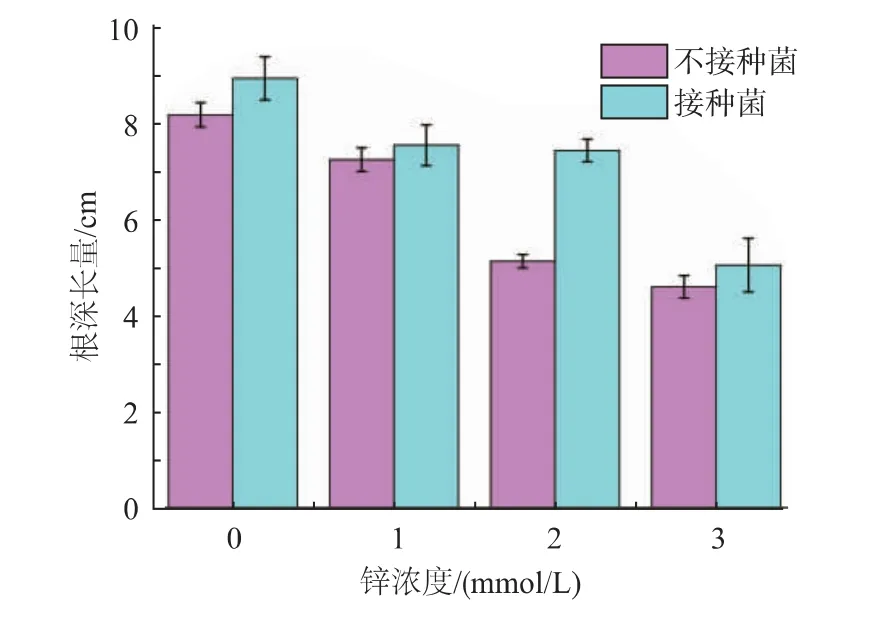
图2 不同锌浓度下印度芥菜种子5 d 的根伸长量Fig.2 Root lengths of Indian mustard cultivated in the absence or presence of zinc at various concentrations after germination for 5 d
2.4 锌抗性菌株BC109-2 联合印度芥菜修复锌污染土壤效果研究
采用温室盆栽实验观察锌抗性菌株BC109-2联合印度芥菜修复锌污染土壤的效果,结果如表3所示。结果显示,5 组实验接种根际促生菌的地上部分(茎)干重与对照组相比分别增加了14.89%、12.90%、10.17%、11.37%和32.26%,地下部分(根)则分别增加了18.18%、65.60%、3.77%、0.13%和44.24%,说明菌株BC109-2 能够促进印度芥菜干生物量的增加。
不接种菌株BC109-2 时,印度芥菜富集土壤中重金属锌的结果显示地上部分(茎)Zn 含量远远高于地下部分(根),说明印度芥菜富集的锌大部分集中于地上部分。接种菌株后,印度芥菜地上部分和地下部分锌含量均有不同程度增加,这可能是因为菌株BC109-2 使印度芥菜生物量有所增加,从而使印度芥菜增富集污染土壤中重金属锌的量增加[32]。
另外,接种根际促生菌BC109-2 之后,与未接种的对照组相比,接种了促生菌的整株印度芥菜所富集的锌含量分别是对照组的1.10、1.24、1.02、1.16和1.14 倍,说明了菌株BC109-2 对提高印度芥菜富集土壤中的锌有明显的促进作用。一般来说,植物根际促生菌具有溶磷作用,能产生IAA 和铁载体,具有ACC 脱氨酶活性,降低植株体内乙烯的生成,提高植物对锌的抗逆性[33]。菌株BC109-2 的促生实验和盆栽试验结果也证明了该菌株能够促进印度芥菜对铁、磷的同化作用,促进印度芥菜的生物量增加和对土壤中锌的富集。

表3 锌污染土壤中印度芥菜生长实验Table 3 Growth of Indian mustard planted in zinc-contaminated soil
3 结语
本研究对从土壤中筛选纯化得到的锌抗性菌株BC109-2 进行了促生特性研究,得出以下结论:1)在PDB 培养基(含1 000 mg/L ZnCO3)中培养72 h 后,菌株BC109-2 能使培养基上清液中锌浓度增加了213%,培养液的pH 由初始的7.0 降低到5.7;说明该菌株对难溶态锌具有较强的溶解能力,且该溶解性是由代谢产酸引起的;2)该菌株能产IAA 和铁载体,并且具有ACC 脱氨酶活性和溶磷能力,充分表明菌株BC109-2 是一株根际促生菌;3)种子根伸长量实验和盆栽试验结果表明,根际促生菌BC109-2 能促进植物根系伸长,伸长率在4.14%~44.83%之间,同时使印度芥菜生物量得到不同程度的增加;4)盆栽实验结果表明,接种根际促生菌BC109-2 的印度芥菜对土壤中锌的富集量提升了1.02~1.24 倍不等,说明了根际促生菌BC109-2 可以增加印度芥菜提取土壤中锌的效率。
根际促生菌BC109-2 促进植物吸收土壤中重金属的机理还不清楚,对于根际微生物的作用机理以及重金属生物有效性的影响因子等理论问题还有待进一步研究,从而为重金属污染土壤的植物与微生物联合修复研究提供理论支撑。

