Q61R和V112A突变的HRAS基因在NIH小鼠体内诱发肿瘤的实验研究
张 峰,赵 龙,樊金萍吴雪伶孟淑芳*
(1.中国食品药品检定研究院,北京 100050;2.包头市肿瘤医院,内蒙古 包头 014030)
肿瘤细胞基因组DNA及其片段可在体外试验中转化NIH 3T3细胞,使其获得体内致瘤能力,肿瘤细胞基因组DNA中具有转化能力的基因被称为癌基因。HRAS属于RAS基因家族(包括HRAS、KRAS和NRAS),通过与GTP/GDP结合,RAS蛋白作为分子开关调节与细胞存活和增殖相关的RAF-MEK-ERK、PI3K/AKT等信号传导通路,HRAS突变与多种肿瘤的发生密切相关[1]。体内外试验中,虽然Q61L突变的HRAS(T24-HRAS)可在转基因动物中诱发尿路上皮癌[2],但正常HRAS基因需要其他癌基因(如SV40的大T抗原或cMYC基因)的辅助才能转化细胞[3]。2008年,Li等使用分别表达T24-HRAS和cMYC的混合质粒首次在NIH小鼠中诱发皮肤肿瘤,剂量为每只12.5μg时,肿瘤发生率分别为20%(成年小鼠)和82%(乳鼠)。使用同时表达T24-HRAS和cMYC的单一质粒,肿瘤发生率提高至40%(成年小鼠)和100%(乳鼠)。进一步研究中,使用NK细胞和T细胞缺陷的CD3ε小鼠替代NIH小鼠,成年小鼠中的致瘤率提高至75%,最低致瘤剂量降低至每只800 pg[4-6]。但截至目前尚没有使用单一的HRAS表达质粒在小鼠体内试验中诱发肿瘤的报道。本研究尝试使用含有G12C、G13C、Q61R和G12C/G13C/Q61R突变的HRAS(V112A)表达质粒通过皮内注射在NIH小鼠体内诱发肿瘤。
1 材料与方法
1.1 细胞株、动物和主要材料
人结肠癌DiFi细胞和L929小鼠成纤维瘤细胞由中国食品药品检定研究院细胞室提供;SPF级NIH小鼠由中国食品药品检定研究院试验动物繁育中心提供;HRAS基因由DiFi细胞中扩增,经测序,其含有V112A突变,将其命名为HRAS(V112A);pCDNA3.1(+)质粒由本室保存;鼠抗人HRAS抗体和鼠抗GAPDH抗体购自中杉金桥公司;引物(表1)由上海生物工程技术有限公司合成;Trizol、Lipofectamine 2000和逆转录试剂盒(Superscript First-Strand Synthesis System)购自Invitrogen公司;pMD-18-T载体、2×Primer Start Premix购自Takara公司;质粒大提试剂盒购自Gibco公司。

表1 研究中使用的引物
1.2 HRAS(V112A)的克隆
Trizol提取DiFi细胞总RNA,按照逆转录试剂盒说明书操作,随机引物逆转录合成cDNA。以合成的cDNA为模板,以HRAS-NheⅠ-F+HRAS-R1引物和HRAS-F1+HRAS-Hin dⅢ-R引物分别扩增HRAS(V112A)的1~440 nt片段和44~570 nt片段,切胶回收PCR产物并混合作为模板,以HRAS-NheⅠ-F和HRAS-Hin d Ⅲ-R 引物扩增全长 HRAS(V112A)(570 bp)。NheⅠ和Hin d Ⅲ双酶切PCR产物及pCDNA3.1(+)质粒,4℃过夜连接,转化大肠杆菌DH5α,挑取重组质粒测序,获得pC-HRAS(V112A)重组质粒。
1.3 HRAS(V112A)定点突变
按照文献方法[7],采用定点突变PCR方法,对HRAS(V112A)的12、13和61位密码子分别进行G12C、G13C和Q61R点突变及3个位点联合突变。简要描述如下:①配制50μL突变体系,含1μL pC-HRAS(V112A)、2 pmol混合突变引物(针对突变位点的正/反向突变引物,如:RM-G12C-F和RM-G12C-R各1 pmol混合)、25 μL 2×Primer Start Premix。②突变PCR。95℃变性5 min;95℃变性30 s,60℃退火30 s,72℃扩增12 min,25个循环;72℃延伸10 min。③模板质粒降解,PCR产物中加入1μL Dpn I酶37℃消化过夜。④突变质粒转化。消化产物转化DH5α,挑克隆测序,根据测序结果选取在目的位置含有设计突变的克隆,根据突变类型,将质粒分别命名为 pC-HRAS(V112A/G12C)、 pC-HRAS(V112A/G13C)、pC-HRAS(V112A/Q61R)和 pC-HRAS(V112A/G12C/G13C/Q61R)。
1.4 Western blot检测HRAS(V112A)及其突变体表达
按照说明书操作,各质粒使用Lipofectamine 2000瞬时转染6孔板中的L929细胞,转染后48 h刮取细胞并使用预冷PBS洗涤细胞2遍后重悬于0.25 mL PBS中。细胞悬液中加入1/5体积6×SDS加样缓冲液煮沸5 min,13 000 r/min离心10 min,取上清10%SDSPAGE电泳后转印至硝酸纤维素膜,以抗GAPDH抗体检测GAPDH为内对照,抗人HRAS抗体检测HRAS(V112A)的表达;肿瘤组织中HRAS蛋白表达的Western blot检测中,按照文献方法进行样品处理[8],用剪刀取1 g病变组织剪碎至乳糜状,置于1 mL PBS中煮沸5 min,13 000 r/min离心10 min,取上清用于Western blot检测。
1.5 质料提取及小鼠体内接种、观察及分析
按质粒大提试剂盒说明书操作,提取含HRAS(V112A)及点突变的质粒,溶解于生理盐水,紫外分光光度法测定浓度,根据检测结果质粒浓度调整至2 mg/mL。取6~8周龄雌性NIH小鼠,每组8只,分别于左侧腋下按每只100μg(50μL)皮内注射pC-HRAS(V112A)[HRAS(V112A)组]、pC-HRAS(V112A/G12C)[HRAS(V112A/G12C)组]、pC-HRAS(V112A/G13C)[HRAS(V112A/G13C)组]、pC-HRAS(V112A/Q61R)[HRAS(V112A/Q61R)组]、 pC-HRAS(V112A/G12C/G13C/Q61R)[HRAS(V112A/G12C/G13C/Q61R)组]和生理盐水(对照组)。注射后于正常条件下饲养,定期观察注射部位及全身病变情况。
1.6 病变组织中HRAS基因的PCR检测
病变组织中DNA的分离采用文献中的煮沸法[9-10],简要描述如下,质粒注射后4个月,取1 g病变组织剪刀剪碎至乳糜状,置1 mL PBS中煮沸5 min,13 000 r/min离心10 min,取1μL上清作为模板,使用HRAS-NheⅠ-F和HRAS-R1引物扩增HRAS 1~440 nt片段,切胶回收后连接pMD-18T载体测序。
2 结果
2.1 HRAS(V112A)的克隆和突变
以DiFi细胞cDNA为模板,PCR扩增HRAS,将扩增产物插入真核表达质粒pCDNA3.1(+)并测序,测序结果与人 HRAS 基因(Access Number:AB451336)比对,扩增的HRAS在335 nt位发生G-C突变,导致其112位的Val突变为Ala(V112A)。为排除聚合酶错配导致的突变,再次扩增,该突变仍然存在,将含有V112A 突 变 的 HRAS 基 因 命 名 为 HRAS(V112A)。以HRAS(V112A)为模板,使用Site-directed PCR突变[7]方法对设计位点进行突变,测序结果表明各HRAS(V112A)突变体均在设计位置含有预期突变,Blast及测序比对结果见图1。
2.2 重组质粒在L929细胞中的表达
以pCDNA3.1(+)空质粒作为对照,含HRAS(V112A)及其突变体的重组pCDNA3.1(+)质粒转染L929细胞,转染48 h后收取细胞进行Western blot检测,检测结果见图2A。本研究Western blot检测使用抗HRAS抗体购自中杉金桥公司,为OriGene产品,虽然抗体所用的免疫原为全长重组人HRAS蛋白,但该抗体与小鼠HRAS蛋白有交叉反应,因此对照细胞(泳道1)21 kD位置有较弱的阳性显色条带,但显色强度显著弱于质粒转染细胞。pC-HRAS(V112A)、pC-HRAS(V112A/G12C)、pC-HRAS(V112A/G13C)、pC-HRAS(V112A/Q61R)和 HRAS(V112A/G12C/G13C/Q61R)转染细胞中,21 kD位置均有HRAS强显色条带。Western blot检测中HRAS均显示为2~3条带,且G12C突变HRAS的电泳迁移速率慢于野生型,而Q61R突变HRAS的迁移速率快于野生型,该现象与文献[11-12]的报道结果相同,证明本研究中的重组质粒能够在细胞内正确表达HRAS(V112A)及其各突变体。目前尚未见报道Gly13突变HRAS的电泳迁移速率变化情况,本研究中,G13C突变同G12C突变的HRAS(V112A)的迁移速率相近,均慢于HRAS(V112A)。HRAS(V112A/G12C/G13C/Q61R)的迁移速率慢于 HRAS(V112A/Q61R),但快于 HRAS(V112A)、HRAS(V112A/G12C)和HRAS(V112A/G13C)。

图1 HRAS(V112A)的Blast结果及各突变体测序结果
2.3 小鼠体内致瘤结果
各质粒于腋下位置皮内注射NIH小鼠后3个月,HRAS(V112A)组 和 HRAS(V112A/Q61R)组 分 别 有 4 只(50%)和1只(12.5%)小鼠于注射部位出现病变,小鼠噬咬导致脱毛和皮损(图 3A),HRAS(V112A/G12C)组、HRAS(V112A/G13C)组和 HRAS(V112A/G12C/G13C/Q61R)组小鼠均未出现明显病变。HRAS(V112A)组中,4只小鼠注射部位皮肤变厚呈增生样改变,皮肤表面出现麦粒大小疣状物,取1只小鼠处死后剪取病变皮肤测量,增生物体积约0.8 cm×0.4 cm×0.3 cm,外有包膜包裹,无明显新生血管穿透包膜(图3B)。剩余3只出现增生样改变的小鼠在注射后5个月,病变自行消退。HRAS(V112A/Q61R)组中,1只小鼠在注射后4个月于注射部位生成肿瘤,体积约4.8 cm×2.2 cm×1.8 cm(图3C),解剖后可见肿瘤外有包膜包裹,新生血管穿过包膜进入肿瘤内部(图3D),肿瘤中心部位呈糜样坏死,坏死部分约占肿瘤体积1/3。制备切片后进行病理学检查可见,核浆比增大,细胞核大小形态及染色深浅不一(图4),表现为恶性肿瘤样病理改变。小鼠体内致瘤试验证明,每只小鼠单独皮内注射100μg的pC-HRAS(V112A/Q61R)质粒可在NIH小鼠体内诱导形成肿瘤。

图2 Western blot检测HRAS(V112A)及突变体在L929细胞中的表达
2.4 病变组织中HRAS基因的表达和测序
采用PCR和Western blot方法检测HRAS(V112A)组和HRAS(V112A/Q61R)组小鼠病变组织中HRAS核酸序列和蛋白表达情况。PCR可在病变组织中扩增出阳性条带,回收扩增产物连接T载体测序,HRAS(V112A)组和HRAS(V112A/Q61R)组分别挑取10个和3个重组克隆送测序。测序结果表明,扩增产物的核苷酸序列均与各组注射的HRAS基因序列对应(比对结果见图5)。通过比对可以发现,HRAS(V112A)组增生样组织和HRAS(V112A/Q61R)组肿瘤组织中扩增的HRAS序列均含有V112A突变,10个HRAS(V112A)组HRAS扩增序列中均不含G12C、G13C和Q61R突变,而3个HRAS(V112A/Q61R)组HRAS扩增序列中仅含有Q61R突变。值得注意的是,40%的HRAS(V112A)组HRAS序列和33%的HRAS(V112A/Q61R)组HRAS序列中含有除设计位点以外的其他突变,该现象在肿瘤组织已有报道,可能为肿瘤组织中细胞微环境紊乱和异常增生导致的基因突变所致[13-14]。
Western blot检测病变组织中HRAS的表达,分别取HRAS(V112A/Q61R)组小鼠肿瘤的实体、坏死组织、HRAS(V112A)组小鼠增生样病变组织进行Western blot检测,上述组织泳道中21 kD位置均有明显HRAS显色条带,而对照组小鼠皮肤泳道中HRAS条带显色强度显著弱于上述组织(图6)。Western blot检测的结果可 见 , HRAS(V112A/Q61R)仍 然 显 示 出 较 HRAS(V112A)更快的迁移速率,说明肿瘤组织中的HRAS基因在61位氨基酸位置存在突变。结合PCR和Western blot结果,可以认定HRAS(V112A/Q61R)组中肿瘤发生与注射pC-HRAS(V112A/Q61R)质粒相关。

图3 HRAS(V112A)组及HRAS(V112A/Q61R)组小鼠病变

图4 pC-HRAS(V112A/Q61R)诱发肿瘤的病理学检查结果

图5 小鼠肿瘤中扩增HRAS的测序结果
3 讨论
RAS基因(包括KRAS、NRAS和HRAS)的突变与肿瘤有密切的关系,在约15%的人类肿瘤中,可检测到RAS基因的突变,特别是在胰腺癌、结直肠癌和肺癌中,突变RAS的检出率分别可达90%、50%和30%。常见的RAS基因突变位点为12和13位密码子,占比约80%和17%,61位密码子突变占比不足4%,在每个突变位点又存在多种突变形式[2]。本研究中,根据文献报道选取G12C、G13C、Q61R以及3个位点联合突变的HRAS(V112A)作研究对象,分析不同突变体能否在小鼠体内诱导肿瘤[15]。本研究中,从人结肠癌细胞系DiFi中扩增HRAS含有V112A突变,该突变在之前的文献报道中从未出现,但也有文献报道除常见的12、13、61位氨基酸突变外,HRAS可含有其他与癌症相关的罕见突变类型,如 12(G)11 等[16]。Crowder等[17]在人多发性骨髓瘤细胞系OPM-2中检测到K117V突变,该突变位点位于HRAS蛋白的GTP结合位点附近,展现出比G12V突变更强的转化活性。与之前使用单独的T24-HRAS不能在小鼠体内诱发肿瘤的结果不同,本研究中,单独HRAS(V112A/Q61R)的表达即可在NIH小鼠中诱发肿瘤的发生,该结果可能部分归因于V112A突变赋予HRAS更强的致瘤活性。
HRAS的信号转导功能由两个蛋白进行调节:鸟苷酸转化因子(guanine nucleotide exchange factors,GEFs)促进HRAS与GDP的解离并与GTP结合,启动HRAS介导的激活信号转导;而GTP酶激活蛋白(GTPase-activating proteins,GAPs)则可激活 HRAS 的GTP酶活性,将GTP降解为GDP,关闭信号传导。若HRAS突变后使其GTP酶活性降低,则可延长激活信号的持续时间,增强细胞增殖能力,从而诱发肿瘤。HRAS蛋白的GTP酶活性依赖于两个结构域:位于1~86 AA的SwitchⅡ结构域和位于87~171 AA的Helix 3结构域[18](图7)。GAP的精氨酸手指可借助电荷作用伸入HRAS的内部与SwitchⅡ结合,提供正电荷稳定GTP水解过程中产生的负电荷,增强HRAS的GTP酶活性[19]。若HRAS第12位氨基酸由比移值(Rate of flow,Rf)为0.30/0.06的疏水性较弱的Gly突变为疏水性较强的氨基酸,如:Ile(Rf=0.79/0.57)、Val(Rf=0.67/0.32)和 Leu(Rf=0.77/0.52),可影响 HRAS 与 GAP 的结合,降低HRAS的GTP酶活性,延长激活信号的作用时间,促进细胞增殖;如果突变为疏水性较弱的Pro(Rf=0.48/0.16)或极性氨基酸,则不会影响/增强HRAS与GAP结合,不影响/增强HRAS的GTP酶活性[20-23],缩短激活信号的作用时间,抑制细胞增殖。当前关于G13突变的文献报道较少,但结构研究表明G13也位于HRAS的GTP酶活性结构域,因此可以推测G13突变对HRAS GTP酶活性的影响与G12相同[24]。根据上述分析,本研究中采用的G12C和G13C突变均为使用极性更强的非水解的极性氨基酸Cys(Rf=0.08/0.02)替代弱极性的Gly,增强HRAS与GAP的结合,从而会增强HRAS的GTP酶活性,因此G12C和G13C突变可能反而降低了HRAS(V112A)的致瘤活性。根据上述讨论,也就可以理解在HRAS(V112A)组出现增生样病变的情况下,HRAS(V112A/G12C)、HRAS(V112A/G13C)和含有上述两个突变的HRAS(V112A/G12C/G13C/Q61R)组小鼠中均未出现明显病变。HRAS蛋白通过61位Gln的氨基基团形成氢键与GAP的精氨酸指结构作用[25-26],使用Arg替代Gln后,产生静电斥力,降低HRAS与GAP的相互作用,降低HRAS的GTP酶活性,因此HRAS(V112A/Q61R)展现出更强的致瘤能力。

图6 Western blot检测HRAS(V112A)及突变体在NIH小鼠病变组织中的表达
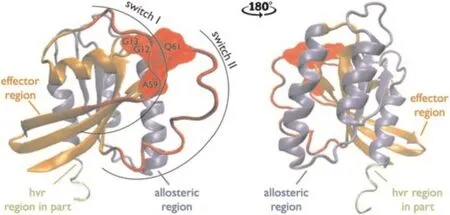
图7 HRAS蛋白3D结构示意图[18]
之前文献报道中,使用分别表达T24-HRAS和cMYC的质粒混合后注射的方式,每只小鼠注射剂量为12.5μg时,成年和新生小鼠中的致瘤率分别为20%和82%,但单独使用的T24-HRAS表达质粒未能在小鼠体内诱导肿瘤形成[4-5]。本研究中,当每只注射剂量为100 μg时,pC-HRAS(V112A/Q61R)在成年NIH小鼠中的的致瘤率为12.5%,该致瘤率虽然低于国外文献报道,但首次在单独使用HRAS表达质粒的条件下,在NIH小鼠体内诱导肿瘤形成。

