异烟肼通过ROS/Casp ase-3信号通路诱导L-02细胞凋亡及槲皮素的保护作用
陈廷玉,王东伟,张金波,王 伟,王景涛,盛颜良,卢春凤*
(佳木斯大学,黑龙江 佳木斯 154007)
异烟肼(isoniazid,INH)是临床上治疗结核病的首选药物[1],但因其具有严重的肝毒性[2-3],临床应用受到了极大的限制。到目前为止,INH的肝毒性机制尚未阐明,因此,阐明其肝毒性机制并寻找安全有效的保肝药物具有重要的意义。槲皮素(quercetin,Que)是一种天然黄酮类化合物,具有抗炎、抗肝纤维化、抗氧化和清除自由基等多种作用[4-6],是具有临床应用前景的抗氧化剂。前期研究发现,INH能诱导肝细胞发生DNA损伤,槲皮素对其具有保护作用[7-8]。因此,本实验以人正常肝细胞(L-02细胞)为研究对象,从细胞水平研究INH肝细胞毒性机制,重点探讨ROS/Caspase-3信号通路在INH诱导L-02细胞凋亡中的作用及槲皮素的保护效应,以期为临床寻找安全有效的防治INH肝毒性的药物提供实验依据。
1 材料与方法
1.1 细胞株和主要试剂
L-02细胞购自中国科学院上海细胞生物研究所;异烟肼、槲皮素、Rho-123和DCFH-DA均为Sigma公司产品;乳酸脱氢酶(LDH)试剂盒购自南京建成生物工程研究所;Hoechst33258染色试剂盒为杭州碧云天公司产品;兔抗Caspase-3多克隆抗体为Santa Cruz公司产品。
1.2 方法
1.2.1 细胞培养及试验分组 L-02细胞用含10%胎牛血清的DMEM培养液常规培养,镜下观察细胞生长情况,取对数生长期的细胞进行试验。将L-02细胞随机分为4组:对照组,给予等体积的无血清培养基;INH组,给予10 mmol/L INH;25μmol/L槲皮素组,给予10 mmol/L INH和25μmol/L槲皮素;50μmol/L槲皮素组,给予10 mmol/L INH和50μmol/L槲皮素。
1.2.2 MTT法检测L-02细胞存活率 L-02细胞经上述处理24 h后,吸弃培养液,每孔加入MTT溶液(5 mg/mL)20μL,放入CO2体积分数为5%的培养箱中继续孵育4 h。吸弃96孔板内培养上清液,每孔加入150μL DMSO,振荡10 min,使蓝紫色结晶完全溶解。使用酶标仪测定570 nm处的吸光度值D(570),计算细胞相对存活率。

1.2.3 细胞上清液中LDH活性检测 L-02细胞经上述处理24 h后,吸取细胞培养液,离心,取上清液100μL,加入50μL蒸馏水和250μL基质缓冲液,混匀,37℃水浴15 min后,加入250μL 2,4-二硝基苯肼,混匀,37℃水浴15 min,再加入0.4 mmol/L NaOH 2.5 mL,室温放置3 min后,用酶标仪在440 nm处测其吸光度值D(440)。按下列公式计算细胞LDH活性。

1.2.4 Hoechst 33258染色法检测细胞凋亡 L-02细胞经上述处理24 h后,吸弃培养液,用PBS洗2次,加入固定液500μL,4℃固定10 min,吸弃固定液,用PBS洗2次。然后加入Hoechst 33258染色液500μL,避光染色5 min。弃去染色液,用冷PBS洗2次,加抗荧光淬灭剂,封片。采用激发波长350 nm,发射波长460 nm,在荧光显微镜下观察、拍照,并计算细胞凋亡率。

1.2.5 细胞线粒体ROS水平的检测 收集各组细胞,用差速离心法分离线粒体,加入DCFH-DA,使其终浓度为2μg/mL,37℃、CO2体积分数为5%的培养箱中继续孵育20 min。吸去培养液,用冷PBS洗3遍,并弃去残液,以去除非特异性荧光,然后在荧光显微镜下观察细胞内DCF荧光强度并拍照。利用Image-Pro Plus 6.0软件进行荧光强度分析,并计算平均荧光强度。
1.2.6 细胞线粒体膜电位的检测 收集各组细胞,用差速离心法分离线粒体,加入Rhodamine123染色液,使其终浓度为5 mg/L,37℃、CO2体积分数为5%的培养箱内避光孵育20 min;冷PBS洗3遍去除非特异性荧光后,用激光共聚焦测定激发波长488 nm下的荧光强度值,并拍照。利用Image-Pro Plus 6.0软件进行荧光强度分析,并计算平均荧光强度。
1.2.7 Western blot法检测细胞中Caspase-3蛋白表达 L-02细胞经上述处理24 h后,收集细胞,提取细胞蛋白,用BCA法进行蛋白定量。每孔上样10 μg总蛋白,在12%SDS-PAGE中进行电泳分离,然后转到PVDF膜上。用含5%脱脂奶粉的封闭液封闭2 h后,加入用封闭液稀释的一抗,室温孵育1 h,然后4℃冰箱过夜。TBST洗膜后,加入用封闭液稀释的二抗,室温孵育1 h。再用TBST洗膜,在暗室中用Super ECL进行化学发光,X线胶片曝光显影。扫描胶片,用Quantity One 4.6.2图像分析软件对目标蛋白进行分析,以β-actin作为内参。
1.3 统计学分析
数据以xˉ±s表示。应用SPSS 11.0软件进行统计分析。INH组与对照组比较,采用两组间t检验,给药组与INH组比较采用ANOVA进行分析,以α=0.05为检验水准。
2 结果
2.1 L-02细胞存活率
L-02细胞存活率检测结果见图1,L-02细胞经INH处理24 h后,细胞的存活率明显降低,与对照组比较差异有统计学意义(P<0.01);50μmol/L槲皮素组细胞存活率明显增加,与INH组比较差异有统计学意义(P<0.01)。
2.2 L-02细胞上清液中LDH活性
L-02细胞上清液中LDH活性检测结果见图2,INH组细胞上清液中LDH活性显著高于对照组(P<0.01);25和50μmol/L槲皮素组细胞上清液中LDH活性明显低于INH组(P<0.05或P<0.01),表明槲皮素可抑制细胞LDH的漏出,且50μmol/L槲皮素组抑制作用更显著。

图1 L-02细胞存活率

图2 L-02细胞上清液中LDH活性
2.3 L-02细胞凋亡率
L-02细胞凋亡率检测结果见图3,L-02细胞经INH处理24 h后,细胞凋亡率显著高于对照组(P<0.01);25和50μmol/L槲皮素组细胞凋亡率明显低于INH组(P<0.05或P<0.01),表明槲皮素可抑制L-02细胞凋亡,且50μmol/L槲皮素组抑制作用更显著。

图3 L-02细胞凋亡率
2.4 L-02细胞线粒体ROS水平
结果见图4,与对照组比较,INH组L-02细胞线粒体ROS水平显著升高(P<0.01);25和50 μmol/L槲皮素组ROS水平明显低于INH组(P<0.05或P<0.01),表明槲皮素可抑制细胞线粒体ROS的生成,且50μmol/L槲皮素组抑制作用更显著。

图4 L-02细胞线粒体ROS水平
2.5 L-02细胞线粒体膜电位
L-02细胞线粒体膜电位检测结果见图5,与对照组比较,INH组L-02细胞线粒体ΔΨm显著降低(P<0.01);25和50μmol/L槲皮素组细胞线粒体ΔΨm明显升高,与INH组比较差异有统计学意义(P<0.05或P<0.01),表明槲皮素对细胞线粒体有保护作用,且50 μmol/L槲皮素组的保护作用更明显。

图5 L-02细胞线粒体膜电位
2.6 L-02细胞Caspase-3蛋白表达
Western blot检测细胞中Caspase-3蛋白表达的结果见图6,INH组细胞Caspase-3蛋白表达显著高于对照组(P<0.01);25和50 μmol/L槲皮素组细胞Caspase-3蛋白表达明显低于INH组(P<0.05或P<0.01),表明槲皮素能抑制Caspase-3蛋白表达,且50μmol/L槲皮素组抑制作用更显著。
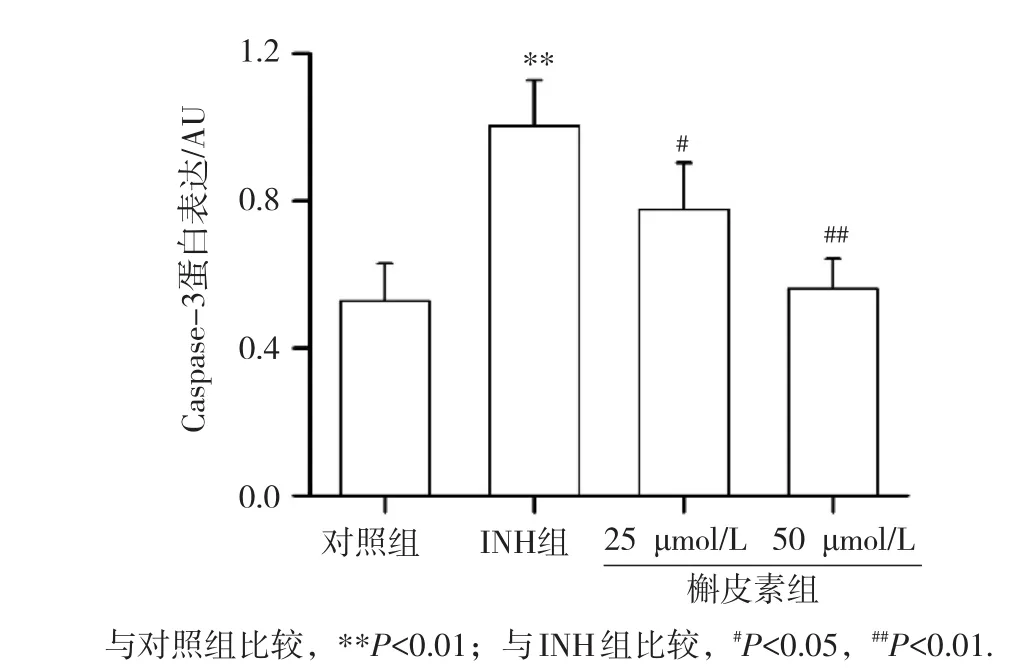
图6 L-02细胞Caspase-3蛋白表达
3 讨论
迄今为止,INH肝毒性的具体机制尚未阐明。研究表明,线粒体是多种外源化合物细胞毒性的主要靶点,也是细胞ROS产生的主要场所[9-12]。近年来,线粒体在细胞凋亡机制研究中的作用越来越受到关注[13-14]。因此,本实验以L-02细胞为研究对象,从细胞凋亡的角度探讨INH肝细胞毒性的机制,重点探讨ROS/Caspase-3信号通路在INH诱导L-02细胞凋亡中的作用,以及槲皮素对INH所致肝细胞凋亡的保护效应及其机制。本实验发现,INH处理L-02细胞后,细胞凋亡率明显增加,而槲皮素能明显降低细胞凋亡率,表明INH能诱导L-02细胞凋亡,槲皮素对INH诱导的L-02细胞凋亡具有保护效应。
研究表明,在细胞凋亡发生时,线粒体的结构和功能会发生明显变化,表现为线粒体膜通透性增高,线粒体ΔΨm降低[15]。那么INH诱导L-02细胞凋亡是否与ROS介导的线粒体损伤有关?本实验检测了细胞存活率[16]、LDH漏出量及线粒体ΔΨm值。正常情况下LDH存在于细胞内,只有当细胞膜损伤时,它才能释放出来,LDH释放或漏出是反映细胞膜受损的重要指标,LDH漏出量的多少可间接反映细胞受损的程度[17-19]。线粒体ΔΨm是反映线粒体功能的关键指标,线粒体ΔΨm降低,提示细胞发生线粒体损伤。本实验结果显示,INH处理后L-02细胞存活率明显降低,LDH漏出明显增加;而槲皮素能明显增加L-02细胞存活率,使细胞LDH漏出减少。同时,还发现INH作用L-02细胞后,线粒体ΔΨm明显降低,而槲皮素可使细胞线粒体ΔΨm明显升高,表明INH可导致细胞线粒体损伤,使膜通透性增加,促进LDH漏出;槲皮素对线粒体损伤有一定的保护作用[20],使膜通透性降低,进而减少LDH的漏出。线粒体ΔΨm降低是细胞凋亡的主要事件,线粒体ΔΨm下降可导致线粒体膜通透性增加,激活线粒体细胞凋亡途径,诱导细胞凋亡,最终导致细胞损伤[21-23]。本实验发现,L-02细胞经INH处理后,细胞中Caspase-3蛋白表达上调,而槲皮素作用后能明显下调Caspase-3蛋白表达,表明INH能造成L-02细胞线粒体损伤,激活Caspase凋亡蛋白酶,启动细胞线粒体凋亡途径,诱导L-02细胞凋亡;槲皮素可保护线粒体膜,阻断线粒体细胞凋亡途径[24],抑制L-02细胞凋亡的发生。那么INH是如何导致细胞线粒体ΔΨm降低,诱导细胞凋亡?研究表明,ROS的增加可损伤细胞线粒体膜,导致细胞线粒体ΔΨm降低,诱导细胞凋亡发生[25-26]。因此,本实验进一步检测了线粒体ROS水平,结果发现L-02细胞经INH处理后,线粒体ROS水平显著升高,而槲皮素能降低线粒体ROS水平,提示INH能促进线粒体ROS生成,降低细胞线粒体ΔΨm,诱导细胞凋亡;槲皮素可减少线粒体ROS的生成,增高细胞线粒体ΔΨm,抑制ROS/Caspase-3信号通路诱导的细胞凋亡,保护细胞免受损伤。
总之,在本实验条件下,INH能诱导L-02细胞发生凋亡,ROS/Caspase-3信号通路参与了其凋亡的过程;而槲皮素对INH诱导的L-02细胞凋亡具有保护作用,其机制可能是通过抑制ROS释放,改善线粒体功能,抑制ROS/Caspase-3信号通路阻断线粒体细胞凋亡途径,从而抑制L-02细胞凋亡,但具体作用机制还有待于进一步研究。

