西藏曲拉和发酵乳中抗氧化和益生特性乳酸菌的筛选及鉴定
刘亚东,张 悦,贺银凤,李 畅,吴 荣,贺 敏,李 博
(1.内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018;2.内蒙古包头市疾病预防控制中心,内蒙古包头 014030;3.内蒙古伊利实业集团股份有限公司,内蒙古呼和浩特 010018)
西藏地区高海拔、相对独立的生态环境致使其传统牦牛乳制品曲拉和发酵乳具有独特且丰富的乳酸菌[1-2]。曲拉(藏语,指奶渣)是藏区牧民以脱脂牦牛乳为原料,添加自然条件下储存的含有大量乳酸菌的乳清为发酵引子,经发酵、脱水、后熟、干制而成的民族传统乳制品;除供食用外,也常用作发酵乳的引子[3]。
近年来,西藏地区传统牦牛乳制品中乳酸菌的抗氧化应激特性是研究的重要方向。氧化应激(Oxidative Stress)及其导致的氧化损伤现象,已成为备受关注的机体病变重要原因之一[4]。机体抗氧化系统的内源性调节仅能在一定范围内清除导致氧化应激现象的自由基(Free Radical)、活性氮(RNS,Reactive Nitrogen Species)等[5],因此,补充外源性抗氧化剂缓解氧化应激状态[6]具有重要意义。目前,虽然针对藏区传统牦牛乳制品中抗氧化乳酸菌的研究已有较多的报道,但是大多集中于抗氧化应激特性的筛选和机制研究[7-9],对于兼具益生特性菌株的开发存在不足。
乳酸菌进入人体后能否耐受胃酸和胆盐的逆环境胁迫,是其发挥抗氧化作用的重要前提条件。因此,本实验通过溶钙圈法对采集自西藏牧区的9份曲拉和发酵乳中的乳酸菌进行了抗氧化应激和益生特性乳酸菌的分离、筛选和鉴定。以期为天然抗氧化剂的开发提供优良菌株,丰富西藏地区乳酸菌资源库的开发与利用。
1 材料与方法
1.1 材料与仪器
9份西藏牧区自然发酵牦牛乳制品信息见表1;标准菌株粪肠球菌CICC 10396(Enterococcusfaecalis) 中国工业微生物菌种保藏管理中心(CICC);MRS液体培养基(MRS固体和半固体培养基在MRS液体培养基基础上分别添加1.5%、0.75%的琼脂) 广东环凯生物科技有限公司;琼脂糖、1,1-二苯基-2-三硝基苯肼(DPPH·) 美国Sigma公司;PrimeSTAR HS DNA Polymerase、DL2000 DNA Marker、6×Loading buffer、核酸染料 日本TaKaRa公司;细菌基因组DNA提取试剂盒 天根生化科技有限公司;2×Easy Taq Super Mix 北京全式金生物有限公司;溶菌酶-306A046 北京索莱宝科技有限公司;其他药品 均为国产分析纯。

表1 样品信息Table 1 Sample information
Thermo Scientific Multiskan FC酶标仪 美国Thermo Fisher公司;UV-1800紫外分光光度计 上海美谱达仪器有限公司;JY88-IIN超声波破碎仪 宁波新芝生物科技股份有限公司;5810R离心机 德国Eppendorf有限公司;电泳仪 美国Bio-Rad公司;Veriti 96孔PCR仪 美国Applied Biosystems公司;GelDocXR+凝胶成像仪 美国Bio-Rad公司;OptionS7+ClassicUVF超纯水系统 英国ELGA公司;BILON-08无菌均质器 上海比朗仪器有限公司。
1.2 实验方法
1.2.1 乳酸菌的分离纯化与保存 样品的处理:称取5 g切成小块的曲拉(发酵乳吸取5 mL)加入装有45 mL生理盐水的均质袋中,均质5 min(拍击速度:6次/秒)得到样品悬浊液;富集:吸取2 mL样品悬浊液加入18 mL的脱脂乳中分别置于30 ℃和37 ℃进行样品悬浊液的第一次厌氧富集(5 d),利用MRS液体培养基,按照上述培养条件进行第二次富集;分离与纯化:挑取第二次富集液划线于含7.5‰ CaCO3的MRS固体培养基(30 ℃/37 ℃,厌氧5 d),培养24 h挑取具有透明溶钙圈的菌落进行革兰氏染色观察和MRS半固体穿刺保存,将革兰氏阳性的菌株继续划线培养,直至得到纯培养物,并进行过氧化氢酶试验,记录特征形态、采集图像;保存:将具有溶钙圈、革兰氏阳性和过氧化氢酶阴性[10]的菌株进行甘油和真空冷冻干燥保存。
1.2.2 抗过氧化氢菌株的筛选 利用平板扩散法初筛具有抗氧化能力的试验菌株,在培养皿中加入10 mL MRS固体培养基,静置冷却;加入20 mL混有2%三代试验菌株培养液的MRS固体培养基,摇匀,冷却;加入10 mL含0.3%过氧化氢的1.5%琼脂水溶液[11]。将上述试验菌株的培养皿于其分离温度(30 ℃或37 ℃)下倒置培养2 d,选取形成单菌落的高抗菌株进行后续研究。
1.2.3 抗过氧化氢菌株清除自由基能力的筛选 取10 mL三代试验菌株培养液,利用同体积无菌超纯水离心(4 ℃,4000 r/min,6 min)洗涤两次后,重悬成菌悬液,吸取5 mL菌悬液利用超声波破碎仪(280 w,2 s/2 s,20 min)冰浴破碎处理,经显微镜检查无完整细胞后离心(4 ℃,12000 r/min,10 min)取上清液,即为无细胞提取物。清除DPPH·的试验方法参考文献[12],清除羟自由基(·OH)试验方法参考文献[13];其中用400 mg/mL的维生素C溶液、超纯水替代样品,分别为阳性对照组和空白对照组。
1.2.4 基于16S rRNA基因片段分析鉴定抗氧化菌株 试验菌株和标准菌株DNA的提取参考细菌基因组DNA提取试剂盒说明书中步骤,进行总DNA的提取;参考文献[14]中方法进行16S rRNA片段扩增,取5 μL扩增后的产物,用1.0%的琼脂糖凝胶电泳检测,若1500 bp处有清晰的扩增条带,无非特异性产物,表明PCR扩增成功;委托上海英潍捷基贸易有限公司对PCR扩增产物测序,测序结果利用DNAStar软件中的SeqMan双向拼接后,在GeneBank中利用BLAST进行同源性序列检索,选择Mega7.0中的邻接法(Neighbor-Joining)将同源性较高的菌株序列连同试验菌株序列进行1000次自展(Bootstrap)检验后,绘制系统发育树。
1.2.5 抗氧化菌株对酸、胆盐的耐受性评价 初始pH对乳酸菌生长的影响:将三代试验菌株以体积分数为1%的接种量,加至pH为1、2、3、4、5、6、7、8、9的MRS液体培养基中,于37 ℃培养18 h,用酶标仪测定595 nm下的OD值[15]。模拟胃液pH对乳酸菌存活的影响:吸取1 mL三代试验菌液于9 mL pH3、0.2% NaCl的溶液中,静置处理2 h,并于0、2 h对试验菌株进行活菌计数[16];利用如下公式进行存活率Sr的计算,式中a为未经酸处理的试验菌株活菌数/CFU·mL-1,b为经酸处理2 h的试验菌株活菌数/CFU·mL-1。
乳酸菌对胆盐的耐受性:将三代试验菌株以体积分数为1%的接种量,加入含有0、0.3%胆盐(人体进食后肠道中胆盐平均浓度[17])的MRS液体培养基中,于37 ℃培养,每2 h用酶标仪测定595 nm下的OD值,以OD值变动0.3为1单位,对比与未加胆盐组的滞后生长时间[18]。
1.3 数据分析

2 结果与分析
2.1 抗过氧化氢菌株的分离和初步鉴定结果
过氧化氢是一种强氧化物,菌株对其耐受能力与抗氧化能力呈现一定的正相关性[19]。利用溶钙圈法从采自西藏林芝和山南牧区的9份样品(曲拉、发酵乳)中分得62株菌株,其中23株对0.30%过氧化氢具有耐受能力。由表2可知,23株抗过氧化氢菌株菌落形态大多表现为直径0.5~2 mm、白色、圆形、突起或微隆起、不透明或半透明、边缘整齐;革兰氏染色无芽孢、均为阳性,其中10株杆菌、13株球菌;过氧化氢酶阴性且溶钙圈为阳性,具备一定的产酸能力,符合乳酸菌的特征[10]。

表2 抗过氧化氢菌株的编号、形态和初步鉴定结果Table 2 Results of number,morphology and preliminary identification of hydrogen peroxide resistant strain
2.2 菌株清除自由基能力的筛选结果
DPPH·是一种稳定的人工合成有机自由基,可通过测定OD517值的变化定量的评价抗氧化剂清除该自由基的能力[20];而·OH具备很强的氧化性,在其胁迫下可损伤生物细胞的大分子,影响正常生理功能[21],评价这两种自由基的清除率是筛选抗氧化菌株的一种稳定且操作简单的方法。
由表3可知,23株菌株对两种自由基都具有不同程度的清除能力,23株菌悬液清除DPPH·的能力显著高于无细胞提取物(p<0.05),而18株无细胞提取物对·OH的清除能力显著高于菌悬液(p<0.05),且同一株菌株对DPPH·和·OH的清除能力间不存在对应关系;其中菌株5-D、9-E、5-E、4-C对DPPH·具备最显著清除能力(p<0.05),菌株4-C、5-E、1-B、1-E清除·OH的能力最显著(p<0.05),具备较高的抗氧化能力。具体表现为,由表3中DPPH·清除率可知,23株菌株的菌悬液对DPPH·的清除能力均显著高于(p<0.05)无细胞提取物,如清除率最高的5-D、9-E菌悬液清除率分别为86.97%±0.11%、53.63%±0.19%,然而对应的无细胞提取物清除率却仅为19.52%±0.11%、1.18%±0.04%;由表3中·OH清除率可知,除菌株2-D、5-C、5-D、5-K、9-G外,其余18株菌株的无细胞提取物对·OH的清除能力均显著(p<0.05)高于菌悬液,如4-C、5-E的无细胞提取物清除率为27.62%±0.28%、17.80%±0.09%,而菌悬液清除率仅为8.54%±0.07%、2.9%±0.06%;对比表3发现,对DPPH·清除率最高的5-D,然而·OH清除率仅为1.80%±0.06%,·OH清除率较高的1-B、1-E,DPPH·清除率仅为15.94%±0.07%和23.03%±0.23%,但菌株4-C对两种自由基的清除率均较高。

表3 菌株对自由基的清除率Table 3 Radical scavenging rate of strains
综上,试验菌株清除DPPH·的物质主要存在于胞外,而清除·OH的物质则分布于胞内,不同菌株间清除自由基能力的差异可能是因为其胞外多糖和胞内抗氧化应激酶系统、硫氧还蛋白(Thioredoxin)系统、谷胱甘肽(Glutathione)系统、巯基氧化还原系统等差异造成[22]。选取对自由基清除能力较高的菌株4-C、5-D、5-E、9-E进行后续试验,这4株菌株抗氧化能力远高于刘珊春[23]与罗章[7]等报道的菌株,具备较好的研究应用价值。
2.3 抗氧化菌株的16S rRNA基因片段鉴定
试验菌株和标准菌株通过16S rRNA通用引物F-5′-AGAGTTTGATCCTGGCTCAG-3′、R-5′-CCGT CAATTCCTTTGAGTTT-3′扩增后会产生1500 bp左右的片段[12],观察图1,发现在目标位置均有单一、明亮的特异性条带,证明菌株的16S rRNA片段扩增成功。观察菌株基于16S rRNA的系统发育树发现4-C与Pediococcuspentosaceusstrain LAB2、5-D和5-E与Lactobacillusdelbrueckiisubsp. jakobsenii ZN7a-9T、9-E与Lactobacillusgasseristrain DMBCT6处于同一分支;同时标准菌株CICC 10396与Enterococcusfaecalisstrain 309-6处于同一分支,与已知相符,说明鉴定结果可信。

图1 菌株16S rDNA基因扩增电泳图Fig.1 Amplified electrophoresis of strain 16S rDNA注:图中条带从左向右依次为marker、4-C、5-D、5-E、9-E。
Lactobacillusdelbrueckiisubsp. Jakobsenii 5-D、5-E是徳氏乳杆菌(Lactobacillusdelbrueckii)新分类的亚种,其模式菌株Lactobacillusdelbrueckiisubsp. Jakobsenii ZN7a-9T分离自布基纳法索的一种当地麦芽汁发酵饮料[24],近来发酵乳制品中也出现报道[25],但还罕有对其抗氧化性等潜在益生特性研究。

图2 菌株系统发育树Fig.2 Phylogenetic tree of strain
2.4 抗氧化乳酸菌的耐酸评价结果
胃酸作为人体针对微生物最大的安全屏障,可杀死绝大多数通过口腔进入人体的异源微生物,乳酸菌能否在其pH3左右的酸性环境存活,是后期发挥益生作用的前提条件[26];同时,乳酸菌定殖的碱性肠道环境[15]对生长影响同样不可忽视。观察图3,发现4株乳酸菌生长的最适pH为6~7,强酸和弱碱性胁迫对菌株的生长均有不同程度的抑制作用,菌株9-E对酸表现出较强耐受性,4株菌株对碱性环境均具备较好的耐受性。具体表现为:菌株9-E在pH4时开始生长,在pH6~7时OD595值达最高(pH6和7 OD595值相比差异不显著p>0.05),随着pH的升高,菌株生长开始受到抑制,但pH9时仍维持在一个较高的生长量,与之相比,其他3株菌株的可生长范围为pH5~9。观察图4,经pH3的酸液处理2 h后,4株乳酸菌均表现出较好的耐受性,5-D、5-E、9-E菌株的活菌数对数值处理前后差异不显著(p>0.05),存活率均在97.86%以上,耐受性稍弱的4-C存活率仍高达58.07%,维持在106CFU/mL以上。

图3 不同初始pH对菌株生长的影响Fig.3 Effects of different initial pH values on strain growth注:相同菌株大写字母不同表示差异显著(p<0.05),表4同。

图4 酸处理2 h菌株的活菌数对数值Fig.4 Number of living bacteria of acid treated 2 hours注:相同菌株小写字母不同表示差异显著(p<0.05)。
2.5 抗氧化乳酸菌的耐胆盐评价结果
胆盐是甘氨酸或牛磺酸和胆汁酸结合形成的钠(钾)盐,在人体消化和吸收脂肪中起到重要作用,同时,胆盐的高渗透压性和高效的表面活性剂作用可破坏异源微生物的细胞膜、改变线粒体膜通透性等造成死亡[27]。由表4可知,4株菌株在质量分数为0.30%的胆盐MRS液体培养基中生长受到不同程度的抑制(差异显著p<0.05),其中5-D、5-E对0.3%胆盐具备较好的耐受性,延滞时间分别为1.10、3.39 h,但4-C、9-E的生长受到了较大的抑制作用,延滞时间分别为6.72、7.49 h。当人体进食后,胆盐在十二指肠中维持在0.20%~0.50%之间、空肠中约为0.30%、回肠中约为0.15%,菌株5-D、5-E可耐受0.3%胆盐,表明其具有在肠道内存活继而发挥抗氧化应激作用的一定潜力[18]。
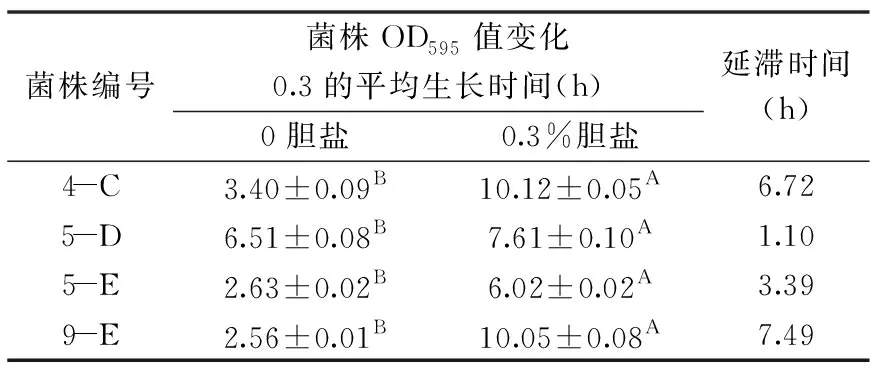
表4 胆盐对菌株平均生长时间的影响Table 4 Effects of bile salt on the average growth time of the strain
3 结论
西藏牧区9份曲拉和发酵乳中共获得62株菌株,经筛选发现试验菌株清除DPPH·的物质主要存在于胞外,而清除·OH的物质则分布于胞内,且同一株菌株对DPPH·和·OH的清除能力间不存在对应关系,其中Lactobacillusdelbrueckiisubsp. Jakobsenii 5-D、5-E对DPPH·和·OH有较高清除能力同时对酸、碱和胆盐均具备较好的耐受性,有较大潜力应用于益生菌抗氧化剂的研究与开发,对丰富西藏地区传统牦牛乳制品中乳酸菌资源库的挖掘工作具有一定意义。

