曲酸对冷鲜鸭肉中优势腐败菌的抑制作用及其抑菌机理
侯温甫,欧阳何一,吴 忌,韩千慧,周 敏,王宏勋*
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2.湖北省生鲜食品工程技术研究中心,湖北 武汉 430023;3.武汉轻工大学生物与制药工程学院,湖北 武汉 430023)
曲酸是由青霉和曲霉真菌发酵产生的一种有机酸,对人体无害[1],对细菌、酵母菌及霉菌均具有较强的抑制作用[2-4],苏国成等[5]研究发现曲酸对食品中常见污染菌,尤其是对于革兰氏阴性细菌的抑菌效果显著,体积分数0.1%的曲酸就可以起到根本性抑制铜绿假单胞菌生长的良好效果;曲酸与喹诺酮类物质[6]、壳聚糖[7]等合成后能增强体外抗菌活性。此外,曲酸能够抑制多酚氧化酶活性[8],有效清除自由基和提高抗氧化能力[9]。与山梨酸和苯甲酸及其盐类等化学添加剂相比,曲酸具有能够与水互溶、pH值变化对其抑菌力无明显影响[10]、热稳定性良好、可抑制亚硝酸盐产生致癌物质[5,11]等特点,在果蔬、肉制品与水产品等护色保鲜方面有着广阔的应用潜力[12]。
冷鲜鸭肉因其肉质柔软、风味鲜美、安全卫生、汁液流失少且便于进一步加工制作而受到消费者青睐,但受限于屠宰技术、卫生条件、加工设备现代化程度等因素,尤其是在加工、包装与贮藏阶段中微生物的污染严重影响了其商品价值,冷鲜鸭肉产品在我国仍处于起步阶段[13-15]。冷鲜鸭肉的腐败菌及常见病原微生物主要有假单胞菌属、气单胞菌属、热杀索丝菌、沙门氏菌等[16-18],如何有效控制冷鲜鸭肉中腐败微生物的增殖是促进冷鲜鸭肉产品快速发展的重要技术瓶颈。
本实验室前期研究发现,曲酸能够有效抑制冷鲜鸭肉产品微生物增殖,维持冷鲜鸭肉良好品质,显示曲酸具备作为冷鲜鸭肉安全高效保鲜剂的应用潜力。现阶段对曲酸抑菌特性及机理研究主要集中于对微生物数量的控制[19],曲酸抑制冷鲜鸭肉中腐败微生物的特性与抑菌机理尚少见报道。本实验以冷鲜鸭肉中主要腐败微生物假单胞菌、气单胞菌、热杀索丝菌和具有致腐能力的常见病原微生物沙门氏菌为研究对象,研究曲酸对4 株菌株的抑制作用和抑菌机理,以期为曲酸在冷鲜鸭肉产业中应用提供理论支撑。
1 材料与方法
1.1 菌株、材料与试剂
假单胞菌、热杀索丝菌、气单胞菌、沙门氏菌由武汉轻工大学微生物与食品研究所提供,分离自冷鲜鸭肉;曲酸(化学纯食品级) 上海阿拉丁生化科技股份有限公司;营养琼脂培养基 青岛海博生物技术有限公司;蛋白电泳试剂盒 上海碧云天生物技术有限公司;Ca2+、K+、Mg2+测试试剂盒、β-半乳糖苷酶试剂盒、碱性磷酸酶试剂盒 南京建成生物工程研究所;红霉素、利福平 合肥Biosharp公司。
1.2 仪器与设备
全自动微生物生长测定仪 芬兰Bioscreen公司;GL-20G-II型冷冻离心机 上海安亭科学仪器厂;超声波细胞粉碎机 宁波新芝生物科技股份有限公司;1645050型电泳仪、凝胶成像系统 美国Bio-Rad公司;紫外-可见分光光度计 上海美谱达仪器有限公司;扫描电子显微镜 日本HITACHI公司。
1.3 方法
1.3.1 曲酸对菌株的抑制作用
1.3.1.1 曲酸对腐败菌最小抑菌浓度的测定
曲酸对菌株的最小抑菌浓度的测定参考刘蔚等[20]的方法。适宜温度下(沙门氏菌37 ℃、热杀索丝菌27 ℃、假单胞菌30 ℃、气单胞菌30 ℃,下同)活化供试菌,200 r/min液体LB培养基中振荡培养24 h。添加对数期的供试菌100 μL于已灭菌的10 mL液体LB培养基中使菌液浓度保持在107CFU/mL,添加曲酸溶液至终质量浓度分别为31.25、62.5、125、250、500、1 000、2 000、4 000 μg/mL,用无菌蒸馏水代替曲酸溶液作为空白对照组。于摇床中培养24 h后观察,以无菌生长的曲酸处理组最低质量浓度为最小抑菌浓度。
1.3.1.2 曲酸对腐败菌株抑菌效果的测定
将已灭菌的营养琼脂培养基倒入培养皿,每皿倾倒15 mL,待其凝固。取100 μL菌液滴加至凝固的培养基表面,用已灭菌的涂布棒涂抹均匀。在已凝固的培养基表面上垂直放入牛津杯,轻轻加压(镊子轻按即可),使其与培养基无空隙接触。在牛津杯内加入200 μL质量浓度为0.5、1.0、2.0、4.0 mg/mL曲酸溶液,勿使其外溢,以无菌水和体积分数75%乙醇溶液分别作为空白对照和阳性对照,盖上陶瓦盖,避免冷凝水滴下,加完样品后在适宜温度培养箱内培养12~24 h,观察结果,读取抑菌圈直径。
1.3.1.3 曲酸对腐败菌生长曲线的影响
腐败菌生长曲线测定参考何丽[21]的方法进行。移液枪吸取0.5 mL浓度为106~107CFU/mL的菌悬液分别加入5 mL LB培养基中,添加曲酸溶液使曲酸终质量浓度分别为0.5、1.0、2.0、4.0 mg/mL,混匀。吸取200 μL混有接种菌与曲酸的培养基至蜂窝状样品板中,每个样品质量浓度测3 个平行,无菌蒸馏水作空白对照。样品板置于全自动分析仪检测器中,设定适宜温度培养2 d,每隔2 h自动测定一次,收集数据并作图。
1.3.2 曲酸对菌株细胞膜作用分析
1.3.2.1 曲酸对菌株表面疏水性的影响
参考冯建岭[22]的方法并进行改进。无菌条件下将供试菌分别接种至100 mL LB无菌培养基中,于各菌适宜温度200 r/min振荡培养48 h。6 000 r/min冷冻离心收集菌体,沉淀溶于无菌生理盐水后再离心取菌体沉淀,重复3 次。最终用0.1 mol/L硝酸钠(pH 6.2)将菌体重悬至108CFU/mL,实验分为2 组:1)空白对照组:取3.0 mL重悬菌液,加入3 mL无菌生理盐水;2)处理组:取3.0 mL重悬菌液,加入3 mL体积分数1%的曲酸溶液,控制曲酸最终质量浓度为4.0 mg/mL。
振荡混匀置于各菌适宜温度培养2 h,分别取5 mL菌液于600 nm波长处测定其光密度值,并标记为ODa;分别再取4.8 mL菌液与0.8 mL十六烷,用漩涡混合器混匀,室温条件下静置15 min,待两相分离,并在20 min后吸取水相测定光密度值,标记为ODb,吸附率按下式计算,每组重复3 次。吸附率越高,疏水性越强。
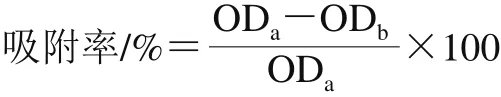
1.3.2.2 曲酸对菌株细胞膜渗透性的影响
参照冯建岭[22]、郝刚[23]等的方法,并进行改进。将菌株用LB培养基培养至对数期,然后分别移取5 mL菌液置于无菌试管中,平均分为4 组:1)红霉素组:分别加入0.5 mL无菌蒸馏水,然后再分别加入0.5 mL 100 μg/mL的红霉素溶液;2)红霉素+曲酸组:分别加入0.5 mL无菌曲酸溶液,使其终质量浓度约为4.0 mg/mL,然后再加入0.5 mL 100 μg/mL的红霉素溶液;3)利福平组:分别加入0.5 mL无菌蒸馏水,然后再分别加入0.5 mL 20 μg/mL利福平溶液;4)利福平+曲酸组:先分别加入0.5 mL无菌曲酸溶液,使其终质量浓度约为4.0 mg/mL,然后再分别加入0.5 mL 20 μg/mL的利福平溶液。
将上述各组试管充分摇晃混匀,置于适宜温度恒温培养10 h,在630 nm波长处用分光光度计检测其光密度值的变化。各组实验重复3 次,最终结果取平均值。
1.3.2.3 扫描电子显微镜观察曲酸对菌株细胞形态的影响
参考Wang Chenjie等[24]的方法并进行改进,具体操作如下:无菌条件下将浓度为107CFU/mL的供试菌液添加到10 mL LB培养基中,加入曲酸至终质量浓度为4.0 mg/mL,空白对照组以无菌水代替,于适宜温度下200 r/min振荡培养24 h。此后,4 ℃条件下6 500 r/min离心10 min去上清液,用0.1 mol/L pH 7.0磷酸盐缓冲液清洗3 次。采用体积分数2.5%的戊二醛溶液(0.1 mol/L pH 7.0磷酸盐缓冲液配制)低温固定24 h,0.1 mol/L pH 7.0的磷酸盐缓冲液清洗3 次,每次15 min。分别采用体积分数30%、50%、70%、90%、100%乙醇进行梯度脱水,每次5 min。分别采用醋酸异戊酯-丙酮(体积比1∶1)和醋酸异戊酯各置换2 次,每次5 min。喷金处理后进行扫描电子显微镜观察。
1.3.3 曲酸对菌株胞内物质的影响研究
1.3.3.1 曲酸对菌株呼吸链脱氢酶的影响
参照冯建岭[22]的方法进行,操作如下:取培养至对数期菌悬液1.0 mL分别于4 支无菌试管,再分别加入0.05 mol/L Tris-HCl缓冲液(pH 8.6)2.0 mL、0.1 mol/L葡萄糖溶液2.0 mL及1.0 mg/mL 2,3,5-氯化三苯基四氮唑(红四氮唑)溶液2.0 mL,充分摇匀。向其中3 支试管中加入曲酸溶液,控制质量浓度为4.0 mg/mL,空白对照组用无菌水代替。将各组具塞试管置于适宜温度培养6 h,然后分别滴加2 滴浓硫酸终止反应,此时可以观察到颜色变化,并拍照。最后,再往各管中分别加入5.0 mL正丁醇,振荡萃取,接着静置30 min后取上层液体于4 500 r/min离心6 min,测定上清液在490 nm波长处光密度值(以正丁醇作参比)。
1.3.3.2 曲酸对菌株β-半乳糖苷酶活力的影响
无菌条件下将供试菌分别接种至100 mL LB无菌培养基中,适宜温度200 r/min振荡培养。取培养至对数期的供试菌10 mL于无菌试管中,加入曲酸溶液至终质量浓度4.0 mg/mL,用无菌蒸馏水代替曲酸溶液作为空白对照组,适宜温度摇床中培养6 h后6 500 r/min离心10 min。取上清液作为样液,按照试剂盒操作步骤测定β-半乳糖苷酶活力。
1.3.3.3 曲酸对菌株碱性磷酸酶活力的影响
取培养至对数期的供试菌10 mL与无菌试管中,加入曲酸溶液至终质量浓度4.0 mg/mL,用无菌蒸馏水代替曲酸溶液作为空白对照组。适宜温度(同1.3.1.1节)摇床中培养6 h后,6 500 r/min离心10 min,取上清液作为样液,按照试剂盒步骤进行操作,于520 nm波长处测定各组光密度值。定义每克组织蛋白在37 ℃与基质作用15 min产生1 mg酚为1 个金氏单位。
1.3.3.4 曲酸对菌株细胞内Ca2+、K+、Mg2+泄漏的影响
无菌条件下将供试菌分别接种至液体培养基中,适宜温度下培养至对数期。加入曲酸溶液至终质量浓度为4.0 mg/mL,用无菌蒸馏水代替曲酸溶液作为空白对照组。适宜温度摇床中培养6 h后6 500 r/min离心10 min,取上清液测定培养基中Ca2+、K+、Mg2+浓度。具体测定方法参照试剂盒说明方法进行。
1.3.3.5 曲酸对菌株菌体蛋白质的影响
菌体蛋白质提取参照Sitohy等[25]的方法并稍有改动。取经培养至对数期的供试菌液平均分为2 组,一组加入无菌曲酸溶液,至质量浓度为4.0 mg/mL,另一组加入等量无菌水做空白对照。适宜温度恒温摇床培养6 h后6 500 r/min离心10 min,测定上清液蛋白质量浓度。用无菌水洗涤沉淀后溶解,超声波破碎20 min后,6 500 r/min离心10 min,取上清液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳实验。
1.4 数据统计分析
采用Excel 2016和SPSS 19.0软件对数据进行统计分析,组间数据的差异显著性比较采用单因素方差分析,以P<0.05表示差异有统计学意义,所得数据以±s表示。
2 结果与分析
2.1 曲酸对供试菌抑制作用2.1.1 最小抑菌浓度

表1 曲酸对4 株菌株的最小抑菌浓度Table1 Minimal inhibitory concentrations of kojic acid for four strains
最小抑菌浓度用于定量表示抑菌剂的抑菌性能。从表1可以看出,随着曲酸质量浓度升高,其对供试菌的抑菌效果逐渐增强。热杀索丝菌对曲酸最为敏感,0.5 mg/mL时生长即被抑制;而假单胞菌和气单胞菌在曲酸质量浓度达到1.0 mg/mL时生长被抑制,当曲酸质量浓度达到2.0 mg/mL时能完全抑制沙门氏菌的生长。曲酸对沙门氏菌、热杀索丝、假单胞菌和气单胞菌最小抑菌质量浓度分别为2.0、0.5、1.0、1.0 mg/mL。有学者研究曲酸对食品中常见污染菌的抑菌作用时发现,1.0 mg/mL曲酸对铜绿假单胞菌曲酸既有较强的抑制作用,曲酸对大肠杆菌、猪伤寒沙门氏菌和枯草芽孢杆菌的最小抑菌质量浓度分别为3.0、3.0、4.0 mg/mL[5],与本实验结果基本一致。
2.1.2 抑菌圈直径

表2 曲酸作用下4 株菌株抑菌圈直径Table2 Diameters of zone of inhibition of four strains when exposed to kojic acidmm
基于牛津杯法的抑菌圈直径表征着抑菌剂对微生物的抑菌效果。由表2可看出,当曲酸质量浓度达到2.0 mg/mL时,4 株供试菌均出现抑菌圈,其中热杀索丝菌抑菌圈直径最大,为11.157 mm;当曲酸质量浓度增加至4.0 mg/mL时,4 株供试菌抑菌圈直径均增大,气单胞菌的抑菌圈直径最大(21.367 mm),假单胞菌次之(18.626 mm)。综合来看,曲酸质量浓度为2.0 mg/mL时即能抑制4 株菌株的增殖,低质量浓度情况下热杀索丝菌抑菌圈直径最大,而提高曲酸的质量浓度后,假单胞菌和气单胞菌抑菌圈直径增加1 倍以上。
2.1.3 液体体系下供试菌生长曲线


图1 不同质量浓度曲酸作用下沙门氏菌(A)、热杀索丝菌(B)、假单胞菌(C)、气单胞菌(D)生长曲线Fig.1 Growth curves of Salmonella (A), Brochothrix thermosphacta (B),Pseudomonads (C) and Aeromonas (D) with different concentrations of kojic acid
全自动微生物生长测定仪可连续对微生物生长情况进行监测,当微生物培养环境和数量发生变化时,菌液浓度与其光密度值成正比,根据光密度值与时间的变化关系图,可推断出该微生物的生长状况[24]。由图1可以看出,曲酸对4 株供试菌均有较强的抑制效果。加入0.5、1.0、2.0、4.0 mg/mL的曲酸溶液,热杀索丝菌生长完全被抑制,45 h内菌悬液光密度值基本无增长;加入质量浓度为0.5、1.0 mg/mL曲酸溶液,假单胞菌、气单胞菌、沙门氏菌的对数生长期出现不同程度的延迟,而加入2.0、4.0 mg/mL的曲酸溶液,45 h内其菌悬液光密度值基本无增长。综合来看,此结果与最小抑菌浓度以及抑菌圈直径数据一致,热杀索丝菌对曲酸较敏感,低质量浓度下曲酸溶液即能完全抑制其生长;曲酸对沙门氏菌、假单胞菌和气单胞菌的抑制效果类似,较高质量浓度曲酸溶液能完全抑制其生长。
2.2 曲酸对菌株细胞膜的抑菌机理
2.2.1 曲酸对菌株表面疏水性的影响
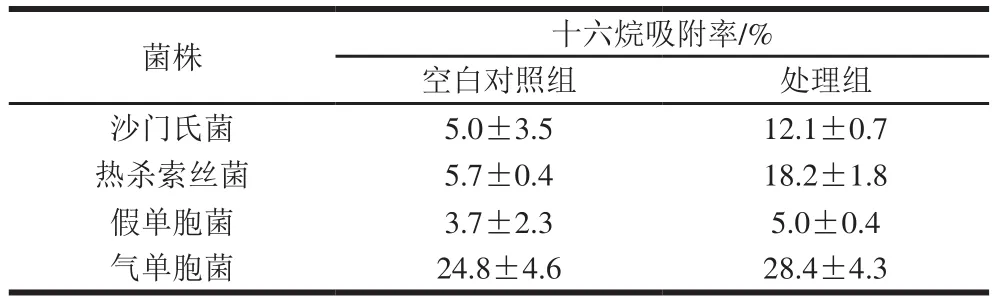
表3 曲酸对菌株表面疏水性变化的影响Table3 Effect of kojic acid on surface hydrophobicity of strains
十六烷具有较强的疏水性,且对微生物细胞无明显损伤作用[22]。通过测定十六烷对供试菌吸附率的变化判定菌体表面疏水性物质的含量变化,可以反映菌株细胞膜结构的变化情况。从表3可以看出,4 株供试菌经曲酸处理后十六烷吸附率由空白对照组的5.0%、5.7%、3.7%和24.8%分别上升至12.1%、18.2%、5.0%和28.4%。沙门氏菌和热杀索丝菌较空白对照组升高了2~3 倍,假单胞菌升高1.5 倍左右。同时可发现,由于不同微生物组成细胞膜的各物质成分及含量的不同,曲酸对不同微生物细胞膜疏水性的影响也不尽相同,如沙门氏菌和热杀索丝菌空白对照组吸附率较低,但经处理后变化幅度最高;而气单胞菌空白对照组表面疏水性物质含量最高,但曲酸处理后吸附率变化幅度较小。推测曲酸对冷鲜鸭肉中优势腐败菌的抑菌效果可能与曲酸促使菌株细胞膜上疏水物质暴露有关。
2.2.2 曲酸对菌株细胞膜渗透性的影响

表1 曲酸对菌株细胞膜渗透性的影响Table1 Effect of kojic acid on cell membrane permeability of strains
利福平及红霉素是具有疏水性功能的物质,当微生物细胞外膜遭受破坏时,其选择渗透性便会降低,导致细胞对外环境营养的吸收能力降低,从而抑制细胞的生长[26]。由表4可以看出,经过4 mg/mL曲酸处理后,热杀索丝菌和气单胞菌光密度值虽然有所下降,但不显著(P>0.05),沙门氏菌和假单胞菌光密度值显著下降(P<0.01,P<0.001)。其中红霉素和利福平组均以假单胞菌变化最为明显,由0.458和0.406分别下降至0.152和0.121 ,分别下降了66.8%和70.2%,沙门氏菌下降幅度分别为23.9%和30.7%。结果显示,曲酸处理能降低菌株细胞膜表面的选择渗透性功能,导致细胞对外环境营养的吸收能力降低,从而抑制细菌的生长。
2.2.3 曲酸对菌株胞内Ca2+、K+、Mg2+泄漏的影响
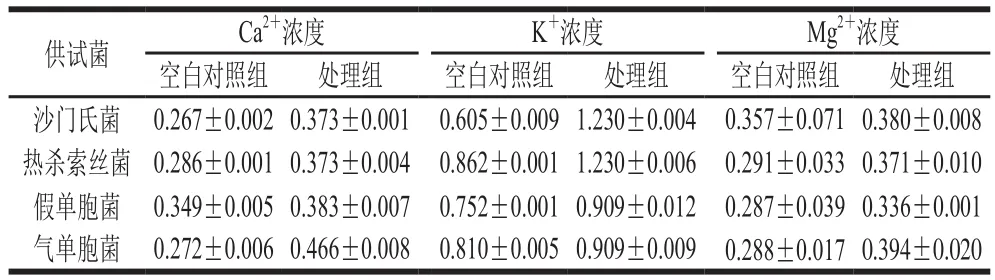
表5 曲酸对菌株细胞内Ca2+、K+、Mg2+浓度变化的影响Table5 Effect of kojic acid on changes in intracellular Ca2+, K+ and Mg2+ levels of strains mmol/L
如表5所示,经曲酸处理后,处理组培养液中3 种离子浓度均高于空白对照组。曲酸作为带正电荷阳离子多聚肽,接触菌株细胞后会造成菌株细胞膜上电荷分布不均匀,从而破坏其细胞膜结构。同时,经曲酸处理后已破损的细胞释放的胞内离子会进一步破坏培养液中的电荷平衡,从而进一步瓦解细胞。此结果与ε-聚赖氨酸损伤大肠杆菌细胞,引起大肠杆菌胞内Ca2+、K+、Mg2+泄漏的情况类似[22]。
2.2.4 扫描电子显微镜观察曲酸对菌株细胞形态的影响
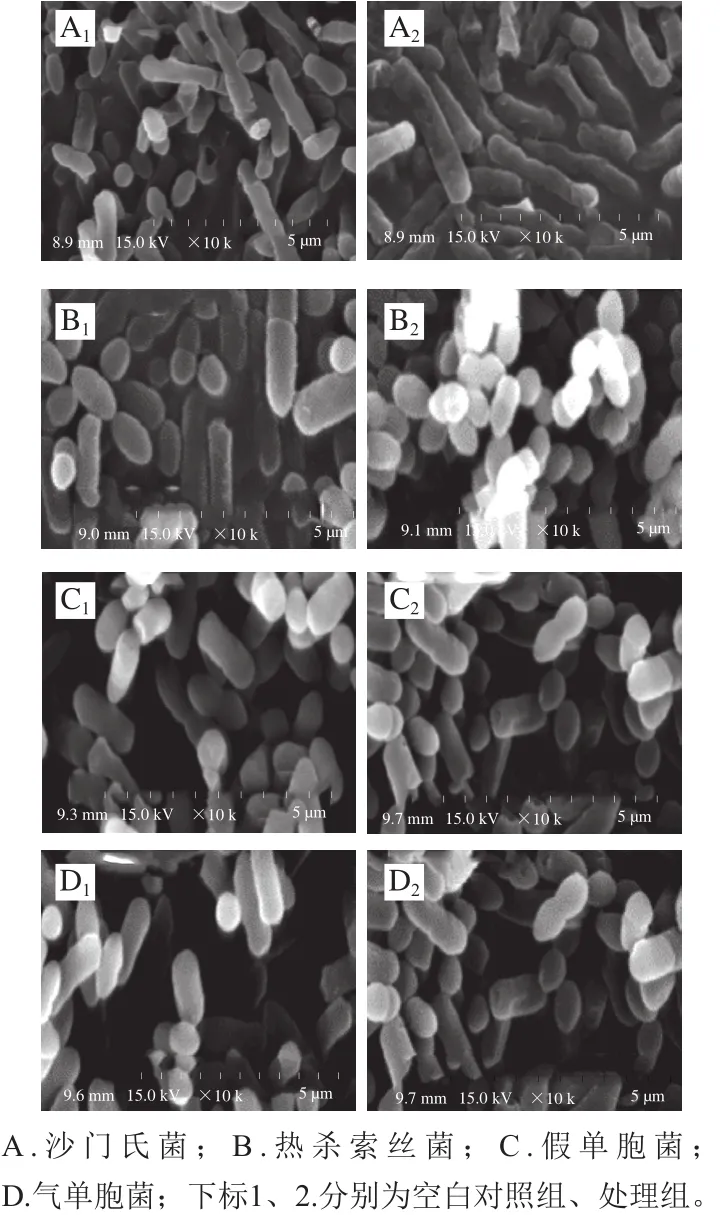
图2 菌株扫描电子显微镜图Fig.2 Scanning electron microscopic images of strains
如图2所示,各组供试菌株处理前形状规则、大小均一、光泽度良好、无破损情况。曲酸处理后,菌体不规则状数量增多、扭曲变形、表面破损严重、孔洞数量增加,同时有细胞内容物溢出后聚集成团的现象发生。反映出曲酸对菌体的细胞膜有明显的损伤作用,其抑菌效果可能与其对细胞膜的显著影响密切相关。类似的结果在Wang Chenjie等[24]研究乳酸对沙门氏菌、大肠杆菌和李斯特菌细胞膜损伤的影响中也曾报道过。
2.3 曲酸对菌株胞内物质的影响
2.3.1 曲酸对菌株呼吸链脱氢酶的影响
氯化碘硝基四氮唑最初是用于分析环境中具有细胞呼吸活力的代谢指示剂,它能被活细胞中的呼吸链脱氢酶裂解成四氮唑环,从而将水溶性的氯化碘硝基四氮唑还原为脂溶性的碘硝基四氮唑甲,并产生颜色的变化。红四氮唑晶体沉积在质膜上,可以用显微镜直接观察,也可以用有机溶剂萃取后通过分光光度计测定其溶液的颜色深浅,反映细胞总呼吸活力或电子传递链的脱氢酶活性[27]。
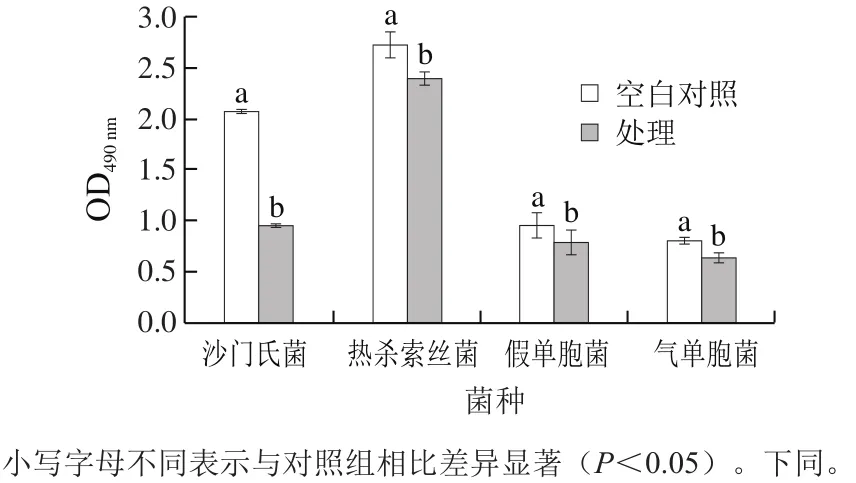
图3 曲酸对菌株呼吸链脱氢酶的影响Fig.3 Effect of kojic acid on respiratory chain dehydrogenase activity of strains
由图3可知,与空白对照组相比,处理组颜色均较浅,一定程度上说明经过曲酸处理,菌株细胞内呼吸链脱氢酶遭到了破坏,曲酸可以通过破坏呼吸链从而抑制菌株的生长。比较而言,热杀索丝菌处理组和空白对照组颜色差异较小,沙门氏菌处理组光密度值较空白对照组显著下降(P<0.05),曲酸处理对沙门氏菌呼吸连脱氢酶影响较明显,对热杀索丝菌的影响则较小。
2.3.2 曲酸对菌株胞内β-半乳糖苷酶及碱性磷酸酶的影响
碱性磷酸酶位于细胞壁与细胞膜之间,不能向外分泌到细胞外,而β-半乳糖苷酶存在于细胞膜内,正常情况下,在胞外也是不能检测到的,只有当细胞壁或者细胞膜受到外界刺激破坏时,细胞膜出现裂口,这2 种酶才会泄漏到胞外[28-29]。
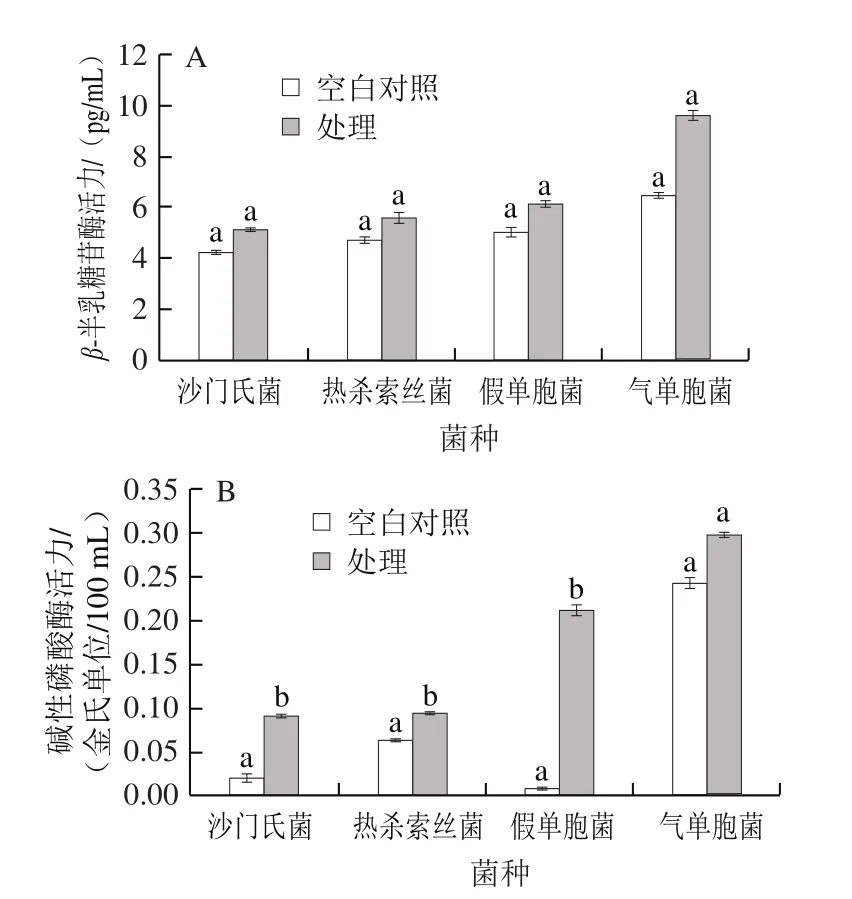
图1 曲酸对菌株菌悬液β-半乳糖苷酶(A)和碱性磷酸酶(B)活力的影响Fig.1 Effect of kojic acid on β-galactosidas (A) and alkaline phosphatase (B) activity in bacterial suspension
从图4A可看出,经曲酸处理后其胞内β-半乳糖苷酶活力有所增加,沙门氏菌、热杀索丝菌、假单胞菌和气单胞菌活力较空白对照组分别增加21.30%、17.40%、21.20%和47.40%。曲酸对菌株胞内碱性磷酸酶的影响(图4B)可看出,除气单胞菌外,其余未加入曲酸的3 组空白对照组菌液中碱性磷酸酶活力显著低于处理组(P<0.05),其中假单胞菌变化最为明显,变化量高达22.56 倍,沙门氏菌次之,为3.14 倍。以上结果表明,曲酸能破坏细胞膜、细胞壁,使内细胞内物质泄漏,从而扰乱细胞的正常生理活动,阻碍其生长,此结果与黄酒多酚、茶多酚的抑菌效果[29-31]类似。
2.3.3 曲酸对菌体蛋白的影响
蛋白质的合成分解是微生物生命活动的重要环节,蛋白质作为酶、运载体、受体及离子通道等在微生物生长代谢过程中发挥着重要作用。

图5 曲酸对菌体蛋白的影响Fig.5 Effect of kojic acid on bacterial protein
从实验结果(图5)来看,与空白对照组相比,曲酸处理6 h后,4 株菌株培养液中蛋白质量浓度均显著上升(P<0.05),其中以气单胞菌上升幅度最为明显,由0.055 g/L上升至0.159 g/L,上升至接近3 倍,沙门氏菌次之,由0.109 g/L增加至0.194 g/L,上升至接近2 倍,此结果与蔗糖癸酸酯对沙门氏菌的作用[32]类似。与空白对照组相比,经曲酸处理后4 株菌株培养液中的蛋白质差异明显,相关条带暗淡,66.4 kDa以上的大分子质量蛋白质基本消失,20.1 kDa以下富集的小分子质量蛋白质减少,其中曲酸对气单胞菌和假单胞菌的蛋白质影响更为明显,表现为大分子条带稀少,富集的小分子条带消失。整体来看,曲酸处理导致胞内蛋白质外流,使处理组蛋白质量浓度明显上升,同时干扰蛋白质的新陈代谢,阻碍大分子蛋白质的合成或加速小分子蛋白的分解。
3 结 论
曲酸对4 株菌株均具有良好的抑制作用。热杀索丝菌对曲酸处理敏感,最小抑菌质量浓度为0.5 mg/mL,液体体系下低质量浓度曲酸溶液处理即能完全抑制其生长。随着曲酸质量浓度增加,沙门氏菌、假单胞菌和气单胞菌的抑菌圈直径增加,假单胞菌和气单胞菌更加明显,其抑菌圈直径增加1 倍以上,2 mg/mL质量浓度曲酸处理在液体体系中能完全抑制3 株菌株的生长。
曲酸处理能够有效改变4 株菌株的细胞膜和相关酶的特性。曲酸处理提高了细胞膜的疏水性1~2 倍,并降低了细胞膜表面的渗透性和导致菌株细胞膜破裂,形成孔洞,增加了菌株培养液中Ca2+、K+、Mg2+离子浓度。同时,曲酸处理影响了菌株胞内酶活性,其中呼吸链脱氢酶遭到严重破坏,β-半乳糖苷酶和碱性磷酸酶等内容物质泄漏。
曲酸处理能干扰菌体蛋白质的新陈代谢,阻碍菌体细胞膜上高分子质量蛋白质的合成,并加速小分子质量蛋白质分子的分解。曲酸处理导致菌株培养液中蛋白质量浓度显著上升,菌体中大于66.4 kDa和小于20 kDa的蛋白质同时减少。

