激肽系统在ED大鼠模型阴茎组织中的表达变化研究*
王天宇 斯依提·阿木提 马文静 刘文娟 张盼盼 阿地力江·伊明**
1. 新疆医科大学基础医学院人体解剖学教研室(乌鲁木齐 830011); 2. 新疆医科大学中心实验室
勃起功能障碍(ectile dysfunction,ED)是指阴茎持续不能达到或维持足够的勃起以完成满意的性生活,是影响男性健康的常见疾病之一,其发生的直接原因是阴茎海绵体平滑肌不能充分舒张,导致海绵体静脉窦不能充分开放、充盈[1]。前期工作中,我们在对ED大鼠模型阴茎的蛋白质组学研究中发现T-激肽原显著上调,可作为蛋白候选标志物,但其作用机制不详。本研究是在此基础上,对ED大鼠阴茎组织中激肽系统的表达改变进行进一步研究,探讨ED发生发展与激肽释放酶-激肽系统表达变化的关系,及药物伊木萨克片可能的调控作用,现报道如下。
材料与方法
一、实验动物
正常雄性SD大鼠120只,体质量(200±10)g,购自新疆医科大学实验动物中心。
二、主要实验仪器
RXZ-436LD型人工气候箱(宁波江南仪器厂),BS-1105 型电子天平(北京赛多科斯天平有限公司),Eppendorf PCR仪(德国Eppendorf公司)5810R型低温离心机(德国Eppendorf公司),DYY-8C电泳仪(方正公司),微波炉(HEGON公司),GL-88B漩涡混合器(海门市其林贝尔仪器制造有限公司),低温试剂柜(中科美菱),UVP凝胶成像仪(美国UVP公司),水平脱色摇床(金坛市成辉仪器厂),Proteinsimple Fluor Chem E 化学发光凝胶成像系统(美国Proteinsimple公司)。
三、主要试剂和药物
阿朴吗啡(Apomorphine,APO,美国Sigma公司,批号:SLBP2431V),伊木萨克片(新疆和田维吾尔药业有限责任公司),miRneasy MiNi Kit试剂盒(德国QIAGEN公司,批号:154027952),M5 First Strand cDNA Synthesis Kit试剂盒(北京聚合美公司,批号:20170308),2×Taq PCR Mastermix 试剂盒(北京天根生化有限公司,批号:Q5116),EB(北京天根生化有限公司),激肽释放酶1兔多克隆抗体(Abcam公司),T-激肽原1鼠单克隆抗体(Cloud-Clone Corp 公司), BCA蛋白定量试剂盒(北京聚合美公司),羊多克隆抗兔二抗(北京中杉金桥),羊多克隆抗鼠二抗(北京中杉金桥),DAB显色试剂盒(北京中杉金桥公司),免疫组化检测试剂盒(北京中杉金桥公司)。
四、动物模型的建立与药物干预
具有正常性功能的雄性SD大鼠120只,分为正常对照组20只(N组),余100只为造模组(M组),采用环境雌激素样饮食联合冷应激建立ED模型[2]。22周后,经性行为学实验和APO阴茎勃起实验筛选出ED模型组(ED组,56只),未成ED大鼠为复合应激组(S组,44只)。从S组与ED组中分别随机抽出20只大鼠为应激用药组(S-Y组,20只)和ED用药组(ED-Y组,20只)。用药组以伊木萨克片干预,每日1次,每次250mg/kg,干预时间为2周。戊巴比妥钠麻醉后,大鼠取阴茎组织,-80℃保存。
五、RT-PCR
取50mg阴茎组织,按照miRNeasy Mini Kit试剂盒提取总RNA,Nanodrop 2000微量分光光度计测量总R N A浓度,按RT-P C R试剂盒说明书进行操作。引物序列:(1)β-actin(F 5'-TTGTAACCAACTGGGACGAT-3' R 5'-GCCAGCCAGGTCCAGACGCA-3' );(2)激肽释放酶1(F 5'-TACTACTTCGGCGAATACCTA-3'R 5'-TCCAATCCGTCAGGTGTGATG-3');(3)T-激肽原(F 5'- GCTGGTGCGAGTACAAGAAA-3' R 5'- CTATGGTGTCACGGTTGAAG-3')。循环参数:所有循环参数为94℃ 预变性3min;94℃ 变性30s;56℃ 退火30s;72℃延伸 1min;35个循环后,72℃延伸5min。琼脂糖凝胶电泳:最终的PCR产物用加入EB的2%琼脂糖凝胶电泳分离,利用UVP凝胶成像系统成像,底片用Image J软件进行分析。
六、Western-blot
用Western-blot方法检测激肽释放酶1、T-激肽原1的蛋白表达。利用RIPA裂解液提取蛋白,BCA法蛋白定量算出各蛋白浓度,加Loading Buffer沸水煮10 min使蛋白变性后-20℃保存备用,避免反复冻融。配制5%浓缩胶、12%分离胶,上样电泳2h,4℃恒压湿性电转2h。用含有TBST的5%脱脂牛奶封闭非特异性蛋白2h,加入一抗激肽释放酶1(1:500)、T-激肽原1(1:500),4℃一抗孵育过夜。次日TBST清洗后室温二抗孵育2 h,用1% TBST清洗ECL化学显影并拍照。
七、免疫组化
取材后阴茎组织用4%甲醛固定,用石蜡包埋制成石蜡切片。运用免疫组化SP法进行检测,按检测试剂盒所示步骤进行。最终结果棕黄色胞核及浅黄色胞浆为阳性细胞,蓝色胞核及无色胞浆为阴性细胞。在显微镜下(放大倍数400倍)计数阳性细胞,并按阳性范围和着色强度的乘积进行评分并统计。
八、统计学分析
采用SPSS17.0统计软件进行分析,计量资料用以均数±标准误(±s)表示,多组数据做正态检验和方差齐性检验,满足条件,采用单因素方差分析(ANOVA);如不满足条件,求出秩次进行方差分析,检验水准 α=0.05 。P<0.05有统计学差异。
结 果
一、T-激肽原1与激肽释放酶1的转录水平变化
激肽释放酶1在S组、ED组显著下调,经药物伊木萨克片干预后S-Y、ED-Y组显著上调;T-激肽原在S组、ED组显著上调,经药物干预后S-Y、ED-Y组显著下调,P<0.05(见图1、图2)。
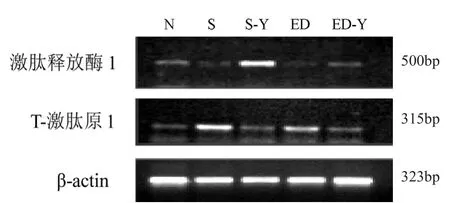
图1 各组大鼠阴茎组织 T-激肽原1与激肽释放酶1的mRNA表达变化

图2 各组大鼠阴茎组织T-激肽原1与激肽释放酶1的mRNA表达变化
二、T-激肽原1与激肽释放酶1在阴茎组织的蛋白表达
激肽释放酶1在S组、ED组显著下调,经药物伊木萨克片干预后S-Y、ED-Y组显著上调;T-激肽原1在S组、ED-组显著上调,经药物干预后S-Y、ED-Y组显著下调,P<0.05(见图3、图4)。

图3 各组大鼠阴茎组织 T-激肽原1与激肽释放酶1的蛋白表达变化

图4 各组大鼠阴茎组织 T-激肽原1与激肽释放酶1的蛋白表达变化
三、免疫组化
免疫组化结果显示激肽释放酶1、T-激肽原1在大鼠阴茎组织尿道内皮、阴茎海绵体窦及血管内皮均有表达,与正常组相比,S组、ED组激肽释放酶1表达显著降低,经伊木萨克片干预后S-Y组、ED-Y组显著升高;T-激肽原1在SED组与正常组相比表达显著升高,经药物干预后显著降低(图5,表1)。
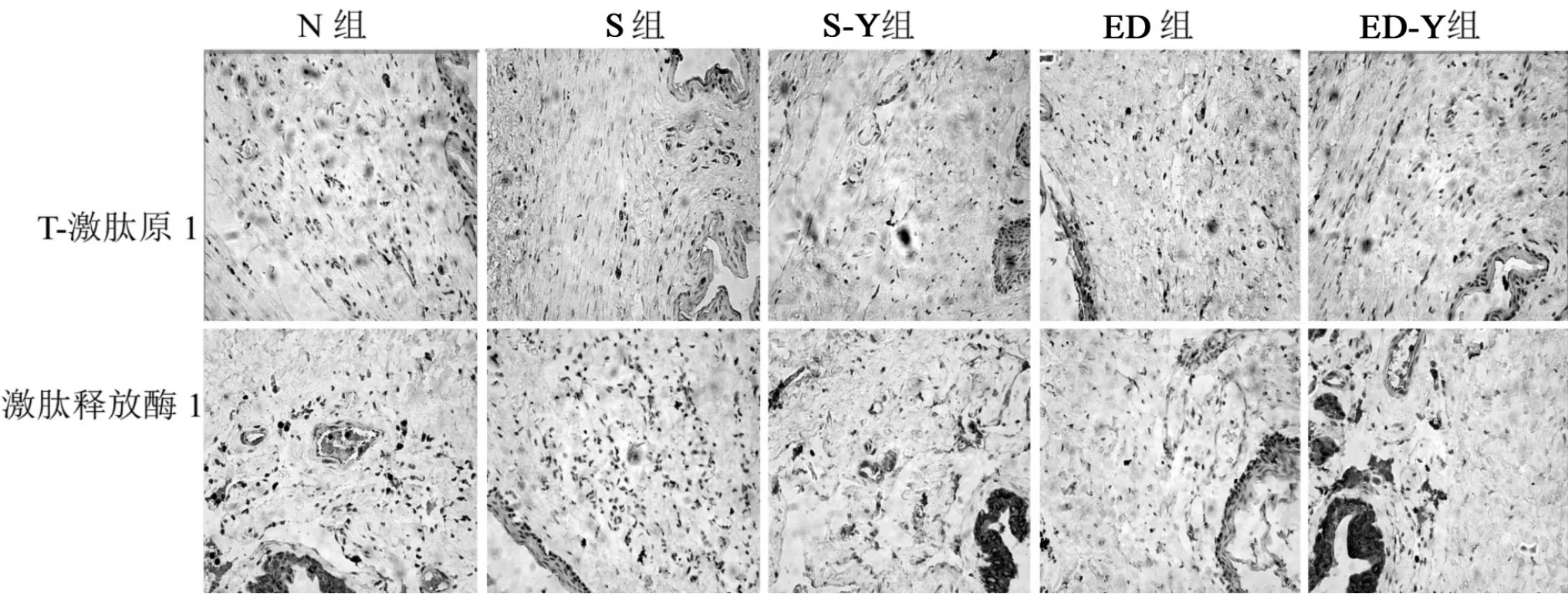
图5 各组大鼠阴茎组织免疫组化染色结果(×400)

表1 免疫组化检测大鼠阴茎组织T-激肽原1 、激肽释放酶1表达
讨 论
阴茎是高度血管化的器官,任何正常内皮细胞功能的破坏都可能影响阴茎血流量并影响勃起功能,血管疾病是ED发展的重要基础[3]。本课题前期研究发现在ED大鼠模型阴茎组织的HE染色结果显示,间质纤维化明显,伴有空泡样改变,提示水肿明显,组织中可能有炎性变化,并伴随血管内皮功能损伤,血管内皮功能障碍则是导致ED的主要原因之一。激肽释放酶-激肽系统是一个复杂的内源性多酶系统,调控心血管、神经系统等的生理功能,与心脏病、脑血管疾病、炎症反应、肿瘤等疾病的发生有密切关系。包括激肽释放酶原、激肽释放酶、激肽原、激肽及其受体[5]。研究发现激肽系统与血管内皮功能相关,可以导致血管内皮增殖、炎症反应等[5,6],从而引起血管内皮功能障碍。
T-激肽原是一种血浆糖蛋白,首先在大鼠血清中被发现,认为是急性炎症期的一种反应物,后来被发现是半胱氨酸蛋白酶抑制剂[7]。在大鼠中,有4种类型的激肽原,其中两种是经典的高分子量和低分子量的激肽原,其余两种是低分子量的激肽原,称为“第三”激肽原,命名为T-激肽原1和T-激肽原2,T-激肽原是大鼠中特有的[8]。我们在前期通过同位素标记相对和绝对定量(iTRAQ)技术结合液相二级质谱(LC-MS-MS)研究了ED大鼠模型,并获得大鼠血清候选差异蛋白,其T-激肽原在ED大鼠血清中显著上调。但T-激肽原在阴茎勃起过程中和ED发生发展中可能的作用尚不清楚。本研究显示,S组与ED组大鼠模型阴茎组织中T-激肽原1表达较N组显著增高,较S组而言ED组有增长的趋势;免疫组化结果显示T-激肽原1在海绵窦与血管内皮表达丰富,且S组与ED组表达量显著高于N组,提示T-激肽原1可能通过血管内皮增殖或炎症等反应影响内皮细胞功能并在ED发生发展过程中发挥关键作用,经药物干预后S-Y、ED-Y组大鼠T-激肽原1表达显著降低,提示伊木萨克片可能通过下调T-激肽原1的表达,对ED大鼠模型发挥治疗作用。
激肽释放酶分为血浆型激肽释放酶和组织型激肽释放酶(kallikrein, KLK),组织激肽释放酶1,属于丝氨酸蛋白酶家族,是负责激肽的产生。组织激肽释放酶裂解成低分子量激肽原从而产生血管活性肽,其通过激肽受体发挥生物学功能[9]。KLK1已被证实对阴茎海绵体平滑肌有较强的舒张效应,并且有扩张血管保护血管内皮的功能[10]。研究发现在老年ED大 鼠中KLK1表达下降,KLK1通过抑制Ras同源类似物A(RhoA )和Rho相关卷曲螺旋形成蛋白激酶1(ROCK1)/LIM激酶2(LIMK2)/丝切蛋白(cofilin)通路的激活,改善海绵体纤维化,保持完整性和效率,最终保护老年大鼠的勃起功能[11]。进一步的研究表明,增强KLK1的表达可以调节二甲基精氨酸二甲胺水解酶(DDAH)/非对称性二甲基精氨酸(ADMA)/一氧化氮/环磷酸鸟苷(cGMP)和血小板环氧化物酶2(COX-2)、 前列腺素合酶(PTGIS)/环磷酸腺苷(cAMP)途径,增加cGMP和cAMP的产生,从而改善老年性ED[12]。本研究结果发现,S组、ED组大鼠阴茎组织中KLK1表达较N 组显著降低,提示KLK1表达降低可能导致降低对平滑肌的舒张效应,并影响血管内皮功能从而导致ED的产生。而经药物干预后显著升高,与N组无显著差异,说明伊木萨克片可能通过上调KLK1的表达,从而对ED大鼠模型发挥作用。同时,我们在另一项研究中发现ED大鼠阴茎组织中RhoA/ROCK1通路发生了改变,且大鼠阴茎组织中RhoA、ROCK1的表达显著升高。结合本研究结果,我们认为,KLK1表达改变可能在ED发生发展过程中发挥了关键性的作用,并和RhoA通路改变存在着内在的关系。
综上所述,该ED大鼠模型中激肽释放酶1表达显著降低,T-激肽原表达显著升高,可能是该ED发生发展的机制之一。而激肽系统在该ED发生、发展中的具体机制还有待进一步研究。

