桔梗皂苷D协同多西他赛促进侵袭性前列腺癌细胞PC3的凋亡*
葛东升 朱丽莉 王莺语 罗 嘉 吴国胜** 冯宁翰, **
1. 南京医科大学附属无锡第二医院泌尿外科(江苏 214002)2. 江南大学无锡医学院
内分泌的去势治疗(androgen deprivation therapy,ADT)是目前前列腺癌主要的治疗方法,大多数患者早期对其比较敏感,但经过1~2年治疗后,最终会进展为去势抵抗性前列腺癌(castrationresistant prostate cancer,CRPC),这类前列腺癌预后较差,是临床治疗的难点[1]。
多西他赛(docetaxel, DTX)是半合成紫杉醇的衍生物, 也是一种典型的细胞毒性药物,具有广谱高效的抗肿瘤活性。它可通过加强微管蛋白聚合作用和抑制微管解聚作用,使细胞形成稳定的非功能性微管束,因而破坏肿瘤细胞的有丝分裂,并阻滞细胞于G2/M期,最终导致肿瘤细胞凋亡。同时,DTX可以诱导肿瘤细胞中抑制凋亡的B细胞淋巴瘤因子2(Bcl-2)磷酸化、提高游离BAX(Bcl-2 Associated X Protein, BAX)蛋白水平并最终促进细胞凋亡。DTX在1998年获美国FDA批准上市,是被FDA批准用于治疗CRPC的首个药物,以其为主的抗肿瘤药物联合治疗是目前CRPC治疗标准方案。
桔梗皂苷D(Platycodin D, PD)是从桔梗中提取的活性成分,它具有免疫刺激、抗炎、止痛、抗肥胖和抗动脉粥样硬化等功能[2-4]。还可以通过诱导细胞自噬抑制肿瘤细胞生长,如白血病、乳腺癌、肺癌、肝癌以及前列腺癌[5]。
基于上述研究基础,我们提出PD与DTX联合应用治疗非雄依赖的前列腺癌的设想。本研究选取非雄激素依赖的细胞株PC3细胞,通过体外细胞培养观察PD及DTX单独及联合应用对PC3细胞增殖和凋亡的影响,并进一步探讨其内在分子机制,以明确PD联合DTX对非雄激素依赖前列腺癌的潜在治疗效果。
材料和方法
一、材料
PD为澳门大学中华医药研究院陆金键博士馈赠,将PD粉末完全溶于二甲基亚砜,配制为20 mmoL溶液。DTX购于江苏恒瑞医药有限公司,将DTX用二甲基亚砜稀释1000倍,得到浓度为49.5 nmoL溶液。多聚ADP核糖聚合酶(poly ADP-ribose polymerase,PARP)、凋亡相关蛋白(Cleaved PARP)、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR,ser2448)、磷酸化表皮生长因子受体(p-EGFR,tyr1068)、Bcl-2、BAX、酵母Agt-6同系物(Beclin-1)、自噬相关蛋白-5(Autophagy-related protein-5,Agt-5)、微管相关蛋白1轻链3-Ⅰ/Ⅱ(microtubuleassociatedprotein1 light chain 3-Ⅰ/Ⅱ, LC3-Ⅰ/Ⅱ)以及β微管蛋白(β-tubulin)均购自美国Cell Signaling Technology公司。蛋白定量试剂盒(BCA试剂盒)购自美国Thermo Fisher Scienti fi c公司。噻唑蓝(MTT),4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)购自上海碧云天生物技术有限公司。细胞凋亡检测试剂盒(FITC-Annexin V-FITC/PI Apoptosis Detection Kit)购于美国BD pharmingen公司。
二、细胞培养
PC3购于美国模式培养物集存库(American type culture collection,ATCC),用RPMI-1640完全培养基(含10%胎牛血清,100 U/mL青霉素,100 μg/mL链霉素)培养。细胞培养条件为37℃,5% CO2,饱和湿度培养。根据细胞生长情况,每2~4天传代一次。
三、MTT法细胞增殖抑制试验
取对数生长期细胞,均匀种入96孔板,每个孔约为10 000个细胞,培养24h完全贴壁后,按照每个浓度设4个平行孔,将孔板分为4组,第四组作为对照组,先向第一、三组加入PD浓度为2.5 μmoL、5 μmoL、10 μmoL、20 μmoL、40 μmoL和80 μmoL的预配好的培养基,培养6h后, 弃去细胞上层药液,向第一组加入完全培养基,第二和第三组分别加入DTX浓度为2.5 nmoL、5 nmoL、10 nmoL、20 nmoL、40 nmoL和80 nmoL的预配好的培养基,继续培养24h,弃去培养基,加入用培养基稀释至1mg/mL的MTT溶液,放入培养基中培养4h,小心吸弃上清,向每个孔加入二甲基亚砜150 μL溶解甲臜晶体,采用BioTek Synergy H4 全功能微孔板检测仪在波长490 nm处检测各孔吸光度(OD)值,并计算药物对细胞生长的抑制率。
四、Western blot
将PD和DTX处理好的细胞用PBS洗两次,加入适量细胞裂解液,刮下细胞,移入1.5 mL EP管中,超声破碎,然后冰上孵育20min,之后于4℃,4 000×g离心20 min,取上清,得到细胞总蛋白,用BCA法测蛋白浓度,蛋白样品上样量为每孔30 μg。SDS-PAGE凝胶电泳分离蛋白,然后将分离后的蛋白电转移印迹到PVDF膜上,用5%脱脂奶粉室温封闭1h,TBST洗3次,每次10min,放入相应抗体中(体积稀释比例都是1:1000),4℃摇床上孵育过夜,TBST洗膜后,于辣根过氧化物酶(HRP)标记山羊抗兔IgG(体积稀释比例为1:2000)室温孵育1h,TBST洗3次,每次10min。然后用ECL试剂盒曝光显色。
五、DAPI 染色
将经过PD和DTX处理好的细胞吸弃培养基,PBS洗两次,每个孔加入800 μL多聚甲醛固定,10min后吸弃上清,用PBS洗两次,避光,加入配置好的DAPI溶液,并将孔板用锡纸严密包好,置于水平摇床孵育10min,用ZEISS全自动正置荧光显微镜进行荧光拍照。
六、流式细胞仪检测细胞凋亡率
将六孔板中用PD和DTX处理好的细胞全部分别收集至15mL离心管(包括上清中的细胞和PBS洗下的细胞),200×g,4℃离心5min,用预冷的PBS洗两次,于100 μL 的1×Binging Buffer中重悬,每个样品中加入5 μL 依赖性磷脂结合蛋白(FITCAnnexinV)和5 μL 碘化丙啶(propidium iodide,PI)避光染色30min,用流式细胞仪分析细胞的凋亡情况。
七、统计学方法
运用SPSS 13.0软件对实验数据进行统计学分析和检验。所有实验重复3次,多个组别间比较运用单因素方差分析(One-way ANOVN)。数据以均数±标准差(±s)表示。P<0.05被认为差异具有统计学意义。
结 果
一、PD和DTX协同抑制PC3细胞的生长
PD和DTX均能抑制PC3细胞的生长,且PD呈现出明显的剂量依赖性(图1)。在PD和DTX联合作用之后可以显著抑制PC3细胞生长。图1A为联合用药的加药方案,即在PD作用6h之后撤药,然后加入DTX继续作用24h,单独用药为PD组只加PD处理6h,DTX组只用DTX处理24h。图1B为不同浓度的PD和DTX作用于PC3,对其增殖的影响,表1显示在PD和DTX浓度分别在2.5 μmoL和2.5 nmoL,5 μnmoL和5 nmoL,10 μmoL和10 nmoL,20 μmoL和20 nmoL时联合用药对PC3细胞增殖具有协同抑制作用,且在20 μmoL PD和20 nmoL DTX联合使用时,协同作用最为显著,与PD组相比差异具有显著统计学意义(P<0.001),与DTX组相比差异具有统计学意义(P<0.05)。
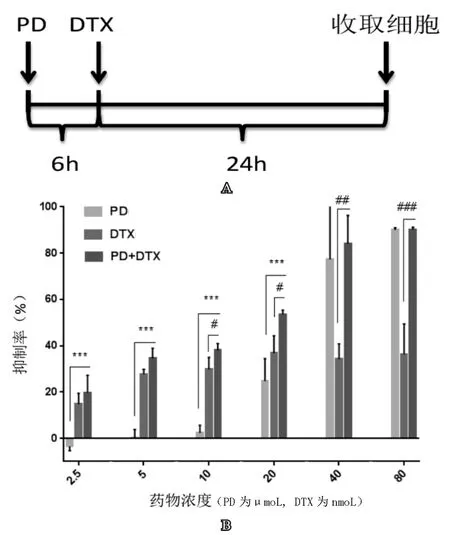
图1 比较PD、DTX单独和联合用药对PC3细胞的生长抑制作用
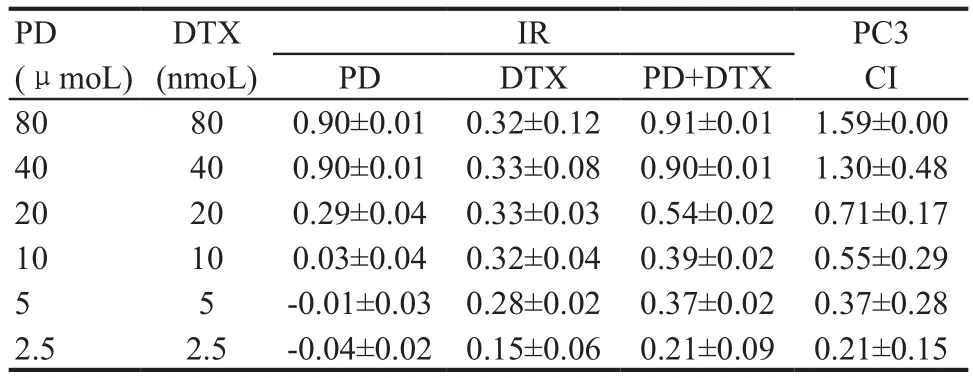
表1 PD和DTX对PC3的抑制率以及协同系数
二、 PD和DTX联合用药促进PC3细胞凋亡
PC3细胞种于六孔板中,分别以20μmoL PD处理6h,20nmoL DTX处理24h以及20μmoL PD处理6h后撤药再用20nmoL DTX处理24h,观察细胞形态学变化,进行DAPI染色,凋亡率检测,以及凋亡相关蛋白的表达情况。
观察PD,DTX和PD联合DTX,对PC3细胞形态的影响,由图2A可见,PD和DTX均可导致细胞形态发生一定程度的变化,在PD联合DTX用药中发现细
胞形态发生明显变化,绝大多数细胞由梭形变为圆形,并且内部产生空泡状结构,贴壁细胞数量也有所降低。在图2B中能观察到PD、DTX和PD联合DTX作用于PC3细胞的DAPI染色结果,DAPI作为一种DNA染料,可以检测细胞凋亡,对照组和PD组染色核形完整,染色质均匀,说明未发生凋亡;DTX组中发现少量的细胞核固缩,说明有部分细胞发生了早期凋亡;而在PD和DTX联合用药组发现细胞核进一步固缩,形成颗粒物,甚至细胞核破裂形成碎片,说明多量的细胞发生凋亡。 为进一步明确PC3细胞的凋亡率,运用流式细胞技术对PD,DTX和PD联合DTX作用过的PC3细胞进行AnnexinV和PI双染,然后运用流式细胞仪进行检测,如图2C所示,PD和DTX联合用药组凋亡率均高于PD和DTX单独用药组。并且在Western blot的结果显示(图2D),在PD和DTX联合用药组中Cleaved PARP表达量显著增高,说明PD联合DTX作用于PC3细胞可以显著增加PC3细胞凋亡。
三、PD联合DTX协同诱导PC3细胞凋亡的机制
PD可以诱导多种肿瘤细胞发生自噬[5],在图2A中,PD组细胞产生多量空泡状结构,推测PD和DTX联合使用的协同效应可能与PD诱导PC3细胞发生自噬有关,在图3A中,PD组以及PD和DTX联合用药组LC3-II表达量较其他组增多,表明在PD处理6h后PC3细胞已经发生自噬。在图3B中,DTX组和PD联合DTX组均可导致p-mTOR(ser2448)和p-EGFR(tyr1068)表达量明显减低,这可能与细胞发生凋亡的具体机制相关。
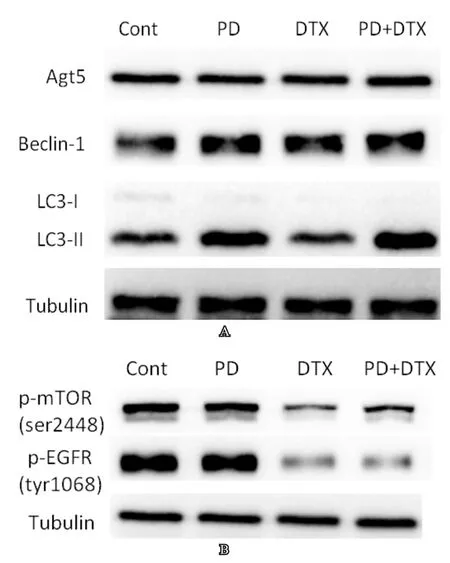
图3 PD和DTX对PC3细胞凋亡机制的探究
讨 论
前列腺癌是男性前列腺泡或导管上皮来源的恶性肿瘤,其发病率具有明显的地理和种族差异。在欧美等发达国家和地区,它是男性最常见的恶性肿瘤,其死亡率居各种癌症的第二位;在亚洲尤其是我国,前列腺癌发病率虽低于西方国家,但近年来呈显著增长且年轻化趋势[6,7]。目前认为,前列腺癌发病率的持续增高和远处转移依赖于雄激素受体传导信号,因此ADT疗法是除外科手术与放射治疗外的标准前列腺癌治疗方法,可以暂时抑制前列腺癌细胞的生长,延缓疾病的恶化进展。尽管80%~90%的早期前列腺癌患者都会对ADT治疗有效果,但几乎所有患者都会在1~2年内复发并由雄激素依赖性前列腺癌发展成高度恶化且广泛转移的雄激素非依赖性前列腺癌,使常规的ADT疗法失去效果,成为临床治疗的难点。目前临床用于治疗前列腺癌的药物虽已显示出强大的功效,但也存在一些弊端,单独用药剂量大、副作用大(如耐药性、不良反应等),而且抗癌治疗药物一般价格昂贵,大大增加了患者的医疗负担。因此,发现新的高效药物成为现阶段临床治疗亟待解决的问题。有鉴于此,本研究试图从药物协同作用入手,将传统中药有效成分与临床一线化疗药物结合,优化治疗方案,降低治疗成本,提高治疗效果,探索前列腺癌疾病新的药物治疗策略。
紫杉烷是一种典型的细胞毒药物,具有高效广谱的抗肿瘤活性,可与微管蛋白的亚基结合抑制微管动力学,诱导肿瘤细胞发生G2/M期周期阻滞[8],亦可通过激活多条信号转导通路诱导肿瘤细胞发生凋亡[9-12]。DTX是第2代紫杉烷衍生物,由欧洲红豆杉提取的非细胞毒性前体化合物10-脱乙酰基巴卡亭Ⅲ(10-DAB Ⅲ)经半合成而成,1998年获美国FDA批准上市[13]。与紫杉醇相比,DTX有更强的微管蛋白亲和力和更长的细胞内停留时间,对肿瘤细胞的破坏力更强。它有一定的靶向性和具有减少药物剂量、降低毒副作用,尤其是减少过敏反应发生的特点。然而因患者自身耐受差、药物选择性弱等原因亦导致化疗失败或复发,使其疗效欠佳。因此,为降低DTX的毒副作用,增强其疗效,寻找有效的辅助治疗药物成为亟待解决的关键问题。
桔梗,俗称气球花,是一种传统中草药,味苦、辛,平。归肺经。其主要功能为宣肺,利咽,祛痰和排脓。在中国、日本及韩国桔梗被广泛用作饮食来源以及治疗呼吸系统疾病的药物。PD是从桔梗中提取的活性成分,它具有免疫刺激、抗炎、止痛、抗肥胖和抗动脉粥样硬化等功能[2-4,14-16]。Chun等通过对人胃癌细胞(AGS)的研究表明,PD可显著性地抑制其增殖并介导失巢凋亡,这种细胞凋亡与外源性的Fas受体通路及内源性的线粒体Bcl-2家族通路有关[17];同时,PD介导的p38等应激活化蛋白激酶的磷酸化可能是其引起AGS凋亡的一个原因。Kim等通过研究人白血病细胞(U937,THP-1及K562),发现PD可在体外抑制白血病细胞的增殖,并介导其凋亡,其机制是为降低c-Myc和Spl蛋白的表达水平,并下调其与DNA的结合能力,通过Ark途径抑制hTERT的磷酸化和核转位,发挥抑制细胞增殖的作用[18];此外,Shin等报道,PD通过抑制Egr-1的活化、ROS的产生、MMP的分解,及活化Caspase-3,在诱导人白血病细胞(U937)凋亡的过程中发挥作用[19]。近年来,有许多研究表明PD在诱导细胞自噬中也发挥重要作用,如PD能够诱导人肝癌细胞BEL-7402形成脂质空泡,提高细胞内自噬标志物LC3-Ⅱ水平,使细胞自噬[20];在非小细胞肺癌中,PD可通过抑制PI3K/Akt/mTOR信号传导途径并激活JNK和p38-MAPK信号传导途径诱导自噬[21]。本研究中,在PD处理细胞6h后可以发现细胞出现了明显的自噬(图2A和图3A),符合上述文献的报道。在后续DTX处理24h后,明显促进了DTX介导的凋亡。基于此结果,我们推断PD介导的PC3自噬使细胞处于应激状态,肿瘤细胞通过自噬的作用一方面提供细胞生长的能量物质,另一方面保证细胞的存活。在此基础上,加入细胞毒药物DTX打破了细胞内部的能量平衡,使细胞更倾向于发生凋亡。在具体分子机制研究方面,我们检测了与细胞能量代谢相关的EGFR和mTOR的激活情况,发现联合用药后,进一步抑制了相关信号通路,具体机制仍需进一步阐明。
总之,通过本研究,我们揭示PD与DTX协同作用这一用药方案对诱导前列腺癌细胞凋亡的优势,进一步挖掘了传统中药中的单体化合物通过协同用药在前列腺癌治疗中的潜力,为有效医治前列腺癌提供新的药理学参考。

