麦冬皂苷D′对心肌细胞H9c2细胞的细胞毒性研究*
林芸芸,顾申红△,宋艳玲,蔡海云,谭 琰
(1.海南医学院第一附属医院,海南 海口 570000;2.海南医学院第一临床学院,海南 海口 570000)
麦冬Ophiopogon japonicus(Linn.f.)Ker-Gawl.有生津解渴、润肺止咳之功效[1],有明显的抗心肌缺血功效,化学成分含麦冬皂苷 A,B,B′,C,C′,D,D′等[2-3]。麦冬皂苷D(OPD)可通过调控细胞钙通道稳态,从而抑制氧化应激,减少心肌细胞凋亡[4];还可通过抗氧作用抑制阿霉素诱导的心肌自噬性损伤,发挥保护效应[5]。麦冬皂苷D′(OPD′)与OPD结构十分相似,然而至今对OPD′的药物毒理研究很少。本研究中探讨了OPD′对心肌细胞H9c2细胞的细胞毒性作用。现报道如下。
1 材料与方法
1.1 细胞、仪器与试药
细胞株:大鼠心肌细胞H9c2购自美国模式培养物保藏中心 (ATCC CRL-1446)。
仪器:c150型CO2细胞培养箱(德国Binde公司);SW-CJ型超净工作台(苏州净化设备公司);A10型超纯水仪(美国Millipore公司);DMI8型倒置显微镜(德国莱卡公司);MDF-C8V1型-80℃超低温冰箱(日本Sanyo公司);FC500MCL型流式细胞仪(美国Beckman公司)。
试药:DMEM培养基(批号为10569010);胰蛋白酶(批号为 25200056);EDTA(批号为 AM9260G);胎牛血清(Fetal Bovine Serum,FBS,批号为 10099141);二甲亚砜(Dimethyl sulfoxide,DMSO,批号为 D2650),均购自美国Gibco公司。麦冬皂苷D′(上海一飞生物科技有限公司,HPLC法测定,含量≥98%,批号为41753-55-3);MTS细胞毒性检测试剂盒(美国Promega公司,批号为G1780);Annexin V-FITC /PI凋亡测定试剂盒(美国Sigma-Aldrich 公司,批号为 APOAF-20TST);JC-1型线粒体膜电位检测试剂盒(碧云天生物技术公司,批号为 C2006)。
1.2 方法
细胞株培养:大鼠心肌细胞H9c2为贴壁细胞,在含有10%FBS,100 U/mL青霉素和100 g/L链霉素的DMEM培养基中,置5%CO2、37℃ 细胞培养箱中培养。待细胞生长至约90%时,弃去原培养基,用PBS轻轻吹吸1~2次,后用预热的0.25%胰蛋白酶消化、传代,平均2 d传代1次。
细胞存活率检测:将H9c2细胞用0.25%胰蛋白酶消化,制成单细胞悬液,按3×104个/孔的细胞密度均匀接种于96孔板。第2天待细胞贴壁生长后弃去培养基,用PBS洗去未贴壁细胞,加入新鲜培养基。OPD′组分别加入不同浓度(0.1,0.5,5.0,10.0 μmol/L)的OPD′,对照组则加等量不含药物的培养液。继续培养24 h后弃去上清液,每孔加MTS 20 μL和不含血清培训基 100 μL,37 ℃孵育 0.5 ~1.0 h。用酶标仪在 480 nm波长下检测各孔吸光度(A),并计算细胞存活率。细胞存活率 =1-(OPD′组 A490-校零孔A490/对照组 A490-校零孔A490)×100%。
心肌细胞凋亡能力检测:根据Annexin V-FITC/PI凋亡检测试剂盒说明书进行操作。将H9c2细胞用0.25%胰蛋白酶消化,制成单细胞悬液,按2×105个/孔的细胞密度均匀接种于6孔板。第2天待细胞贴壁生长后弃去培养基,用PBS洗去未贴壁细胞,加入新鲜培养基。OPD′组分别加入不同浓度(0.1,0.5,5.0,10.0 μmol/L)的 OPD′,对照组则加等量不含药物的培养液。继续培养24 h,弃去上清液,胰酶消化,离心,收集细胞,用250 μL结合缓冲液重悬细胞并调整细胞浓度约为1×106个/mL。向细胞悬液中依次加入Annexin V-FITC和PI溶液,混匀,室温避光孵育15 min,加入400 μL PBS,混匀后上流式细胞仪检测分析。
心肌细胞周期检测:按“心肌细胞凋亡能力检测”项下自“将H9c2细胞”至“收集细胞”同法操作,70%冷乙醇(无水乙醇以PBS配制)固定过夜,PBS洗涤2次后弃上清液,PI染液冰浴30 min,将试管置室温避光染色30 min,通过流式细胞仪分析细胞周期分布。
线粒体膜电位检测:按“心肌细胞凋亡能力检测”项下自“将H9c2细胞”至“加等量不含药物的培养液”同法操作。继续培养24 h,用JC-1染色缓冲液(1×)洗涤2次。加入2 mL细胞培养液,培养液中可以含有血清和酚红。采用流式细胞仪进行检测,设置激发波长为525 nm,发射光波长为595 nm,测定荧光强度。
1.3 统计学处理
2 结果
2.1 OPD′对心肌细胞的细胞毒性
MTS法检测OPD′对细胞的毒性见图1。随着OPD′处理浓度的增加,H9c2细胞数量呈明显下降趋势,其中5 μmol/L及以上浓度的OPD′对心肌细胞有明显的毒性作用。

图1 OPD′对H9c2细胞存活率的影响
2.2 OPD′对心肌细胞凋亡的影响
流式细胞仪检测OPD′对心肌细胞H9c2凋亡的影响。与对照组相比,OPD′5 μmol/L 组和 10 μmol/L 组凋亡率明显上升(P<0.05)。提示 5 μmol/L 及以上浓度的OPD′可诱导H9c2细胞凋亡。详见表1。
表1 OPD′对心肌细胞凋亡率的影响(±s,% )

表1 OPD′对心肌细胞凋亡率的影响(±s,% )
组别 凋亡率(%)t值P值对照组OPD′组 0.1 μmol/L 0.5 μmol/L 5.0 μmol/L 10.0 μmol/L 3.9 ±1.1 4.6 ±1.6 5.1 ±1.7 8.9 ±2.1 11.9 ±1.9 0.624 1.026 3.653 6.311 0.283 0.181 0.011 0.002
2.3 OPD′对心肌细胞周期的影响
流式细胞仪检测H9c2细胞周期发现,5 μmol/L组和10 μmol/L 组 G0/G1期所占比例分别为(48.7 ±0.3)%和(61.4 ± 0.5)%,与对照组的(32.0 ± 0.4)%比较,差异有统计学意义(P<0.01)。而 5 μmol/L 组和 10 μmol/L组G0/G1期所占比例与对照组相比,差异无统计学意义(P > 0.05),详见表 2。提示 5 μmol/L 及以上浓度的OPD′可将心肌细胞阻滞于G0/G1期,进而造成心肌细胞周期失调。
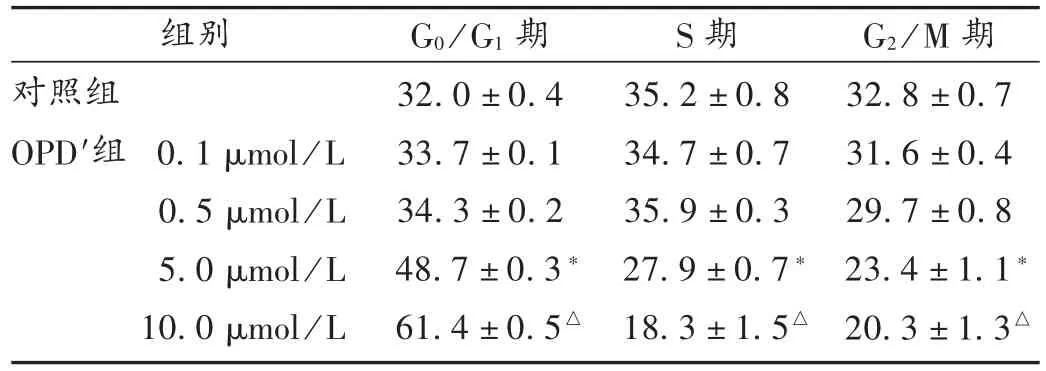
表2 OPD′对心肌细胞周期的影响(%)
2.4 OPD′对心肌细胞线粒体膜电位的影响
流式细胞仪检测OPD′对心肌细胞H9c2线粒体膜电位的影响,与对照组相比,OPD′0.1 μmol/L 组和0.5μmol/L 组细胞线粒体膜电位无明显差异(P>0.05),而 5 μmol/L 组和 10 μmol/L 组细胞线粒体膜电位明显下降(P <0.01)。详见表 3。
表3 OPD′对心肌细胞线粒体膜电位的影响(±s)

表3 OPD′对心肌细胞线粒体膜电位的影响(±s)
注:与对照组比较,*P<0.01。
组别对照组OPD′组 0.1 μmol/L 0.5 μmol/L 5.0 μmol/L 10.0 μmol/L MMP(FI)1.21 ± 0.37 0.95 ± 0.12 0.73 ± 0.21 0.41 ±0.14*0.09 ±0.03*t值P值1.157 1.954 3.503 5.226 0.156 0.061 0.012 0.003
3 讨论
本研究结果显示,OPD′浓度超过 5 μmol/L 时,H9c2细胞存活率明显下降,凋亡率明显下降,线粒体膜电位下降;且OPD′可阻滞H9c2细胞由G0/G1期进入S期,使心肌细胞周期失调。提示OPD′对大鼠H9c2细胞有明显细胞毒性,可能是通过刺激凋亡通路活化而发挥作用的。线粒体膜电位的降低,是细胞凋亡级联反应过程中最早发生的事件,是细胞早期凋亡的重要指标[6]。在凋亡信号的刺激下,线粒体的膜电位丢失,线粒体的通透性发生变化,线粒体产生三磷酸腺苷(ATP)的能力降低,无法维持其正常功能对细胞供能,细胞就会发生凋亡[7]。另一方面,热休克蛋白Hsp90作为心脏保护蛋白ErbB2的分子伴侣,可通过与ErbB2结合发挥保护心脏的作用,而ATP的减少会降低Hsp90对ErbB2的亲和力,其对心脏的保护作用也会下降[8]。可见,OPD′可能通过影响高能磷酸池对心肌细胞产生细胞毒性作用。
麦冬含多种甾体皂苷,具有抗疲劳、清除自由基、提高细胞免疫功能及降血糖的作用[9]。麦冬有镇静、催眠、抗心肌缺血、抗心律失常、抗肿瘤等作用,尤其对增进老年人健康具有多方面功效[10]。目前,对麦冬的药理活性方面的研究主要集中于其粗提物,对其中单体化合物研究较少。OPD和OPD′作为麦冬的主要成分,结构十分相似,差异仅为糖基侧链取代不同,OPD含有岩藻糖取代基而OPD含葡萄糖取代基[11]。对于OPD的研究相对较多:OPD可通过降低阿霉素诱导的活性氧簇(ROS)累积,进而缓解内质网应激而对心肌产生保护作用[4];OPD可通过抑制内质网应激及其介导的细胞凋亡通路减轻大鼠心肌细胞的凋亡[12];另外,OPD可通过降低自噬抑制血管紧张素Ⅱ诱导的心肌肥大[5]。OPD对心肌细胞的损伤、肥大均有保护作用,本研究中发现OPD′却对心肌细胞产生细胞毒性作用。OPD与OPD′同为参麦注射液成分,参麦注射液可增加机体耐缺氧能力,减少心肌耗氧量,并有保护、修复心肌细胞的作用[13-15],而其不良反应可能与OPD′的细胞毒性相关。
综上所述,一定浓度的OPD′对心肌细胞有促进凋亡作用,会干扰细胞周期,有一定细胞毒性。通过与OPD功能的对比发现,可通过优化OPD′结构的方式对药物进行改良,但OPD′的具体作用机制和其在机体内的转化机制还需要作进一步研究。

