多核铜槲皮素配合物对DNA的作用研究
王继群, 魏然茹, 宋 月, 刘俊杰, 程秀珍, 李 婧*
(1.黑龙江八一农垦大学生命科学技术学院,黑龙江 大庆 163319;2.黑龙江八一农垦大学理学院,黑龙江 大庆 163319)
槲皮素金属配合物具有较强生理活性,如,抗炎、抗病毒、抗肿瘤等[1-3]。其生理活性通常强于槲皮素单体,一方面,由于配合物溶解性很大程度改善了槲皮素本身的溶解性,另一方面,金属离子参与作用具有加强生物活性的作用[4-5]。槲皮素金属配合物抗肿瘤活性研究是热门课题之一,作用机理[6]其一为金属配合物可以插到DNA的碱基对,与DNA产生强烈的键合作用,从而影响DNA分子的内部构型,抑制了分子的遗传与复制。配合物与DNA作用主要有3种形式:非共价键作用(静电结合、插入结合和沟区结合)、共价结合、剪切作用。配合物通常采用插入和部分插入的模式与DNA作用,在一定浓度下展现裂解DNA的作用[7]。
本课题组研究发现,苯甲酸铜和新戊酸铜与槲皮素反应,具有双齿配位性能的新戊酸根和苯甲酸根,参与槲皮素铜配合物的形成,生成多种形式的配合物,推测结构如图1所示[8]:配合物1由新戊酸铜或苯甲酸铜与槲皮素反应得到,其结构与文献报道相同,配合物2为新戊酸铜与槲皮素的产物,配合物3为苯甲酸铜与槲皮素的产物。研究发现,这几个配合物具有较强的肿瘤抑制作用[8]。
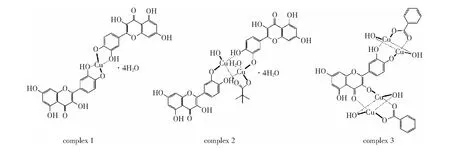
图1 配合物分子结构
本实验对这3个配合物通过紫外光谱和凝胶电泳方法研究配合物与pBR322 DNA的作用形式与裂解能力,探究3种配合物的DNA作用机制。
1 实验部分
1.1 实验仪器、试剂与药品
红外光谱使用Nicolet 380型红外光谱仪,由KBr压片法测定;凝胶成像使用美国BIO-RAD紫外凝胶成像系统分析;紫外光谱在thermo scientific紫外分光光度计上测定。
配合物参照文献方法制备[8],生化燃料溴化乙锭,EB北京博奥拓达科技有限公司;超螺旋pBR322 DNA,美国Fermentas公司;琼脂糖,Spanish公司;其他试剂均为分析纯。
1.2 配合物的合成
配合物1:槲皮素(4 mmol)溶解于热的无水乙醇(50 mL),加入新戊酸铜或苯甲酸铜(1 mmol),搅拌回流1 h,抽滤后得黑色产物。IR(KBr,cm-1):3 480 b~3 272 b,1 650 s,1 599 s,1 508 s,1 432 w,1 369 w,1 321 w,1 271 s,1 208 w,1 098 w,1 016 w,824 w,625 w。
配合物2:槲皮素(2 mmol)溶解于热的无水乙醇(50 mL),加入新戊酸铜(1 mmol),搅拌回流1 h,抽滤后得黑色产物。IR(KBr,cm-1):3 510 b~3 315 b,2 967 w,1 640 m,1 597 s,1 536 m,1 484 s,1 415 w,1 357 m,1 320 m,1 268 s,1 201 w,1 094 w,813 w,624 w。
配合物3:槲皮素(2 mmol)溶解于热的无水乙醇(50 mL),加入苯甲酸铜(2 mmol),搅拌回流1 h,趁热抽滤后得黑色产物。IR(KBr,cm-1):3 510 b~3 315 b,2 967 w,1 640 m,1 597 s,1 536 m,1 484 s,1 415 w,1 357 m,1 320 m,1 268 s,1 201 w,1 094 w,813 w,624 w。
1.3 配合物与pBR322 DNA作用的紫外光谱
用甲醇溶解槲皮素和配合物1、2、3,然后用5 mmol/L Tris-NaCl-HCl、pH值为7的缓冲液稀释至槲皮素为4.0×10-5mol/L,配合物为2.0×10-5mol/L,pBR322 DNA用Tris-NaCl-HCl缓冲液稀释至0.125 μg/μL备用。参比池中加入380 μL缓冲液,样品池中加入380 μL样品溶液,在200 nm~600 nm波长范围内扫描,再向参比池和样品池中分别加入相同体积(1 μL/次)的0.125 μg/μL pBR322DNA,共加入5 μL,然后分别测定溶液的紫外吸收光谱图。
1.4 配合物对pBR322 DNA的裂解实验
槲皮素铜配合物对pBR322 DNA的切割活性由琼脂糖凝胶电泳法测定。用DMSO将槲皮素铜配合物稀释成7个质量浓度,分别为500、250、125、62.5、31.25、15.63、3.91 μg/mL。在每个EP管中加1 μL槲皮素配合物溶液,然后,加入Tris-HCl(pH=7.4)缓冲溶液8 μL,最后,加入1 μL pBR322 DNA(0.25 μg/μL)混合,总体积10 μL;同时,设空白对照组,混合溶液放置在37 ℃恒温水浴中避光反应2 h。反应结束后,从EP管中取3 μL产物与1 μL loading buffer混合,上样到含有1.0 μg/mL溴化乙锭的0.8%琼脂糖凝胶板,使用TAE缓冲溶液,在80 V/cm电压下电泳,使用美国BIO-RAD紫外凝胶成像系统分析电泳结果。
2 结果与讨论
2.1 紫外光谱分析
金属配合物分子的特征吸收谱带会在加入DNA后发生变化。如发生插入作用,则该分子吸收光谱的吸收峰位置红移,强度减小。因为插入配体与DNA碱基对可发生π电子堆积作用,配体的π×空轨道与碱基的π电子轨道发生偶合,使能级下降导致π→π×跃迁能减小,继而产生红移。同时,偶合后的π×轨道因部分填充电子,使π→π×跃迁几率减小,产生减色效应。红移的程度和减色效应均能反映出插入能力的大小。
槲皮素和配合物1、2、3在加入DNA后紫外光谱如图2所示。槲皮素在290 nm和325 nm处有2个吸收峰,吸收峰随着DNA不断加入,强度降低,325 nm处发生红移;配合物1、2在325 nm处具有较弱的吸收峰,加入DNA后,吸收峰的强度小幅度减小,但未见明显红移;配合物3的紫外吸收谱图没有明显的紫外吸收峰,主要原因是,配合物中的槲皮素受到多个铜离子的影响,使苯环共轭效果减弱,因此紫外吸收峰不明显,但是在加入DNA后紫外吸收有降低趋势。综合上述情况,槲皮素是以插入方式与DNA作用;配合物与DNA的作用方式不是明显的插入方式,可以是插入、静电和剪切作用多种形式与DNA共同作用,进而对DNA产生裂解效果。
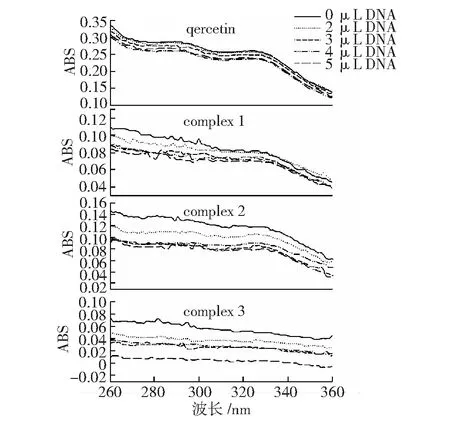
图2 槲皮素及配合物1、2、3加入DNA后紫外光谱的变化
2.2 裂解作用结果与分析
实验运用凝胶电泳法,对槲皮素及配合物1、2、3对pBR322 DNA的裂解能力做了初步研究。pBR322 DNA为超螺旋DNA,配合物在以插入方式与超螺旋质粒DNA发生作用后,会引起DNA闭环超螺旋的解旋,变成开环缺刻型,使DNA的迁移率减小,直到超螺旋消失。配合物以静电或沟区结合不会引起超螺旋的解旋。因此,解旋度是用作插入键合方式的证据之一,同时,DNA的解旋强度也反应配合物对DNA的裂解能力。
实验首先检验反应原料和产物的DNA裂解能力。如图3所示,在反应2 h后,槲皮素、新戊酸铜、苯甲酸铜3种原料未能对pBR322 DNA进行裂解,DNA保持Form Ⅰ形态;而配合物1、2、3在1.5 μg/mL时,具有明显的作用,有Form Ⅱ的DNA形成。在对配合物1、2、3的裂解作用研究中,实验使用梯度样品浓度,作用于DNA。结果如图4所示,3个配合物对DNA的裂解作用呈现浓度依赖。经过2 h的作用,在低浓度时,仅有部分裂解;在质量浓度达到1.88 μg/μL时,大部分DNA裂解。实验还表明,在同一浓度下,作用时间越长,裂解的越多。
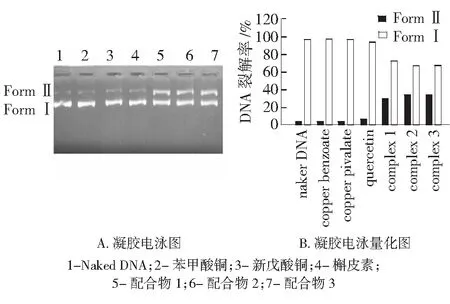
图3 化合物对pBR322 DNA裂解能力
3 结论
本文研究了新型多核铜槲皮素配合物与DNA作用形式和对DNA的裂解作用。紫外光谱法和凝胶电泳实验研究发现,配合物对DNA作用效果强于单体槲皮素。配合物通过插入、静电、剪切多种形式与DNA作用,使其具有高效的DNA断裂活性,在质量浓度为1.88 μg/μL时,作用2 h,基本全部裂解。
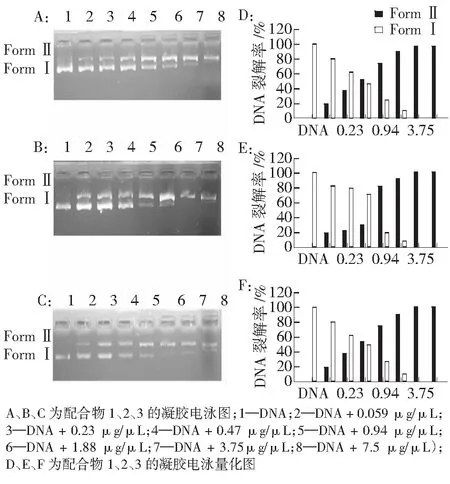
图4 配合物1、2、3在不同浓度不对pBR322 DNA的裂解能力

