小鼠癫痫模型血清谷氨酸脱羧酶抗体和TLR4水平与海马神经元损伤的关系
王正玲, 宋玉宁, 程玉清
潍坊市益都中心医院神经内科(山东潍坊 262500)
癫痫是严重影响健康和生存质量的疾病,通过动物模型研究可探讨癫痫的发病、发展及其机制,而大鼠和小鼠为其常用动物模型[1-3]。癫痫的发生发展涉及过个细胞因子,已有研究表明,谷氨酸脱羧酶抗体(GADA)和Toll样受体4(TLR4)在癫痫中的表达异常[4-5]。然而具体GADA和TLR4在癫痫及其神经元损伤中的作用尚不明确,需进一步研究证实。因此,2017年5—12月本研究建立了癫痫小鼠模型,检测了其血清GADA和TLR4水平变化并分析了其血清GADA和TLR4水平与海马神经元损伤情况的关系,具体研究结果如下。
1 材料与方法
1.1 实验动物 研究采用3月龄CD-1小鼠60只,由解放军总医院医学实验动物中心提供,均为雄性,体重20~33 g,平均(25.88±3.56)g。所有小鼠均独立饲养在22~24℃环境中,保持12 am/12 pm的明/暗周期,自由摄食和饮水,使用标准饲料由北京中兴饲料公司提供,引用纯净水由杭州娃哈哈集团有限公司提供。研究符合伦理学标准,并经本院伦理学委员会审核批注。
1.2 实验器材和试剂 氯化锂、匹罗卡品购于美国Sigma公司;乙醚购于南京沃洁特化工科技有限公司;抗GADA试剂盒购于美国Biomerica公司;TLR4正义和反义序列购于广州RIBIBIO公司;RNA提取试剂盒购于德国Qiagen公司;逆转录试剂盒购于美国Promega公司;实时定量PCR试剂盒和SYBR Premix EX Taq购于日本TaKaRa公司;离心管、玻璃瓶、吸管、试管等购于广东东普医疗科技有限公司;Synergy H1全功能酶标仪购于美国伯腾仪器有限公司;Centrifuge 5920R离心机、微量移液器购于德国艾本德公司;戊巴比妥钠购于北京普博斯生物科技有限公司;多聚甲醛购于天津市科密欧化学试剂有限公司;酒精购于上海化学试剂有限公司;BM-V1生物组织冷冻包埋机、TS-12F生物组织自动脱水机、电子天平购于孝感市电子仪器厂;RM2125切片机购于德国LEICA公司;二甲苯、二氨基联苯胺、磷酸盐缓冲液、冰醋酸AR级、枸椽酸缓冲液购于上海化学试剂有限公司;苏木精-伊红购于美国Fisher公司;过氧化氢、辣根过氧化物酶、牛血清购于北京博奥森生物公司;细胞凋亡原位检测试剂盒购于美国罗氏公司;电热恒温水浴箱HH-W420 OLABO购于山东博科科学仪器有限公司;微波炉购于中国美的公司;低温冰箱购于中国海尔公司;ANTI-MOUL光学显微镜购于日本Nikon公司;纯水仪购于美国Millipore公司;SPOT INSIGHT GOLO照相系统购于日本Olympus公司。
1.3 实验方法
1.3.1 分组和小鼠癫痫模型构建 常规乙醚麻醉后将小鼠固定,A组30只小鼠通过腹腔注射3 mEq/kg的氯化锂、10 h后腹腔注射溴化甲基阿托品10 mg/kg、30 min后腹腔注射300 mg/kg的匹罗卡品[剂型∶注射剂,规格:1 mL∶10 mg(硝酸盐)]构建小鼠癫痫模型,大鼠持续癫痫发作1 h或抽搐濒危时腹腔注射地西泮4 mg/kg,无缓解者可重复地西泮注射,最多重复注射2次所有小鼠均症状缓解,小鼠均癫痫发作Ⅳ级以上且解除症状后状态良好,成功建立小鼠癫痫模型。B组30只小鼠同期通过腹腔注射等量生理盐水建立空白对照。
1.3.2 血清样本的获取和相关指标的检测 分别在两组建模前及建模1、3 d取尾静脉血1 mL以检测血清GADA和TLR4水平,获得的血液标本以3 500 r/min、3.5 cm半径离心、4℃中离心5 min,待分层后取上层血清常规冷藏待测。血清GADA水平检测采用酶联免疫吸附法,具体检测操作根据酶标仪以及相关试剂盒说明书要求进行。血清TLR4水平检测采用RT-PCR法,具体检测操作见参考文献[6]。
1.3.3 海马神经元损伤情况的检测 建模3 d后向小鼠腹腔注射40 mg/kg的1%戊巴比妥钠麻醉,随后迅速进行断头以处死小鼠,掀开颅骨暴露脑组织,剥离大脑皮层以显露海马组织,游离其相邻组织并迅速取出海马组织,采用4%多聚甲醛固定1 d,流水冲洗1 h后梯度酒精脱水,并常规行石蜡包埋,切制成厚度为3 μm的连续切片待测。常规行HE染色观察海马神经元细胞变化。并通过TUNEL染色法检测观察海马神经元损伤状况,具体检测操作见参考文献[7]。显微镜下观察细胞,细胞核染色,结合染色为棕黄色颗粒为TUNEL阳性以及细胞的形态特征确定凋亡细胞,在400高倍显微镜下观察,每个检测样本随机观察5个不重复视野,计算单位面积内TUNEL细胞数,统计神经损伤状况以及凋亡神经元数。
1.4 评价方法 癫痫发作分级[8]:根据惊厥发作情况分为0~Ⅴ级,其中0级为未表现出发作迹象,Ⅰ级为出现头面部痉挛,Ⅱ级为出现节律性点头或湿狗样抖动,Ⅲ级为前肢阵挛但无后肢站立,Ⅳ级为后肢站立且全身强直惊厥,Ⅴ级为后肢站立伴摔倒,且出现全身强直-阵挛。
1.5 统计学方法 采用SPSS 22.0统计软件,计量资料均符合正态分布并采用两独立样本均数t检验进行组间比较,Pearson线性相关分析法分析小鼠癫痫模型血清GADA和TLR4水平与其海马神经元坏死的关系,P<0.05为差异有统计学意义。
2 结果
2.1 两组建模前后血清GADA和TLR4水平比较 两组建模前血清GADA和TLR4水平比较差异无统计学意义(P>0.05)。与B组比较,A组建模1 d和建模3 d的血清GADA和TLR4水平均升高,差异有统计学意义(P<0.05)。B组建模前后血清GADA和TLR4水平比较差异无统计学意义(P>0.05)。与建模前比较,A组建模1 d和建模3 d的血清GADA和TLR4水平均升高,且A组建模3 d的血清GADA和TLR4水平高于其建模1 d,差异有统计学意义(P<0.05),见表1。
表1两组建模前后血清GADA和TLR4水平比较

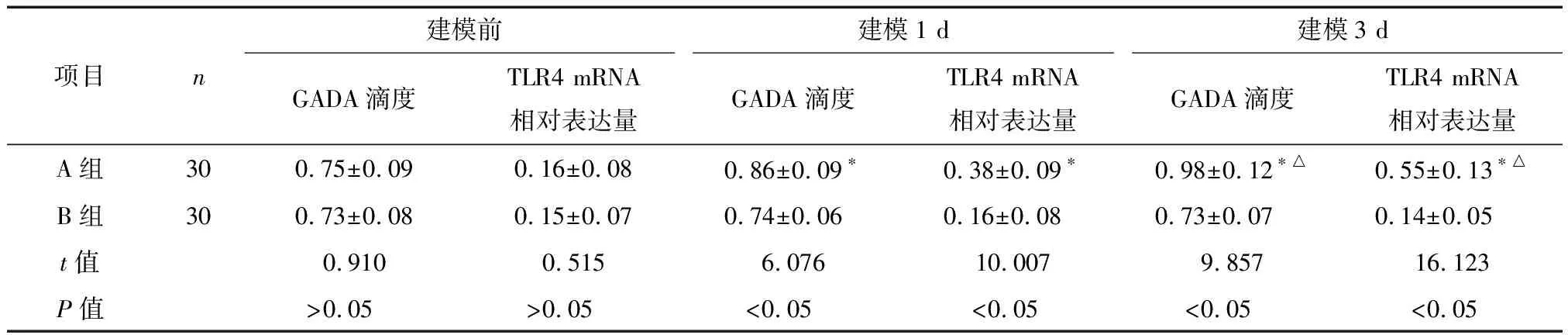
项目n建模前建模1 d建模3 dGADA滴度TLR4 mRNA相对表达量GADA滴度TLR4 mRNA相对表达量GADA滴度TLR4 mRNA相对表达量A组300.75±0.090.16±0.080.86±0.09∗0.38±0.09∗0.98±0.12∗△0.55±0.13∗△B组300.73±0.080.15±0.070.74±0.060.16±0.080.73±0.070.14±0.05t值0.9100.5156.07610.0079.85716.123P值>0.05>0.05<0.05<0.05<0.05<0.05
*与同组建模前比较P<0.05;△与同组建模1 d比较P<0.05
2.2 两组海马神经元损伤情况以及凋亡神经元数比较 B组均未见海马神经元损伤,海马神经元排列整齐紧密,细胞浆透明,细胞核呈圆形且核仁清晰,细胞形态正常。A组所有大鼠均出现不同程度的海马神经元损伤,神经元排列出现散乱,细胞边缘欠清晰,核固缩,胞体浓缩,部分胞浆红染。B组凋亡神经元少量。A组凋亡神经元数在25.44~37.28 Nr/5F,平均(31.15±6.88)Nr/5F。见图1。

图1 两组海马神经元的病理图(×400)
2.3 A组凋亡神经元数<31.15 Nr/5F与≥31.15 Nr/5F建模前后的血清GADA和TLR4水平比较 A组凋亡神经元数<31.15 Nr/5F与凋亡神经元数≥31.15 Nr/5F鼠建模前血清GADA和TLR4水平比较差异无统计学意义(P>0.05)。与A组凋亡神经元数<31.15 Nr/5F比较,A组凋亡神经元数≥31.15 Nr/5F建模1 d和建模3 d的血清GADA和TLR4水平均升高,差异有统计学意义(P<0.05),见表2。


凋亡神经元数(Nr/5F)n建模前建模1 d建模3 dGADA滴度TLR4 mRNA相对表达量GADA滴度TLR4 mRNA相对表达量GADA滴度TLR4 mRNA相对表达量≥31.15180.76±0.090.17±0.090.92±0.110.45±0.121.05±0.130.67±0.12<31.15120.74±0.070.15±0.060.77±0.080.28±0.050.88±0.090.37±0.09t值0.6490.6744.0534.6263.9347.372P值>0.05>0.05<0.05<0.05<0.05<0.05
2.4 小鼠癫痫模型血清GADA和TLR4水平与其凋亡神经元数的关系分析 Pearson相关分析结果显示,小鼠癫痫模型血清GADA和TLR4水平与其凋亡神经元数均呈正相关(r=0.822、0.879,P<0.05)。
3 讨论
近年来,各类原因导致癫痫的发生不断增加,已成为严重威胁人类健康的疾病。作为慢性神经系统病症,癫痫的治疗困难,而且治疗可反复发作,病程长,可给患者带来明显的经济负担和精神负担,影响其生存质量[9-10]。因此,对癫痫的机制进行研究,从而指导临床采取措施和开发药物以控制癫痫病情具有重要意义。而癫痫的发生和发展机制目前主要通过动物实验进行研究[11]。成功建立动物模型为癫痫研究的重要环节,本研究通过腹腔注射匹罗卡品法构建小鼠癫痫模型的结果显示,研究所有小鼠的癫痫发作Ⅳ级以上,建模成功,腹腔注射匹罗卡品法为构建小鼠癫痫模型的有效方法。癫痫不但在发作时可对患者造成明显的影响,其相关神经元损伤亦是其影响患者的重要因素[12]。海马为癫痫最敏感脑区之一,临床已有多个研究证实癫痫患者可存在海马神经元损伤的发生[13]。本研究亦建立了小鼠癫痫模型以观察其海马神经元损伤状况,本研究结果显示,癫痫小鼠均出现不同程度的海马神经元损伤,神经元排列出现散乱,细胞边缘欠清晰,核固缩,胞体浓缩,部分胞浆红染,而凋亡神经元数在25.44~37.28 Nr/5F,平均(31.15±6.88)Nr/5F,其神经元凋亡率高,海马神经元损伤严重。预防和改善癫痫患者海马神经元损伤病情为其治疗的重要环节。
癫痫的发生、发展涉及多个机制,对其各机制相关因子进行检测可能有助于了解其病理机制而指导临床干预。GADA为与自身免疫密切相关因子,而癫痫与自身免疫异常相关,因此GADA与癫痫亦具有一定的关系,这一点已得到临床研究认可[14]。亦有研究证实免疫炎症在癫痫发生、发展中具有明显的促进作用,而TLR4可促进炎症反应,其与癫痫的关系亦得到了多个研究的认可[15-16]。然而目前关于GADA和TLR4与癫痫患者的海马神经元损伤具体关系仍有待进一步研究证实。本研究检测了小鼠癫痫模型的血清GADA和TLR4水平,本研究结果显示小鼠癫痫模型血清GADA和TLR4水平均较高,而随着建模后时间的延长,小鼠血清GADA和TLR4水平进一步升高,进一步证实GADA和TLR4与癫痫发生、发展相关。而本研究中凋亡神经元数≥31.15 Nr/5F小鼠建模1 d和建模3 d的血清GADA和TLR4水平高于其凋亡神经元数<31.15 Nr/5F小鼠,提示其血清GADA和TLR4水平与海马神经细胞凋亡状况可能相关。进一步的Pearson相关分析结果显示,小鼠癫痫模型血清GADA和TLR4水平与其凋亡神经元数均呈正相关,小鼠癫痫模型血清GADA和TLR4水平的检测可能有助于辅助评估其海马神经损伤状况,而采取措施控制炎症反应和提高免疫力可能为改善癫痫疗效和防治其神经元损伤的重要措施。
综上所述,小鼠癫痫模型血清GADA和TLR4水平与其海马神经元损伤具有明显的相关性,可能用于其海马神经元损伤评估以指导临床防治癫痫海马神经元损伤,减少其海马神经元损伤相关认知功能损伤和治疗支出,提高癫痫治疗水平。

