PPP2R5C小干扰RNA的安全性分析*
沈琦, 周继豪, 张睿婷, 张新友
深圳市人民医院、暨南大学第二临床医学院血液内科(广东深圳 518020)
肿瘤治疗基因药物是近10年来国内外研究的重点之一,主要包括反义核酸和siRNA。通过基因芯片、高通量测序等方法寻找肿瘤细胞株或原代细胞高表达基因,通过多疾病综合分析筛选特异基因,设计相应的反义核酸或特异干扰性小分子RNA(small interfering RNA,siRNA),再利用多种实验方法筛选有效高效的片段[1-4]。由于转染反义核酸或特异siRNA能特异地沉默目的基因,且作用具有高效性和高特异性的特点,使RNA干扰成为肿瘤治疗领域中的新希望。PPP2R5C是蛋白磷酸酶2A(protein phosphatase 2A,PP2A)的一个亚单位,在调节细胞增殖和细胞转化中起重要作用,许多细胞的活动过程是依赖于关键调节蛋白的磷酸化状态。PPP2R5C作为PP2A重要的一个亚单位,其表达模式变化或基因突变等可能影响了正常细胞的增殖或导致细胞的恶性转化等[5-6]。我们前期研究发现通过PPP2R5C-siRNA下调PPP2R5C基因,对慢性髓细胞白血病(CML)细胞(K562细胞株及伊马替尼耐药的K562R细胞株)、Jurkat细胞均产生明显的增殖抑制和凋亡增加等影响[7-8],即对慢性粒细胞白血病及T淋巴白血病细胞的恶性克隆起到抑制作用,若能应用于临床,需验证PPP2R5C-siRNA安全性,目前对其安全性的分析还少见报道。故2013年5月至2017年5月,本研究拟分析核转染PPP2R5C后,CML细胞株单个细胞形态学改变以及健康人骨髓单个核细胞体外增殖、分化的情况,初步证明PPP2R5C-siRNA安全性。
1 材料与方法
1.1 材料
1.1.1 标本 K562细胞株(人慢性髓原白血病细胞,购自上海细胞库,本科室保存),经细胞形态学、细胞化学及细胞免疫学排除血液系统相关疾病的健康人3例,年龄25~41岁,中位年龄33岁。
1.1.2 主要试剂 TRIzol试剂盒购自美国Invitrogen公司,随机引物和反转录酶试剂盒PowerScriptTMReverse购自美国Becton Dickinton公司,Real Master Mix试剂盒购自北京Tiangen公司。注射用重组人促红细胞生成素(EPO)购自深圳赛保尔制药有限责任公司,注射用重组人促血小板生成素(TPO)购自沈阳三生制药有限责任公司,重组人IL-3、干细胞因子(SCF)购自美国Gibco公司,注射用重组人粒-单核细胞集落刺激因子(GM-CSF)购自厦门特宝生物工程股份有限公司,Suspension cell lines NucleofectorTMKit 购自德国Amaxa公司。
1.1.3 主要仪器 原子力显微镜购自Olympus公司,PCR扩增仪购自德国Biometra公司,荧光实时定量PCR仪为美国BIO-RAD公司产品。
1.2 方法
1.2.1 PPP2R5C-siRNA的设计、合成及工作液的配置 在Invitrogen公司网站设计目的基因不同序列的siRNA[7]。
1.2.2 原子力显微镜检测细胞形态
1.2.2.1 样品制备 分别取转染72 h后不同实验组(siRNA:转染PPP2R5C-siRNA的K562细胞;MOCK:空转的K562细胞;NC:未经处理的K562细胞)的细胞,甲醛固定,室温自然干燥。
1.2.2.2 原子粒显微镜(AFM)成像及力谱测量 选用100 μm扫描器,UL20B硅探针,力常数为2.8 N/m[9]。
1.2.3 骨髓单个核细胞(BM-MNCs)的分离 应用淋巴细胞分离液,具体方法同单个核细胞提取。
1.2.4 核转染正常人BM-MNCs 按照Amaxa公司推荐的方法,收集正常人BM-MNCs达到4×106,用NucleofectorTMSolution和Supplement以9∶2配得的混合液悬浮细胞。将细胞及1 μg siRNA加入核转杯,选择对应的程序,程序完成后立刻用专用的移液管将转染后的细胞液转移至12孔板中。
1.2.5 荧光实时定量PCR检测各组PPP2R5C基因mRNA表达水平 (1)分别收集 K562组(K562细胞株)、MNC组(健康人骨髓单个核细胞)及转染PPP2R5C-siRNA至健康人骨髓单个核细胞 24 h的MNC-siRNA组、空转组(MNC-MOCK)的细胞,提取RNA,合成cDNA。(2)荧光实时定量PCR应用Real Master Mix试剂盒。总反应体系20 μL,具体反应条件为95 ℃ 10 s,55℃ 30 s,81℃读板。(3)采用相对定量法分别分析PPP2R5C基因相对mRNA的表达水平,以β2M为内参,利用Ct值,计算PPP2R5C基因相对mRNA表达量,其计算公式为:相对mRNA表达量=2-△Ct×100%,其中,△Ct=Ct(PPP2R5C)-Ct(β2M)。
1.2.6 红细胞集落形成能力(BFU-E)、粒细胞巨噬细胞集落形成能力(CFU-GM)和巨核细胞集落形成能力(CFU-Meg)检测
1.2.6.1 种板 24孔板培养板,分转染PPP2R5C-siRNA的健康人骨髓单个核细胞组(siRNA)及空转的健康人骨髓单个核细胞组(MOCK),BFU-E、CFU-GM、CFU-Meg各3孔,每孔0.5 mL体系,其中,125 μL的甲基纤维素,BFU-E(细胞因子应用EPO,终浓度30 IU/mL)、CFU-GM(细胞因子应用GM-CSF,终浓度10 ng/mL)、CFU-Meg(细胞因子应用TPO,终浓度50 ng/mL)。此外,细胞因子SCF(终浓度30 ng/mL)、IL-3(终浓度100 IU/mL)。新生牛血清(终体积百分数15%),RPMI 1640培养基补足体系。
1.2.6.2 计数 14 d后在显微镜下观察计数,BFU-E计数标准为>50个细胞计为1个集落,CFU-GM计数标准为>40个细胞计为1个集落,CFU-Meg计数标准为>3个细胞计为1个集落。
1.3 统计学方法 采用SPSS 11.5统计软件,组间比较选用多个样本均数间两两均数比较的S-N-K(q检验);不同样本中PPP2R5C基因mRNA水平的比较采用非参数检验中的多样本比较的秩和检验(H值检验);健康人BM-MNCs体外诱导分化的比较采用两样本t检验。检验水准均为:α=0.05。P<0.05为差异有统计学意义。
2 结果
2.1 AFM观察各组细胞微观形态学变化 利用AFM观察转染后72 h细胞,所有细胞均呈椭圆形,见图1。与各对照组相比,干扰组细胞高度和直径有所减小,但各组间的差异无统计学意义(P>0.05)。见表1。
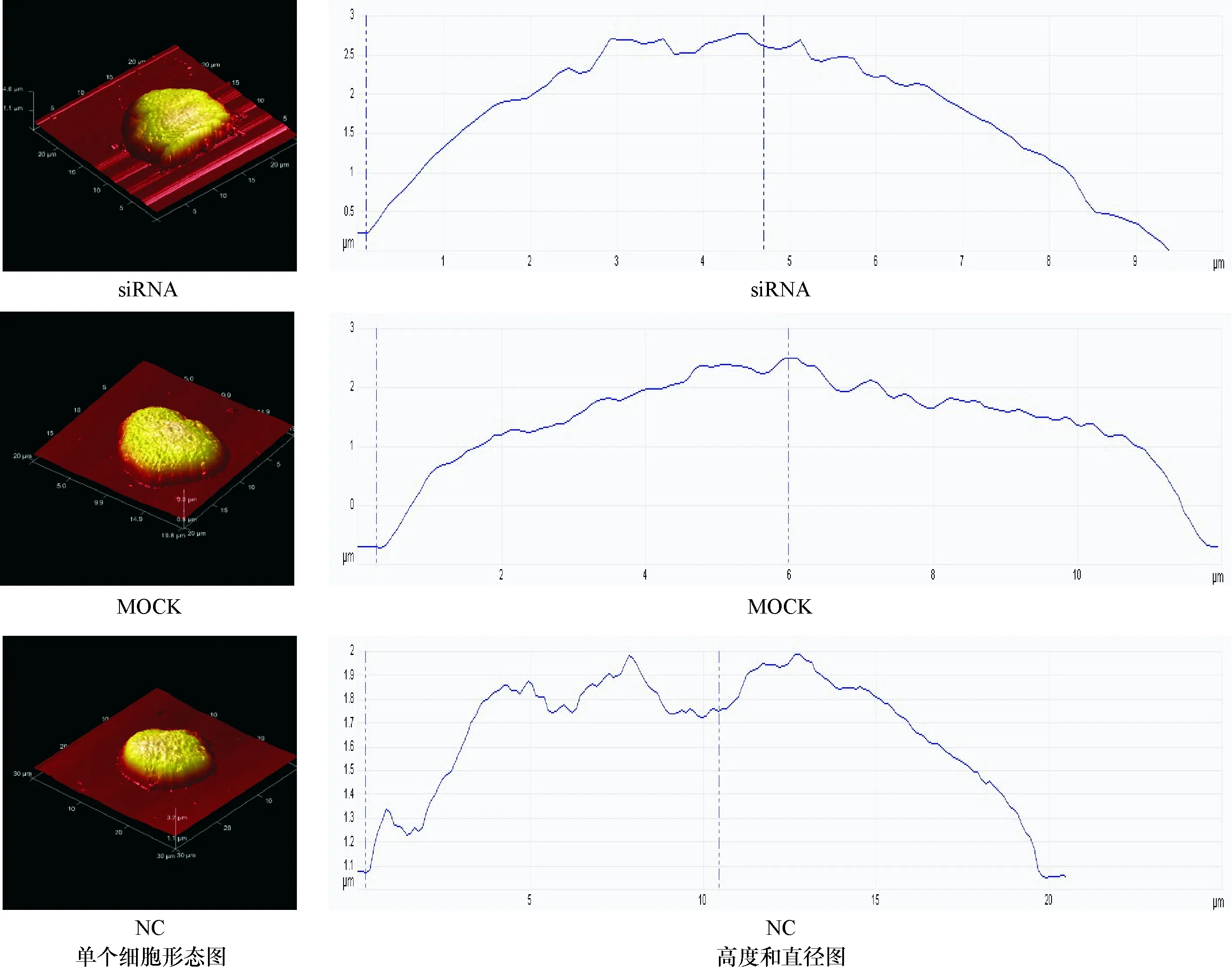
siRNA:干扰组,MOCK:空转组;NC:阴性对照
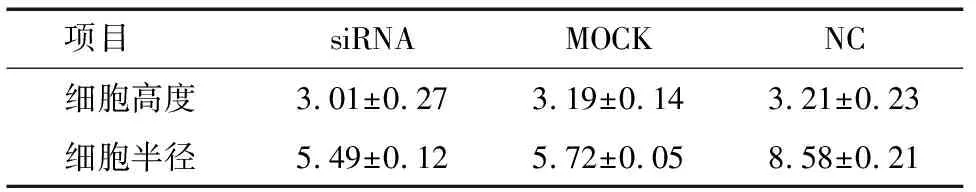
项目 siRNAMOCKNC细胞高度3.01±0.273.19±0.143.21±0.23细胞半径5.49±0.125.72±0.058.58±0.21
2.2 健康人BM-MNCs中PPP2R5C基因表达情况 3例健康人BM-MNCs中的PPP2R5C基因表达(6.839±1.342)%明显低于K562(34.215±3.756)%,差异有统计学意义(P<0.05);转染前(MNC)后(MNC-siRNA)(4.704±1.862)%以及与空转组(MNC-MOCK)(4.887±2.235)%对比BM-MNCs中PPP2R5C基因表达量无明显变化。见图2。
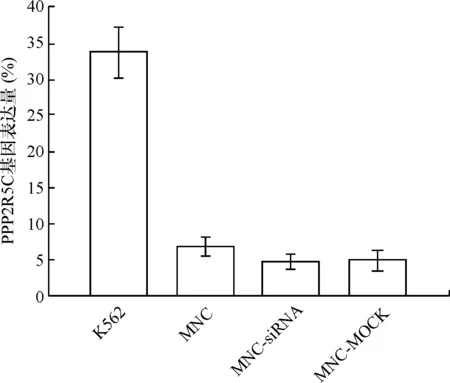
图2转染前后健康人BM-MNCs及K562中PPP2R5C基因的表达水平
2.3 健康人BM-MNCs体外BFU-E、CFU-GM和CFU-Meg形成情况 PPP2R5C-siRNA转染、种板后14 d,健康人BM-MNCs体外BFU-E(116±22)、CFU-GM(168±18)、CFU-Meg(76±5)的形成与MOCK对照组(123±14、177±11、84±7)比较差异无统计学意义(P=0.723、0.826、0.448),各组集落图及计数结果分别见图3、4。
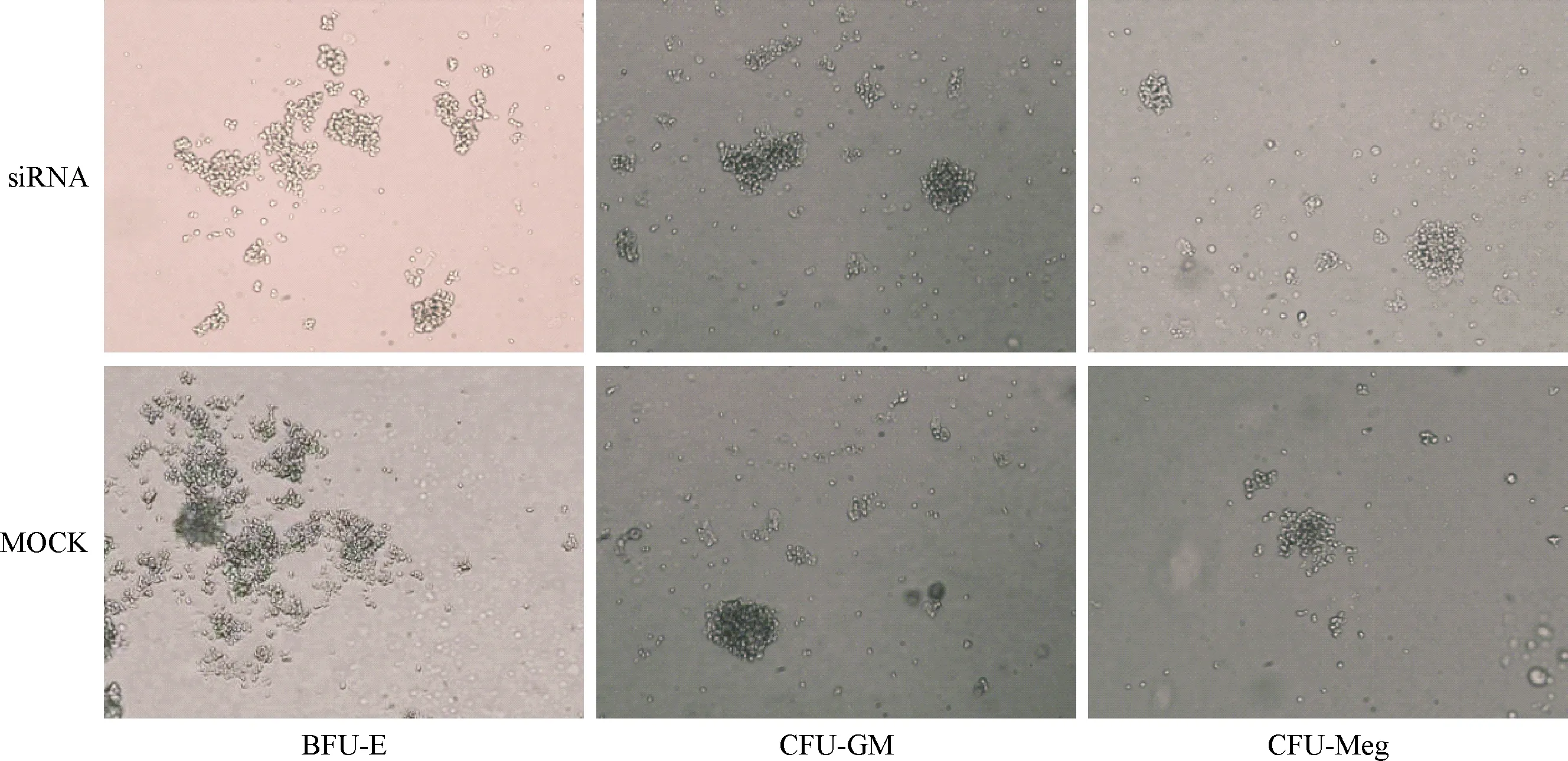
图3 1例健康人BM-MNCs体外诱导分化图(14 d 倒置显微镜,种板密度2×105)

图4 体外诱导14 d各组BFU-E、CFU-GM、CFU-Meg形成情况
3 讨论
近年来,恶性肿瘤的治疗领域已开启了针对患者个体基因组学的靶向治疗和个体化治疗新时代。RNA干扰能高效特异沉默靶基因,已成为肿瘤靶向治疗的一种革命性的新手段[10]。RNA干扰通过病毒性载体或非病毒载体转染入某种细胞中,通过CCK8、实时定量PCR、Western blot等方法来认识目的基因的功能。病毒性载体与非病毒性载体相比,具有目的基因转染效率高、基因表达稳定持久等优点,其局限性体现在病毒载体存在生物安全性问题,逆转录病毒可能与靶细胞基因组随机整合,而且只能感染分裂期细胞等问题。非病毒性表达载体目前主要通过电穿孔和脂质体介导等方法,但不同类型细胞对外源DNA的摄取能力有所不同,因而此方法对于悬浮细胞和原代细胞转染效果较差。
本研究采用的是德国Amaxa公司所推出的NucleofectorTM核转染方法,是一种新的非病毒载体的转导方式,该技术针对不同细胞有推荐的高转染效率或高细胞活性的方法代码转染试剂和转染缓冲液,在核转仪上输入代码即可完成转染过程[11-12]。转染试剂和转染缓冲液能增强细胞膜通透性,转染启动时瞬时的电流能同时穿透细胞膜和核膜,直接将外源核酸同时输送到细胞浆和细胞核内。此技术既无生物安全性问题,而且解决了因受到细胞分裂限制而一直困扰人们的原代细胞的低效率转染,特别适用于难转染的悬浮细胞系和原代细胞[13]。这项技术具有低毒性和高转染效率,可以使转基因的细胞表现出较强的活力,外源基因在细胞内稳定表达。我们的前期研究将PPP2R5C小干扰RNA转染至K562、K562R 及Jurkat细胞[7-8],已检测细胞转染效率>80%,同时细胞在后续72 h保持良好的生物活性。我们在转染效率检测时设立转染条件的对照组(Mock transfection),对比转染试剂、电流刺激对细胞的影响。
AFM把形态学与客观数据结合,能在单细胞层面上对细胞超微结构进行探测分析,从而可以捕捉到精准的细胞本质特征,发现影响因素作用后对细胞的细微改变[14]。从AFM的形态微观结构检测结果上看:转染了PPP2R5C基因72 h后的细胞高度、直径均减少,体积变小,提示这可能是PPP2R5C基因促进CML细胞的凋亡的表现。在本研究中,我们每组扫描了3个细胞,结果提示各组间存在变化的趋势,但数值上的比较差异无统计学意义。这说明PPP2R5C基因下调可能对K562细胞形态学未造成明显影响。
本研究结果显示健康人BM-MNCs中PPP2R5C基因的表达量明显低于K562细胞株,结合我们的前期研究结果[7,15],即PPP2R5C基因在CML细胞中高表达、健康人外周血单个核细胞及健康人BM-MNCs中低表达的特点。因此,选择健康人BM-MNCs作为研究对象,希望能够了解PPP2R5C-siRNA的安全性。本研究采用PPP2R5C-siRNA 干扰组和转染条件的MOCK对照组比较,以排除转染条件对PPP2R5C-siRNA 作用的干扰。结果表明:PPP2R5C-siRNA对健康人BM-MNCs的体外增殖和分化无显著影响,初步说明其安全性。我们推测PPP2R5C基因在健康人BM-MNCs中的增殖和分化中可能并未发挥明显作用。
因此,单独沉默PPP2R5C基因未对CML细胞株的形态产生明显影响,亦未影响BM-MNCs的增殖和分化。本研究分析和证明PPP2R5C小干扰RNA的安全性问题,为CML的靶向治疗提供新资料。

