结直肠癌SOS1、K-ras共表达对预后的影响*
曹建, 万相斌, 杜记涛, 赵卫杰, 陈广龙, 赵智力, 董志闯, 孙淼淼, 李智△
郑州大学附属肿瘤医院 1普外科, 2病理科(河南郑州 450000)
最新调查结果显示中国结直肠癌发病率从2003年的12.8/10万,上升到2011年的16.8/10万,病死率从5.9/10万上升到7.8/10万[1]。K-ras蛋白是由KRAS基因编码的一个质量为21 kD小分子蛋白质,KRAS基因是一个原癌基因,目前研究发现在肺癌、胰腺癌以及结直肠癌等实体肿瘤中均发现K-ras蛋白的异常激活[2]。对于结直肠癌传统化疗的研究目前已经进入瓶颈,难以进一步改善结直肠癌患者预后。近两年来随着精准医疗,个体医疗理念的提出及发展,对于发现肿瘤有效的治疗靶点,筛选适合个体化治疗的患者显得至关重要。直接靶向K-ras蛋白是一种治疗结直肠癌可靠的手段,但是直接靶向K-ras蛋白难度较大,因为K-ras蛋白和GTP结合的比较紧密,而且二者经常处于一种结合状态,而且K-ras的活性位点缺乏像口袋一样的药物结合区域[3],所以目前对于直接靶向K-ras蛋白的的研究结果并不乐观,多个针对靶向ras蛋白的分子药物的Ⅲ期临床实验表明并没改善患者的总生存期,结果并不理想[4-6]。K-ras蛋白活化过程是由鸟苷酸交换因子催化KRAS-GDP到KRAS-GTP的过程,作为鸟苷酸交换因子(son of sevenlessl, SOS1)家族中的其中一员, SOS1蛋白是K-ras蛋白的激活蛋白[7],目前也有研究尝试干扰SOS1与K-ras结合来抑制K-ras蛋白活化[8]。本研究通过免疫组化技术检测了结直肠癌SOS1,K-ras蛋白在结直肠癌中的表达情况,并着重分析了SOS1、K-ras蛋白的不同表达分组与结直肠患者预后之间的关系,为结直肠癌患者的生物靶向治疗及预后判断提供更多的科学依据。
1 资料与方法
1.1 一般资料 收集郑州大学附属肿瘤医院普外科2012年1月至2013年12月期间180例经术后病理确诊为结直肠癌的患者以及相应癌旁5 cm以上结直肠黏膜组织标本45例为研究对象,所有患者一般病历资料及病理组织蜡块均完整。排除切片及免疫组化染色过程中出现组织脱片或染色失败的病例,最终可供统计分析病例数为156例。其中,女74例,男82例。年龄18~84岁,平均(59.7±0.65)岁,中位年龄61岁。按照2018年美国癌症联合会(American Joint Committee on Cancer,AJCC)发布恶性肿瘤 TNM 分期标准TNM分期:Ⅰ期20例,Ⅱ期45例, Ⅲ期56例,Ⅳ期35例。肿瘤部位:右半结肠23例,左半结肠26例,直肠107例。中、高分化87例,低分化69例。无淋巴结转移86例,有淋巴结转移70例。所有患者术前均未接受任何放化疗、 内分泌治疗及靶向治疗并全部接受结直肠癌根治术,有转移灶患者均进行同期或分期R0切除。
1.2 组织芯片制作 组织阵列仪(personal tissue arrayer),美国Beecher公司生产。选用质量好结直肠癌组织的病理玻璃切片和相应的石蜡标本,在显微镜下定位标记出典型的病变部位,然后将根据标记的HE切片在石蜡组织块上找到相同部位并标,本研究每例石蜡标本取1个点。在组织阵列仪上固定好空白石蜡阵列块,在供体石蜡组织标记的部位用直径0.3 mm深度为2 mm的打孔针采集圆柱形组织块(tissue core),将组织块移入受体蜡块打好的孔中,距离第1个孔1 mm处打孔下第2个孔。重复上述步骤,制成组织芯片3张。将受体石蜡块放在37℃的水浴中10~15 min后用一个载玻片下压保持组织芯片的表面平整。使用切片辅助系统(Adhesive-coated Tape Sectioning System)对组织芯片蜡块进行连续切片,每张切片厚 3 μm。
1.3 免疫组织化学染色 运用聚合物免疫组化技术(MaxVisionTM试剂盒)进行免疫组织化学染色,试剂盒购自福建迈新生物技术开发有限公司。K-ras (兔抗,Abcam,CA,USA,Cat number ab140621)抗体,工作浓度1∶2 400, 室温孵育30 min,SOS1 (兔抗,Abcam,CA,USA,Cat number ab180772)抗体,工作浓度1∶200,室温孵育30 min。染色技术严格按照说明书操作。磷酸缓冲盐溶液(phosphate buffer saline,PBS)代替一抗作为阴性对照。
1.4 结果判读 每例随机观察5个高倍镜(400倍)视野,根据阳性细胞数和着色深度计分,(1)阳性表达<5%为0分;(2)阳性表达5%~24%为1分;(3)阳性表达25%~49%为2分;(4)阳性表达50%~74%为3分;(5)阳性表达>75%为4分。阳性细胞表达的着色深度:基本不着色为0分,淡黄色为1分,黄色为2分,棕黄色3分。两者得分相乘,<3分判定为表达阴性,其余判定为表达阳性。所有切片均采用双盲法由2位病理科主任医师阅片,两人结果一致则记录结果如有争议请第3位病理科医生看片,以两个相同结果为准。
1.5 随访 随访方式主要以电话随访和门诊复查为主,随访时间至2018年2月28日,随访5~52.4个月,中位随访时间38.1个月,期间35例死亡,其中31例死于肿瘤相关事件,4例死于非肿瘤相关事件。复发转移要求有病理诊断或者典型的影像学及临床表现,复发和生存时间按月记录,以手术日至患者复发、死亡或最后一次就诊(随访)时间为复发或生存期限。失访,非肿瘤死亡及截止点生存病例按统计分析要求列为截尾数据处理。本研究已通过郑州大学附属肿瘤医院伦理委员会伦理学要求,所有患者签署知情同意书。
1.6 统计学方法 应用SPSS 23.0统计软件,采用2检验分析K-ras蛋白和SOS1蛋白在结直肠癌患者和癌旁组织中表达的差异以及K-ras蛋白和SOS1蛋白与临床病理的关系,应用GraphPad Prism 7.0软件,采用Kaplan-Meier法及Log-rank检验以及COX多因素分析分析K-ras蛋白和SOS1蛋白阳性表达与结直肠癌患者的预后关系。以P<0.05为差异有统计学意义(双侧)。
2 结果
2.1 K-ras蛋白和SOS1蛋白表达与结直肠癌临床病理学关系 K-ras蛋白和SOS1蛋白在细胞质及胞浆中均有表达。K-ras蛋白和SOS1蛋白在结直肠癌组织中阳性率高于癌旁组织,差异均有统计学意义。K-ras阳性表达与患者性别2=4.405,P=0.036)、淋巴结转移(2=9.471,P=0.002)以及TNM分期有关(2=6.177,P=0.013)。SOS1蛋白阳性表达与患者性别、年龄、肿瘤分化程度、肿瘤部位、浸润深度、有无淋巴结转移及TNM分期均无关(P>0.05)。见图1,表1、2。
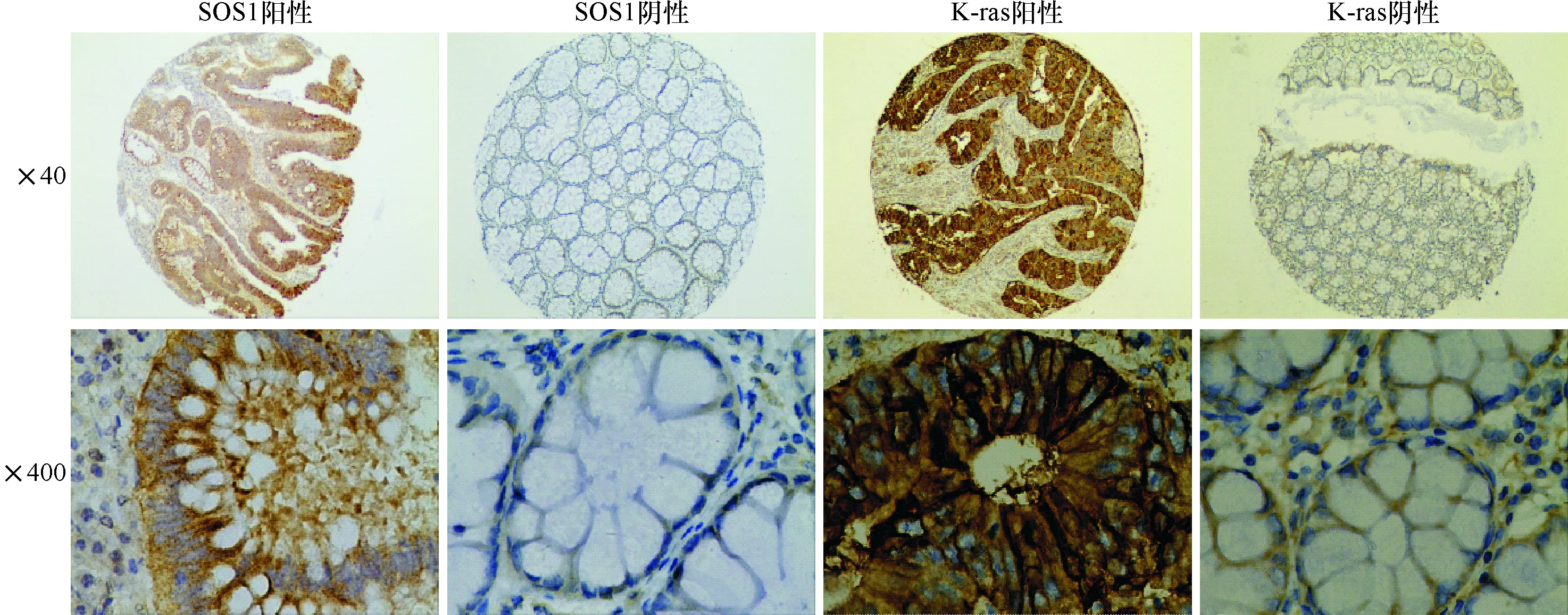
图1 K-ras蛋白、SOS1蛋白在结直肠癌旁组织及癌组织的表达(S-P法)

表1 K-ras蛋白和SOS1蛋白在结直肠癌组织和癌旁中的表达例(%)
2.2 K-ras和SOS1蛋白共表达对生存率的影响 K-ras蛋白和SOS1蛋白对结直肠癌患者4年OS均无相关性(Log RankP>0.05)。进一步根据K-ras和SOS1蛋白的表达情况将病例分为4组:K-ras阴性SOS1阴性组(n=17);K-ras阴性SOS1阳性组(n=16);K-ras阳性SOS1阳性组(n=63);K-ras阳性SOS阴性组(n=60)。组间比较仅K-ras阳性SOS1阳性组与K-ras阳性SOS阴性组之间结直肠癌患者4年总体生存率(overall survival,OS)差异有统计学意义(HR=2.381,95%CI:1.103~5.137,P=0.034 3)。COX多因素分析显示:调整了性别、年龄、肿瘤分化程度、手术方式、是否行术后辅助化疗、肿瘤T分期、肿瘤N分期、免疫组化分组等因素后,显示肿瘤T分期(HR=2.118,95%CI: 1.109~4.046,P=0.023)、肿瘤N分期(HR=2.487,95%CI:1.103~5.610,P=0.028)及免疫组化分组(HR=2.795,95%CI:1.272~6.139,P=0.010)是结直肠癌患者死亡风险增加的独立危险因素。见图2,表3。

表2 K-ras蛋白和SOS1蛋白与结直肠癌患者临床病理的关系(n=156) %
3 讨论
结直肠癌是一组异质性很强的疾病,其发生是一种多基因突变,多阶段共同发展的过程。KRAS基因在结直肠癌中的突变率为35%~45%,其中KRAS基因常见突变形式为第2外显子12、13位密码子发生突变,产生异常K-ras蛋白处于持续激活状态[9]。K-ras蛋白是MAPK信号通路上游的关键因子,活化的K-ras蛋白可以激活下游 RAS/RAF以及PI3K/Akt等下游信号分子,从而产生调控细胞的增殖、分化、凋亡等一系列细胞生物学作用[10]。研究结果显示K-ras蛋白在结直肠癌、肺癌、卵巢癌等在内的多种肿瘤组织中均存在异常激活[11-12],K-ras蛋白在结直肠癌组织中的阳性率明显高于非癌组织[13]。在结直肠癌中,由K-ras蛋白介导的MAPK信号通路已经被证实存在异常激活,KRAS基因突变型的晚期结直肠癌对抗EGFR靶向治疗通常是无效的[14]。目前研究证实SOS1基因突变会导致努南综合征(Noonan syndrome,NS)发生,但是与人类肿瘤发生的关系并不明确[15]。SOS1蛋白由SOS1基因编码,又被称为鸟氨酸转换因子,是K-ras蛋白的激活因子。当胞外信号与受体结合后,生长因子受体结合蛋白2(Grb2),作为接头分子,与激活的受体结合,再与SOS1的C端富于脯氨酸的序列相互作用形成受体-Grb2-SOS1复合物。SOS1与受体或受体底物蛋白上的Tyr磷酸化位点结合导致胞浆蛋白SOS1向膜转位,并在Ras附近形成高浓度的SOS1,SOS1与Ras-GDP结合,促使GTP取代Ras上的GDP,使Ras由失活态转变为活化态,激活Ras蛋白,形成活性Ras-GTP复合物使K-ras蛋白转变为激活状态[16]。近年来,关于靶向SOS1蛋白来抑制K-ras蛋白激活,从而抑制MAPK信号通路活化的一些初期研究报道也取得了比较令人满意的效果[17]。

图2 K-ras蛋白和SOS1蛋白对结直肠癌患者4年生存率的影响
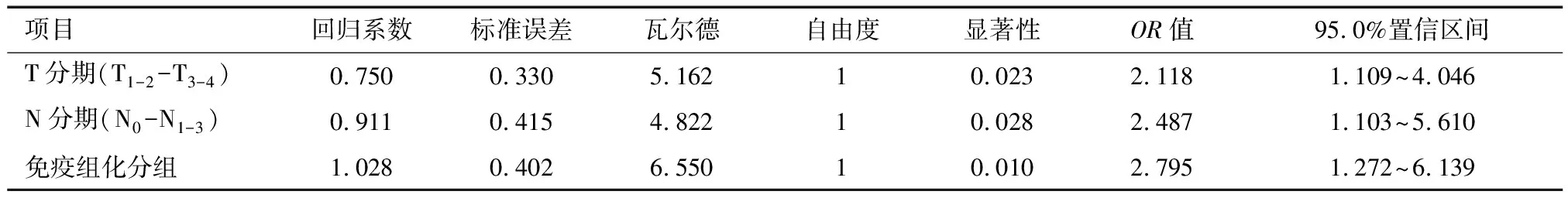
项目回归系数标准误差瓦尔德自由度显著性OR值95.0%置信区间T分期(T1-2-T3-4)0.7500.3305.16210.0232.1181.109~4.046N分期(N0-N1-3)0.9110.4154.82210.0282.4871.103~5.610免疫组化分组1.0280.4026.55010.0102.7951.272~6.139
Leshchiner等[18]研究的SAH-SOS1 A小分子化合物可以与SOS1竞争性结合K-ras结合位点,从而达到抑制K-ras蛋白活化的目的,在结直肠癌、胰腺癌KRAS基因野生或者突变细胞系中,都发现了SAH-SOS1A可以有效降低K-ras蛋白介导的MAPK信号通路的下游的Akt、Erk1/2蛋白磷酸化程度,同时在果蝇的体内实验中,也得出了相同的结果。以上基础研究表明,SOS1可能是个潜在的治疗靶点。但在临床上SOS1,K-ras蛋白在结直肠癌组织中表达情况及与结直肠癌患者预后之间的关系目前还鲜见相关报道。
本研究结果显示K-ras在结直肠癌组织中的阳性率高于癌旁组织,这与其他研究是一致的。此外,SOS1蛋白在结直肠癌组织中的阳性率也高于癌旁组织。K-ras蛋白阳性表达与结直肠癌患者性别、淋巴结转移、更晚的肿瘤TNM分期相关。本研究未发现SOS1蛋白阳性表达与结直肠癌临床病理参数有关。以上结果提示K-ras蛋白阳性表达可能与结直肠癌疾病晚期进展有关。
我们根据K-ras、SOS1蛋白在结直肠癌表达的免疫组化结果对病例进行了分组,结果发现在K-ras、SOS1同时阳性组的结直肠患者与K-ras阳性SOS1阴性组的4年OS相比,预后更差,多因素分析结果表明肿瘤T分期、N分期及免疫组化分组是结直肠癌患者预后的独立危险因素。这与SOS1促进K-ras活化,进而激活MAPK信号通路的理论结果是相吻合的。因此,联合检测这两种蛋白可以对结直肠癌患者的预后进行评估。此外,对于K-ras、SOS1共阳性表达的结直肠癌患者,靶向SOS1治疗可能会改善这一类患者预后。

