2,4二硝基氟苯柱前衍生HPLCUV法测定海稻米中的γ氨基丁酸含量
段智红,黄永梅,吕应年,,*,梁力中,黄燕霞,叶 华,,叶盛权
(1.广东医科大学,广东天然药物研究与开发重点实验室,广东湛江 524023;2.广东医科大学,海洋医药研究院,广东湛江 524023;3.广东海洋大学,食品学院,广东湛江 524088)
海水稻(海稻86)是生长于海边滩涂的一种耐盐碱水稻,由野生水稻繁育,国家农业部2014年公布于《农业植物新品种保护公报》,是一种特异性水稻种质资源[1-2]。海水稻营养成分丰富,含多种蛋白质、脂肪及微量元素等,与精白米相比,海稻米的膳食纤维及多酚类物质含量高而淀粉含量低。海稻米口感粗糙,不适合作主粮日常食用。海稻米经培育发芽,能提高活性成分γ-氨基丁酸(γ-aminobutyric acid,GABA)的含量,因此发芽海稻米可用作生产高含量GABA功能性食品的原料。GABA是一种非蛋白质氨基酸,广泛存在于动物、植物、真菌等各种生物体中,在哺乳动物中主要存在于中枢神经系统,具有抑制中枢神经、增强肝肾功能、降血压及降血脂等生理活性[3-4]。GABA作为一种新型功能性因子可应用于医药、食品、保健品等生产领域[5]。为了开发和评价富含GABA的功能性食品,发展一种高效、准确的检测方法已是当务之急。
传统的检测方法有化学比色法和层析法[6-7],操作简便,成本较低,但由于米胚芽样品成分复杂,含有多种游离氨基酸,能和显色剂发生化学反应,干扰显色,造成结果不准确。现代的检测方法有氨基酸自动分析仪检测法[8]、高效液相色谱-荧光分析法[9]、高效液相色谱-质谱分析法[10],检测迅速、结果精确,但由于这些仪器设备昂贵,常规分析实验室难以配置,限制了方法的应用。
高效液相色谱-紫外检测器分析是大多数实验室配置的常规仪器,但GABA分子没有紫外吸收官能团,往往需要柱前衍生化,在GABA分子上结合具有紫外吸收的化合物,从而能被紫外检测器发现。常用的衍生化试剂有6-氨基喹啉基-N-羟基琥珀酰亚胺基甲酸酯(AQC)、丹磺酰氯(DNS-Cl)、2,4,6-三硝基苯磺酸(TNBS)、9-芴基甲基氯甲酸酯(FMOC)以及邻苯二甲醛(OPA)等,但存在反应条件苛刻、衍生产物不稳定、试剂毒性大等缺点[11-12]。
2,4-二硝基氟苯(FDNB)是一种反应活性高、价廉的衍生剂,FDNB与氨基反应迅速、结合牢固,衍生产物具有紫外吸收且相当稳定,是进行柱前衍生反应的理想试剂[13]。本研究以FDNB为衍生剂,建立一种快速准确的检测方法,用于测定海水稻及发芽海水稻的GABA含量。
1 材料与方法
1.1 材料与仪器
精白米及玉米 广东省湛江市区农贸市场;海稻米 来自陈日胜研究员馈赠;γ-氨基丁酸标准品(≥99%)、2,4-二硝基氟苯(FDNB) 美国Sigma公司;乙腈(色谱级) 天津市科密欧化学试剂有限公司;其它化学试剂 均为分析纯;水 为实验室超纯水机制水。
Agilent 1260高效液相色谱仪 美国安捷伦科技公司;OBS-2200旋转蒸发仪 上海爱朗仪器有限公司;AR224CN型分析天平 梅特勒-托利多仪器上海有限公司;pHB-3笔式pH计 上海三信仪表厂;HX-200型高速中药粉碎机 浙江省永康市溪岸五金药具厂;TDZ4台式低速离心机 湖南赫西仪器装备有限公司;DZG-303A超纯水机 上海硕鼎水处理设备有限公司。
1.2 实验方法
1.2.1 发芽海稻米的培育 将保留有完整米胚的海稻米用水浸泡24 h,转移至稻米发芽专用平底盘内,平铺,湿纱布覆盖,每6 h喷水保湿,保持室温25~35 ℃静置发芽。根据发芽时间24、48、72 h取样,提取并检测样品中GABA含量。
1.2.2 GABA提取 试验用精白米、玉米及海稻米经HX-200型高速中药粉碎机粉碎得米粉样品,准确称取米粉样品各3 g,加入50 mL 60%的乙醇超声(60 ℃,50 Hz)提取2 h,离心(4000 r/min,10 min,37 ℃)取上清液,用旋转蒸发仪浓缩(60 ℃,30 min),用流动相0.5%醋酸铵水溶液-乙腈(85∶15,V∶V)混合溶液定容至25 mL,用孔径为0.22 μm的有机滤膜过滤。
1.2.3 样品衍生化 取7份1.2.2中发芽的海稻米滤液,每份3 mL于5 mL EP管中,加入0.3 mL NaHCO3(0.5 mol/L)溶液,向EP管中分别加入0.05、0.1、0.2、0.3、0.4、0.5、0.6 mL的0.715 mg/mL FDNB的乙腈溶液,混匀,避光于60 ℃水浴1 h,冷却至室温后10000 r/min离心10 min,取上清定容至5 mL,0.22 μm滤膜过滤后备用。
1.2.4 色谱条件的优化 色谱系统采用安捷伦1200型高效液相色谱仪。色谱柱为Thermo Hypersil C18柱(250 mm×4.6 mm,5 μm),检测波长360 nm,柱温30 ℃,进样量10 μL,流速1.0 mL/min。根据文献方法筛选流动相,比较乙腈-磷酸盐溶液流动相和乙腈-醋酸铵溶液流动相的分离情况,优化样品中GABA的色谱分离条件,并分别用蒸馏水和硼酸盐缓冲液对衍生化后发芽24 h的海稻米粉样品进行不同倍数稀释(1、5、10、20、40倍),之后各取10 μL注入高相液相色谱仪中进行分析,考察样品溶液pH对色谱分离的影响。
1.2.5 标准曲线的绘制 精密称取0.00393 g GABA标样于10 mL容量瓶中,用超纯水定容至刻度线,配制成0.393 mg/mL的GABA标准溶液,备用。取3 mL标准溶液,按照1.2.3项方法衍生化处理,过滤。将衍生化后的GABA溶液稀释成1.178、5.89、11.79、17.68、23.58 μg/mL倍配成五个不同浓度,分别取10 μL注入高效液相色谱仪分析,以峰面积为纵坐标(Y),以GABA浓度(μg/mL)为横坐标(X)绘制标准曲线。
1.2.6 精密度实验 精密称取0.02000 g GABA标样于10 mL容量瓶中,用超纯水定容至刻度线,配制成2 mg/mL的GABA标准溶液,取3 mL标准溶液按照1.2.3项方法衍生化处理,过滤。
1.2.7 重复性实验 取发芽24 h的海稻米粉滤液,按照样品处理的方法,分别同时制备6份样品溶液进行测定。
1.2.8 稳定性实验 精密称取0.00393 g GABA标样于10 mL容量瓶中,用超纯水定容至刻度线,配制成0.393 mg/mL的GABA标准溶液,备用。取3 mL标准溶液按照1.2.3项方法衍生化处理,过滤。
1.2.9 加标回收率实验 取1.2.2中试验用精白米、玉米及海稻米的提取液各3 mL,分别加入3.245、3.468、2.910、6.543和11.453 μg/mL的GABA标准品溶液,按照1.2.3下方法制备样品液。
1.2.10 不同样品GABA含量测定 试验用精白米、玉米以及海稻米按前述方法粉碎、提取GABA、衍生化后,离心、过滤,取滤10 μL进样HPLC,在优化的色谱条件下分离检测,优化的色谱条件为Thermo Hypersil C18柱(250 mm×4.6 mm,5 μm),检测波长360 nm,柱温30 ℃,进样量10 μL,流速1.0 mL/min。峰面积代入标准曲线计算样品中GABA的含量。
1.3 统计学分析
2 结果与分析
2.1 衍生条件(FDNB投量)的优化
GABA分子的氨基取代FDNB分子上的氟原子生成二硝基苯胺衍生物(化学反应方程式如图1),能被紫外光检测。

图1 GABA和FDNB的衍生化反应方程式Fig.1 Derivatization reaction of GABA and FDNB
若衍生反应中FDNB的量不足,则样品GABA不能完全转化成紫外吸收物质,影响结果的准确性,因此在衍生化反应中,FDNB的量应能确保GABA完全反应。根据茚三酮显色预实验发现,经24 h培育的发芽海水稻GABA含量最高,在衍生化反应中,逐渐添加FDNB的反应体积,确定可完全反应的最小加入量。当样品量为3 mL时,衍生剂FDNB加入0.1~0.3 mL时,GABA生成量逐渐增加,当FDNB体积继续增加到0.3~0.6 mL时,产物峰面积基本不变,表明样品中GABA已经完全反应,结果如图2。由此可见,衍生剂的加入量为0.3 mL,可确保样品GABA完全反应,紫外检测结果准确可靠。

图2 0.715 mg/mL FDNB投量的优化Fig.2 Optimization of the addition volume of FDNB at 0.715 mg/mL
2.2 色谱条件优化
色谱法测定GABA的常用流动相为乙腈-水-磷酸盐体系[14],梯度洗脱,分离时间较长[15]。在优选流动相预实验中,使用乙腈-磷酸盐体系洗脱,高效液相色谱仪存在泵压不稳定的现象,洗脱过程中泵压突然急剧降低,原因在于乙腈和磷酸盐溶液的在线混合过程中,有微量磷酸盐从乙腈有机相中析出,造成泵压不稳定。经筛选发现,采用乙腈-醋酸铵作为流动相,泵压平稳,GABA分离度高(R>1.5)结果如图3。

图3 不同样品的色谱图Fig.3 Chromatograms of reference substance注:(a)GABA标样;(b)发芽海稻米24 h;(c)FDNB溶液。
发芽海稻米中GABA色谱峰保留时间为15.8 min,与GABA标样色谱峰保留时间(15.9 min)基本一致,FDNB溶液的色谱峰保留时间是6.1 min,且FDNB溶液的其他成分GABA无干扰,这表明该条件下,GABA的分离效果较好。
预实验发现样品及流动相的pH对色谱分离有显著影响。样品衍生化反应完毕,反应液需稀释后进样HPLC分析,稀释溶液的pH会影响色谱峰的保留时间。图4中A和B分别是用蒸馏水和硼酸盐缓冲液对衍生化后的样品按不同倍数稀释得到的色谱图(纵坐标为mAU),结果显示,用蒸馏水稀释1、5、10、20、40倍样品,GABA色谱峰的保留时间分别为24.8、23.1、20.9、19.4和14.0 min,发生明显漂移;用硼酸盐缓冲液稀释的样品中GABA色谱峰保留时间都在15.8 min,几乎不漂移,表明pH是影响样品中GABA色谱峰漂移的关键因素。本试验采用的流动相乙腈-醋酸铵水溶液呈碱性,因此稀释液采用硼酸盐缓冲液,样品溶液pH稳定在9.0左右,色谱峰保留时间不漂移。

图4 不同溶液稀释样品所得色谱图Fig.4 Chromatograms of GABA derivatives soiluted by different solution注:A:蒸馏水稀释;B:硼酸盐缓冲液稀释。
2.3 标准曲线
按照实验设计,准确配制不同浓度衍生化的GABA标准溶液进行色谱分析,以峰面积为纵坐标(Y),以GABA浓度(μg/mL)为横坐标(X)绘制标准曲线,见图5。
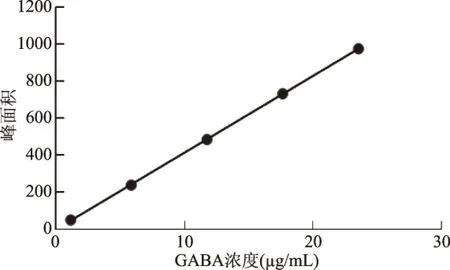
图5 GABA对照品的标准曲线Fig.5 Calibration curve of GABA reference
经过数据分析,GABA标准曲线的回归方程为Y=41.344X-4.0243,相关系数R2=0.9999。这说明待测液中GABA含量在1.18~23.58 μg/mL的范围内与吸光度的相关性较好。
2.4 精密度、重复性及稳定性
精密吸取处理后的2 mg/mL GABA标准溶液10 μL,进样,平行测定6次,以峰面积考察其精密度,实验结果显示标准偏差(SD)为6.60,相对标准偏差(RSD)为0.08%,表明仪器精密度良好。
取发芽24 h的海稻米粉样品,按照样品处理方法同时分别制备6份样品溶液进行测定,以GABA含量考察重复性,SD值为4.11,RSD值为0.66%,远低于2%,证明该方法具有良好的重现性。
取衍生化的标准液,分别于0、4、8、12、24 h进样,测定GABA含量。测定结果显示,GABA峰面积的SD值为7.75,RSD值为0.60%,表明GABA衍生产物在24 h内稳定。
2.5 加标回收率实验
取1.2.9中各样品溶液反复进样3次,进样量10 μL,分别测定它们的平均回收率为99.480%、99.295%、100.361%、101.358%、101.233%;RSD值分别为1.721%、1.658%、1.835%、1.924%、1.800%,均小于15%,结果见表1。这表明该方法下测得的样品含量准确可靠。

表1 加样回收率试验结果(n=3)Table 1 Result of recovery test(n=3)
2.6 样品含量测定
用上述方法检测几种粮食样品的GABA含量,结果显示,精白米中几乎不含GABA,玉米的GABA含量是3.74 μg/mg,海稻米GABA含量是3.63 μg/mg,海稻米发芽24、48、72 h样品中GABA 的含量分别是34.35、17.03和9.54 μg/mg。实验结果见图6。
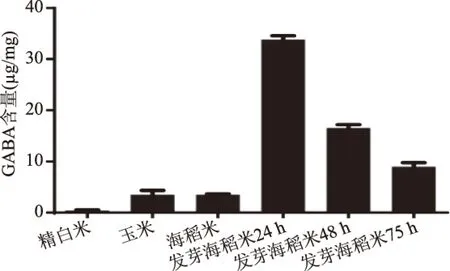
图6 各样品中GABA含量图Fig.6 GABA content of each sample
3 讨论与结论
文献中报道的GABA的测定方法中主要有比色法[16-17]、紫外分光光度法[18]、氨基酸分析法[19]和高效液相色谱法[20],前两种方法主要用于测定成分较复杂的物质中的GABA,测定结果容易受干扰而影响结果的准确性。而氨基酸分析法无论是柱前或是柱后衍生化,检测时大多用的是荧光检测器,成本高,价格昂贵。由于GABA分子没有紫外吸收官能团,不能直接用于高效液相法检测,往往需要衍生化。衍生化试剂多种多样,因此,检测方法也各有不同,但都有不足之处。常用的方法有OPA法[21]、DNS法[22]、PITC法[23]、CEOC法[24]和FDNB法[25-26]。OPA法衍生物稳定性差,测定结果不准确;DNS法、PITC法、CEOC法这三种方法反应速度慢,反应试剂易对实验结果造成干扰。用FDNB作为衍生化试剂时不仅反应速度快、衍生物稳定,且灵敏度高,干扰物少,方法简单易行,且本实验克服了pH影响色谱峰漂移的问题,测定结果更稳定、准确、可靠,是一种理想的检测方法。
本研究建立了一种检测海稻米中GABA含量的HPLC方法,采用FDNB进行了柱前衍生,优化了FDNB的投量并确定FDNB的最佳投量为0.3 mL,以0.5%醋酸铵水溶液∶乙腈(V∶V)=85∶15作为最优色谱条件,解决泵压不稳的问题;用四硼酸钠缓冲液(pH=9.0)作为稀释剂,确保GABA色谱峰保留时间不变。结果表明,GABA含量在1.18~23.58 mg/mL范围内线性关系良好,各样品中GABA含量测定结果为发芽海稻米24 h>发芽海稻米48 h>发芽海稻米72 h>未发芽海稻米和玉米>精白米。由此可见,海稻米在发芽初期24 h内,其GABA含量大幅增加,约为未发芽海稻米的10倍,这可能是由于发芽过程中,谷氨酸在内源性蛋白酶和谷氨酸脱羧酶的共同作用下产生了GABA,但随着发芽时间的继续延长,GABA的含量开始下降,这也许是生成的GABA又在转氨酶的催化下形成琥珀酸半醛而逐渐被消耗,导致GABA含量下降[25-28],因此,合理地控制海稻米的发芽时间是提高海稻米中GABA含量的关键因素。

