采用近红外光谱技术快速检测桃汁原汁含量的方法研究
李祥辉,连媛媛,杨木莎,蓝真红,孙伟明
(1.福建医科大学医学技术与工程学院,福建 福州 350004; 2.福建医科大学药学院,福建 福州 350108)
0 引言
桃子性热而味甘酸,营养价值丰富,有补气养血、解劳热、生津解渴的功效.此外,桃子含较多有机酸和纤维素,能增加胃肠蠕动,并且其含铁量较高,可辅助治疗缺铁性贫血.而桃树以其结果早、效益高、管理容易,成为近几年来发展迅速的林业种植项目.据联合国粮农组织统计,目前我国桃树种植面积达600万亩(40万hm2),年产量300多万t,是世界桃果第一大生产国[1].鉴于成熟桃果贮存期短,部分桃子被制作成桃汁进行销售.目前,市场所售桃汁饮料大多为水蜜桃汁.而现实生产过程中水蜜桃汁较难榨取,导致市售桃汁饮料原汁含量差异较大,桃汁品质参差不齐.因此,桃汁中原汁含量的检测分析显得非常重要.目前,应用于果汁饮品质量检测的方法很少,如Williams等[2]采用原子吸收分光光度计法(AAS)对果汁中痕量的金属离子进行检测; 康明丽等[3]用气相色谱-质谱 (GC-MS) 技术检测不同熟度的蜜柑果汁中的挥发性成分; Pei等[4]利用高效液相色谱(HPLC)对果汁中的痕量酚酸进行了定量检测.但目前用于桃汁饮品中原汁含量检测方面的分析方法未见诸报道.上述定量分析方法虽然在果汁中痕量成分检测方面准确度和灵敏度较高,但预处理复杂、耗时长、检测成本高,并不适用于桃汁中原汁含量的快速、简便、廉价、无损、准确定量检测.
近红外光谱(near infrared spectroscopy,NIRs)分析技术具有效率高、耗时短、绿色环保、可在线无损检测等优点,主要检测待测样品含氢基团化学键(X—H,X为C、O、N、S 等元素)在近红外波段内伸缩振动倍频和合频的振动、转动等特征信息,是鉴定食品品质、分析食品中有效成分含量等的有效工具,被广泛应用于山茶油[5]、牛奶[6]、蜂蜜[7-8]、苹果汁[9-11]、中药材[12]、莲子粉[13]等的品质检测.但由于果汁成分复杂,近红外光谱重叠严重,限制了近红外光谱技术在果汁品质鉴别方面的应用.
鉴于此,本研究利用近红外光谱技术结合经典偏最小二乘法(partial least squares,PLS)分析鲜榨桃汁样品中桃子原汁的含量,建立一种快速、无损测定桃汁饮品中原汁含量的定量检测方法.
1 实验部分
1.1 实验仪器与对象
傅里叶变换近红外光谱分析仪(ANTARISⅡ型,美国Thermo公司); 无缺损、色泽好的古田水蜜桃安农一号(采购于福州市场).
1.2 样品制备
将水蜜桃样品洗净去核,切成碎块放于搅拌机内,以20 000 r·min-1的转速搅拌10~15 min,搅拌后经纱布过滤3次,取上清液置于烧杯中待用,避免因桃子果粒大小不均对实验结果造成干扰.然后将上述原汁软化后的自来水按不同质量比进行勾兑,配制成水蜜桃原汁质量分数不同的一系列桃汁样本20个,即每个样本(100 g混合液)中含有的桃子原汁和自来水的质量比分别为5∶95、10∶90、15∶85、20∶80、25∶75、30∶70、35∶65、40∶60、45∶55、50∶50、55∶45、60∶40、65∶35、70∶30、75∶25、80∶20、85∶15、90∶10、95∶5、100∶0,震荡摇匀,备用.
1.3 光谱数据的采集
实验中近红外光谱数据均使用美国Thermo公司生产的ANTARISⅡ型傅里叶变换近红外光谱分析仪采集,该仪器配有高灵敏度InGaAs检测器,内置自动金箔背景采集方式,配置样品杯旋转器及石英样品杯积分球系统.将所配制的待测桃汁溶液使用10 mm石英比色皿盛装,测其在10 000~4 000 cm-1范围内的近红外光谱数据,分辨率为16 cm-1,每个标本扫描3次,取其平均值作为样品的近红外吸收光谱数据.以空气为测量背景,在室温下测定,空气湿度控制在65%,用PLS进行定量分析.所得数据采用Matlab (R2013a) 软件进行分析处理.
2 结果与讨论
2.1 数据预处理
用近红外光谱计算结果时,待测样品本身的颗粒大小、样品内部结构的均匀性、样本自身稳定性等因素对结果有一定的影响.同时,仪器检测样品时本身的噪声等因素会降低所得样品的近红外谱图的有效信息.为降低仪器本身固有因素和待测样品自身因素对所建的定量分析模型的准确性、稳定性等的影响,需要先运用高选择性的方法对近红外光谱数据进行预处理,在此基础上建立相应的定量分析模型.
为使数据更好地呈现,研究采用5种不同的预处理方法对数据进行优化,分别为多元散射校正(multiplicative scatter correction,MSC)、标准正态变量(standard normal variate,SNV)、SG卷积平滑一阶(Savitzky-Golay first-derivative,1st)、SG卷积平滑二阶(Savitzky-Golay second derivative,2st)、标准化(Normalize).经预处理后的数据光谱图如图1所示,其中,图1(a)为测得的近红外吸收光谱原图,未经任何预处理(Raw).由图1可直观看出经过1st(见图1(b))和2st(见图1(c))预处理的光谱图相比其他预处理方法所出现的毛刺更多,这是因为采用微分处理,信号被放大的同时,噪声也被放大[7].MSC和SNV主要是校正由于颗粒不均、大小不一等原因导致样品光散射不同而造成的光谱差异,待测样品经搅拌、研磨、过滤后可有效避免此类情况的出现.因此,图1(d)、1(e)显示的光谱曲线光滑、干扰信息较少、光谱信息更加集中,但也导致部分有效信息被过度处理后丢失.经Normalize方法进行预处理后的谱图(见图1(f))与未经任何预处理的原图(见图1(a))在图形形状上相似,光谱线光滑、噪音较小.不同光谱预处理方法对模型准确性、稳健性的影响需相关参数进一步验证.



图1 不同方法预处理后的近红外光谱图Fig.1 Near infrared spectrum after pretreatment of different methods
2.2 定量分析模型的建立

将所配制的20个桃汁样本随机选取10个作为校正集,剩余10个作为预测集,用于定量分析模型的建立.检测结果经预处理后建立的模型如图2所示(其中,图2(a)为未经处理的原始数据),预测值与真实值分布于斜率为1的直线上时,表明预测值与真实值几近相同,所得模型最佳,预测准确率接近100%.根据图2中预测值与真实值的分布情况可知,图2(b)、2(c)的分布较差,远远偏离直线,其中图2(c)分布最差,几乎完全与直线脱离.图2(d)、2(e)的预测值与真实值之间存在一定程度的偏离,对光散射的过度预处理造成了部分有效信息的缺失.图2(a)、2(f)预测准确率最高,接近100%,与图1呈现的预处理后的光谱图相吻合.
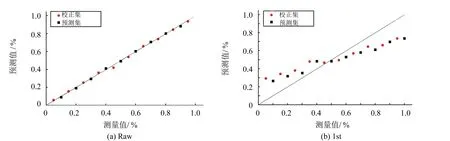

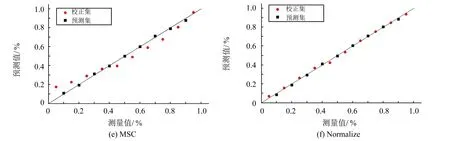
图2 不同预处理方式下的PLS模型的预测值和真实值分布情况Fig.2 Predictive value and real value distribution of PLS model under different pretreatment modes

预处理方法因子数校正集R2c RMSEC预测集R2pRMSEPRaw40.99650.02390.99910.01241st70.85870.14720.84770.15242st10.28710.29880.38700.3080SNV10.97400.06510.97490.0639MSC10.97250.06690.97470.0642Normalize30.99730.02120.99880.0140
3 结语


