基于测地线活动轮廓模型的图像联合分割算法*
郑翰艺,邱天爽
(大连理工大学 电子信息与电气工程学部,大连 116024)
1 引 言
对PET/CT图像分割,可辅助医生制定准确的放疗靶区,用以治疗肺癌。实际上,现阶段数字图像处理技术已经相当成熟,完全可以依靠计算机来进行多模态肿瘤图像的融合和靶区分割,从而辅助医生确定肿瘤的位置和大小,更好的制定放疗计划,提高患者的治疗成效。
活动轮廓模型是图像分割中的经典算法[1],主要分为两大类:基于区域的活动轮廓分割模型和基于边缘的活动轮廓分割模型。基于区域的活动轮廓分割模型中最常用的是Chan-Vese (CV)模型[2]和Regionscalable Fitting(RSF)[3]模型。CV模型利用的是图像的全局信息,算法收敛速度快,但是不适用于灰度不均的图像。RSF模型在CV的基础上进行改进,同时结合了图像的全局和局部能量,解决了对灰度不均图像分割效果不好的问题,但其缺点是由于局部项的影响,算法不易找到全局最优解[4-5]。基于边缘的活动轮廓模型中最常见的是测地线活动轮廓[6](geodesic active contour,GAC) 模型,其优点是对复杂图像的分割效果较好,但是分割结果会出现边界泄漏的问题[7-8]。对活动轮廓模型算法的改进有很多,文献[9]利用概率分布的概念,将图像局部和全局信息结合,文献[10]将分割区域的形状作为先验信息改进模型,文献[11-14]在模型中加入了先验信息、边缘信息等,来提高分割效果。文献[15-17]以图像局部信息为主,约束活动轮廓的演化。
传统的GAC模型往往是针对单一模态的图像来进行分割,而在癌症领域,医生往往要通过多种模态的医学图像来综合确定肿瘤区域的形状。为解决该问题,本研究改进了传统GAC模型的边缘函数,在其中加入了CT图像和PET图像的梯度信息,在不改变肿瘤边缘细节的情况下,增加肿瘤区域的对比度。改进后的算法综合利用了PET和CT图像的信息,对肿瘤边缘的保留情况更好,自动描记的区域更加接近金标准。
2 传统的测地线活动轮廓模型
2.1 测地线活动轮廓模型
GAC模型是活动轮廓模型的一种,它是由Snake模型演变而来,但是克服了Snake模型需要预知曲线参数的问题。该方法通过计算曲线最小化能量泛函来推动曲线演化,与Fermat原理相近,即光线在不同介质中总是沿着光程最短的路线行进[18]。GAC模型的能量泛函:

(1)
其中C为图像上某条闭合曲线,L(C)为闭合曲线对应的长度,LR(C)为加权弧长。g为边缘函数,它的形式有很多种,最常用的形式如下:
(2)
其中K为常数,可以控制边缘函数g边缘的陡峭程度。
GAC模型的梯度下降流为:
(3)
其中N为闭合曲线C的单位法向量。
2.2 存在的问题
传统的GAC模型中,边缘函数g内只包含单一模态图像的梯度信息,而肿瘤的形态信息和代谢信息又分别体现在CT和PET两种模态的医学图像上,所以采用传统的边缘函数g来进行图像分割,会丢失肿瘤的一部分信息,导致最后的分割结果不理想。本研究从PET/CT联合分割出发,旨在找到一种新的边缘函数,将PET和CT图像的信息同时包含进去,即可以实现PET/CT联合分割,使分割出的肿瘤区域更准确。所以构建合适的边缘函数g,可以改进GAC模型的效果。
3 本研究模型
3.1 新的边缘函数
由2.1得知,在GAC模型按照梯度下降流演化时,边缘函数g起到了控制演化速度的方向的作用。边缘函数g一般可以写作:
(4)
或
g(r)=exp(-r/K)
(5)
本研究采用的是配准后的PET/CT图像,所以两幅图像上相同位置点对应的空间位置是相同的。改进的目标是将来自两幅图像上相同位置点的两种信息结合,同时在边缘函数g中体现出来,CT的图像可以很好的将组织的边缘表示出来,但是无法区分正常组织和肿瘤之间的分界。PET图像高亮的部位即为肿瘤区域,但是边界模糊。综合两种模态的图像提供的有用信息互补,目标区域的边界上的点既要满足CT的梯度信息,又要满足PET图像中处于高亮的区域。这种既要、又要的条件,符合数学上加权和的形式,可以以此设计新的边缘函数:
(6)
在经过较多实验分析后,其中参数w的取值得到如下结论:w的取值在0.5左右,分割效果较好,本研究选取10幅图像测试,做出TPR均值与w的关系,见图1。w越小,则边缘函数g中ICT的权重越大,虽然可以让肿瘤边缘更清晰,但是w过小会导致肿瘤区域的代谢信息不足,造成分割边界演化收缩过度,导致分割失败。当w变大,边缘函数g中IPET的权重变大,可以更好的体现肿瘤区域的形态,但是w过大会导致肿瘤边缘不准确。根据大量的实验分析后,w取值为0.5时,分割结果较好。

图1 w与TPR的关系Fig 1 Relation between w and TPR
3.2 数值实现
本研究采用变分水平集方法[19],得到演化方程:
(7)
其中δε为Dirac函数,为正则化后的Heaviside函数Hε的导数[20]:
(8)
(9)
对式(8)进行离散化处理,采用有限差分法δ(z) :
(10)


(11)
对其中涉及到变量的微分形式采用上下两部分半点的中心差分后合并可得:
(12)
(13)
(14)
(15)
(16)
(17)

(18)
因为源图像输入时即为矩阵形式,所以空间步长Δx与Δy为1。这样,梯度下降方程中的所有变量都已经转化为差分的形式,只要给定算法一个初值,即可通过迭代得到最终结果。
4 实验结果与分析
4.1 分割评价标准
图像分割通常采用图像分割准确率(TPR)来描述分割算法性能。计算公式如下:
(19)
其中,Es是“金标准”(经验丰富的医生手动勾画出的病灶区域),EM是分割算法分割出的结果。其意义是表示经过计算机算法分割出的结果与“金标准”之间的吻合度[21]。TPR∈[0,1]。由式(19)可知TPR的值越趋近于1,分割结果越准确。
4.2 与基于GAC模型的单模态图像分割算法对比
本文算法的特点是在分割的过程中结合了PET、CT各自的特征信息。将本文算法与基于GAC模型的PET单模态图像分割算法做对比。选择参数c=2.8,w=0.5,ε=1.5,K=8。初始轮廓及两种算法的分割结果见图2。图3为两种算法的分割准确率随两种算法迭代次数的变化。
直观上来说,本文算法所描记的肿瘤区域较单模态GAC算法更小,对PET图像中的高亮区域贴合的更好。由图3可以看出本文算法边缘收敛的速度较GAC-PET算法有很大提升,肿瘤区域描记的精度也较GAC-PET算法有小幅提升。具体数据见表1。

图2两种算法的分割结果(a).初始轮廓; (b).GAC-PET/CT;(c).GAC-PET
Fig2Thesegmentationoftwoalgorithms(a).Initialcontour; (b).GAC-PET/CT; (c).GAC-PET
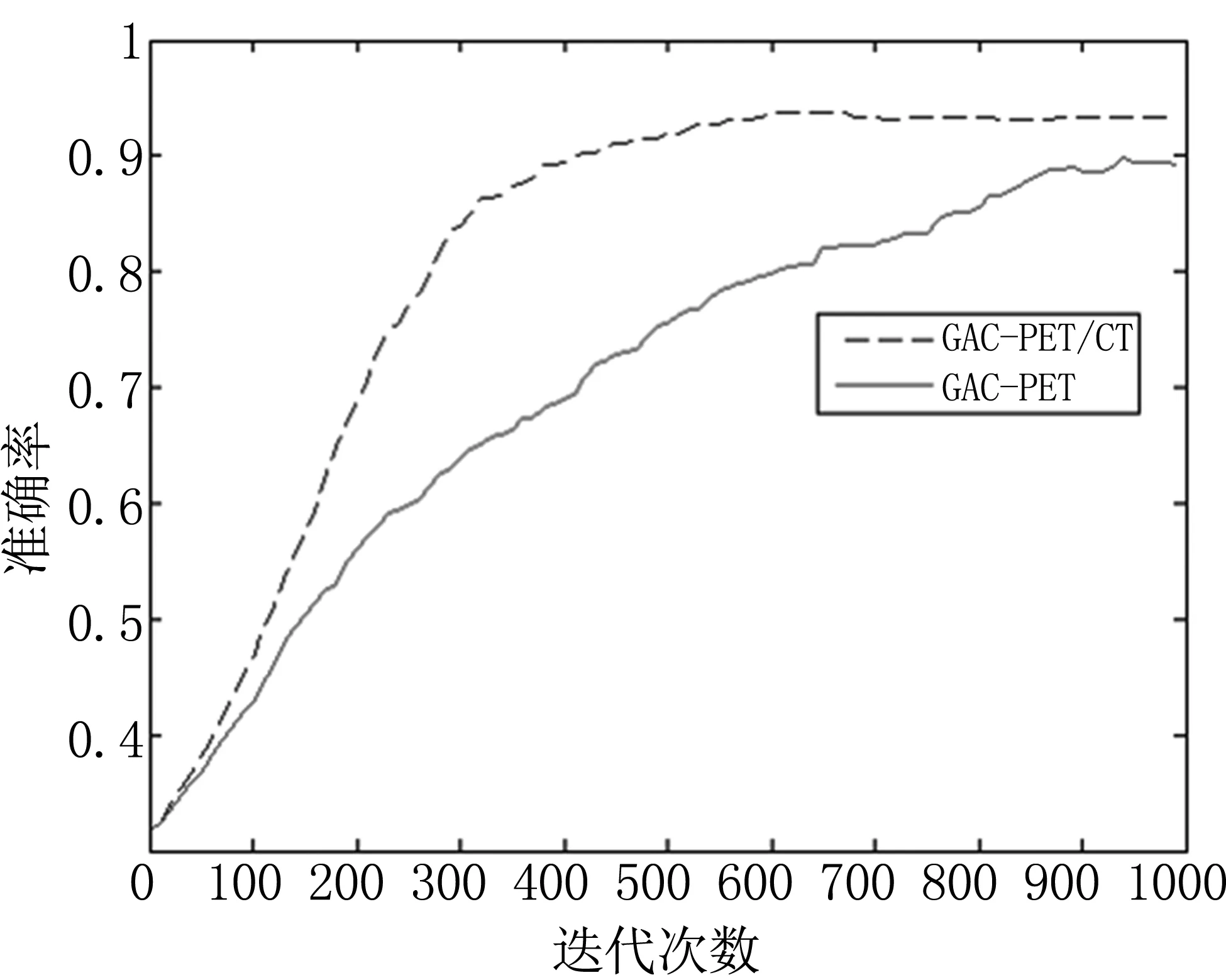

图3 分割准确率随迭代次数变化图Fig 3 TPR versus the number of iterations
结合表1对结果进行分析。由于改进了边缘函数gnew,即加入了CT图像的信息也加入了PET图像的信息,所以在目标区域边缘时,基于多模态医学图像所构建的边缘函数gnew会产生多种推动曲线演化的力,使得其收敛速度较单模态医学图像构建的边缘函数gPET快,因而算法的运行时间降低了约60%。又因为边缘函数gnew是由PET图像和CT图像共同决定的,所以gnew的边缘形状和大小都较单模态图像构建的gPET更加准确,因而最终得到的分割区域准确度也越高。故本文算法的性能要优于单模态GAC分割算法。

表1 三种方法分割评价对比
4.3 与其他分割算法对比
为了进一步证明本文算法的有效性,将本文算法与其他两种算法做对比。以图像中SUV值最大的40%作为阈值来进行分割的阈值分割算法(TH40),基于SUV值得随机游走算法(RW)。实验图像为配准后的肺部肿瘤的PET和CT图像DUVLE1,其中肿瘤层为36~50,共15层。客观评价参数选择TPR,金标准为医生手动描记的肿瘤轮廓。分割结果中41、48层结果见图4。选择参数c=2.8,w=0.5,ε=1.5,K=8。

图4 三种算法的分割结果 (a).金标准;(b).本文算法;(c).TH40;(d).RW
Fig4Thesegmentationofthreealgorithms(a).goldenstandard; (b).ourmethodsegmentationresult; (c).TH40segmentationresult; (d).RWsegmentationresult
由实验图像可以看出,本文算法所分割出的肿瘤区域边缘与医生所描记的金标准在肿瘤形态大小和边缘结构上最为相似。进一步计算三种方法分割结果与医生金标准的TPR指标,见表2。

表2 三种方法TPR结果
根据表2对算法进行分析。本文算法结合了PET和CT两种图像信息作为分割演化的依据,所以分割出的边缘与金标准更相似。从主观上来说,本文算法所勾勒的靶区边缘的形状与金标准最相似,RW算法分割边缘的形状与金标准有较大差异,TH40算法分割边缘形状虽然与金标准相似,但是由于门限值的选择不当,所以分割边缘会出现过收缩的现象,分割结果有泄漏。从客观结果上分析,与其他两种分割方法相比,本文算法15幅的TPR均值较其他两种算法大幅提高,所以本文算法的分割准确度更高。并且本文算法的TPR标准差较低,这说明了本文算法在分割时的稳定性高于其他两种算法。传统RW算法在分割时需要人为的标记前景种子点和背景种子点,无法做到自动分割。而且所得到的实验结果对种子点选取很敏感,导致算法的鲁棒性较低。TH40算法在分割时只结合了图像的SUV值,这样单一阈值分割可能会导致分割结果有泄漏或者外扩,并且由于个体的差异性,每人对PET显影剂吸收程度不同,所以由最大SUV值的40%设置的门限不具有普适性,对不同的患者分割的准确度会有很大的波动。所以,本文算法兼顾PET/CT两方面信息,可以实现计算机全自动分割,在肺部肿瘤分割中具有很大的优势。
5 结论
本研究在基于GAC的PET图像分割算法的基础上,引入新的边缘函数,使分割结果兼顾PET和CT两方面的信息,提高了边缘的结构性。经过实验验证,本文提出的算法有较好的分割效果。且相对于结合单一模态图像信息的GAC算法具有更高的分割精度和更快的边缘收敛速度。与其他两种方法进行对比,实验结果表明,本文算法可以利用计算机自动进行边缘描记,分割精度高,且稳定性较强。可以辅助医生进行靶区勾画,在保证准确度的前提下减少医生手动分割的工作量。

