血清癌胚抗原、甲状腺球蛋白及半乳凝集素-3水平在甲状腺癌鉴别诊断中的价值
温琥玲 谢建平 林师宇 文丹
甲状腺癌是较为多见的内分泌系统来源恶性肿瘤,流行病学研究显示,甲状腺癌的发病率可达345/10万人左右[1-2]。甲状腺癌的发生可以通过增加远处器官转移,导致患者病死率的上升。现阶段临床上甲状腺癌缺乏有效的早期诊断方式,超声等影像学检查虽然可以提高甲状腺癌的早期筛查水平,但其诊断的灵敏度或者特异度仍然具有一定的局限性。血清学指标的变化在评估恶性肿瘤的发生过程中具有一定的参考价值。癌胚抗原(carcinoembryonic antigen,CEA)、甲状腺球蛋白(thyroglobulin,Tg)是甲状腺滤泡上皮病变过程中显著释放的糖链蛋白,其表达浓度的上升可以促进滤泡上皮的异常增殖和分化,增加甲状腺癌癌细胞的转移风险[3-4];半乳凝集素-3(gal agglutinin-3,gal-3)可以通过结合糖链蛋白,促进细胞内的第二信使的活化,增加癌细胞调控异常的发生风险[4]。为了进一步揭示血清CEA、Tg及gal-3水平在甲状腺癌患者血清中的异常表达,从而指导临床诊疗,本次研究选取川北医学院附属医院经病理学明确诊断的甲状腺癌患者127例,探讨了相关指标的异常表达及诊断学指标如灵敏度或者特异度的变化情况,报道如下。
1 资料与方法
1.1 一般资料
选取川北医学院附属医院经病理学明确诊断的甲状腺癌患者127例(甲状腺癌组)、甲状腺良性结节患者(良性组)60例,收治时间2015年1月至2017年9月。
甲状腺癌组,男32例、女95例,年龄31~75岁,平均(54.5±16.0)岁;病理学结果:乳头状癌121例、滤泡状癌6例。良性组,男14例、女46例,年龄32~72岁,平均(53.0±16.8)岁,病理学结果:甲状腺腺瘤38例、结节性甲状腺肿22例。2组患者的年龄、性别比较,差异无统计学意义(P>0.05)。
1.2 纳入排除标准
1.2.1 纳入标准
①甲状腺癌的诊断标准参考中华医学会制定的相关标准[4];②所有甲状腺癌患者均经过病理学检查证实;③患者年龄范围18~75岁;④患者采集标本接受检查时未接受放化疗;⑤本研究获得患者的知情同意及川北医学院附属医院医学伦理委员会的批准。
1.2.2 排除标准
①术前具有放化疗病史;②合并其他部位恶性肿瘤;③长期应用免疫调节性药物;④伴有风湿性疾病、结缔组织疾病。
1.3 检测方法
采集患者入院后或者治疗6~8 h内的空腹静脉血5 mL,加入枸橼酸钠抗凝剂3 mL,1 000 r/min离心(离心半径12 cm)5 min,采用化学发光法检测CEA、Tg,检测仪器为MAGLUMI化学发光免疫分析仪及其配套试剂。采用双抗体夹心酶联免疫吸附法检测gal-3,检测仪器为美国Bio-Bad全自动酶标仪,试剂盒购自南京建成生物工程研究所,严格按照试剂盒说明书操作。
1.4 统计学方法
2 结果
2.1 2组患者的血清CEA、Tg及gal-3水平比较
甲状腺癌患者的血清CEA、Tg及gal-3水平均显著的高于良性组,差异具有统计学意义(P<0.05)(表1)。
表1 2组患者的血清CEA、Tg及gal-3水平比较(±s)Table 1 Serum CEA,Tg and gal-3 levels were compared between the 2 groups(±s)

表1 2组患者的血清CEA、Tg及gal-3水平比较(±s)Table 1 Serum CEA,Tg and gal-3 levels were compared between the 2 groups(±s)
组别甲状腺癌组良性组t值P值n 127 60 CEA(ng/mL)17.3±8.298.6±35.225.84±5.71 2.2±1.635.3±18.514.20±3.98 14.11813.08914.232<0.001<0.001<0.001 Tg(ng/mL)gal-3(ng/mL)
2.2 血清CEA、Tg及gal-3鉴别诊断甲状腺癌与甲状腺良性疾病的诊断学分析
血清CEA、Tg及gal-3 3种指标单独应用及联合应用鉴别诊断甲状腺癌的诊断学价值指标见表2,ROC曲线图见图1;gal-3鉴别诊断甲状腺癌的灵敏度、ROC曲线下面积AUC值均高于 CEA、Tg;血清 CEA、Tg及 gal-3 3种指标联合应用鉴别诊断甲状腺癌时,能显著地提高诊断的灵敏度、特异度及ROC曲线下面积AUC值。
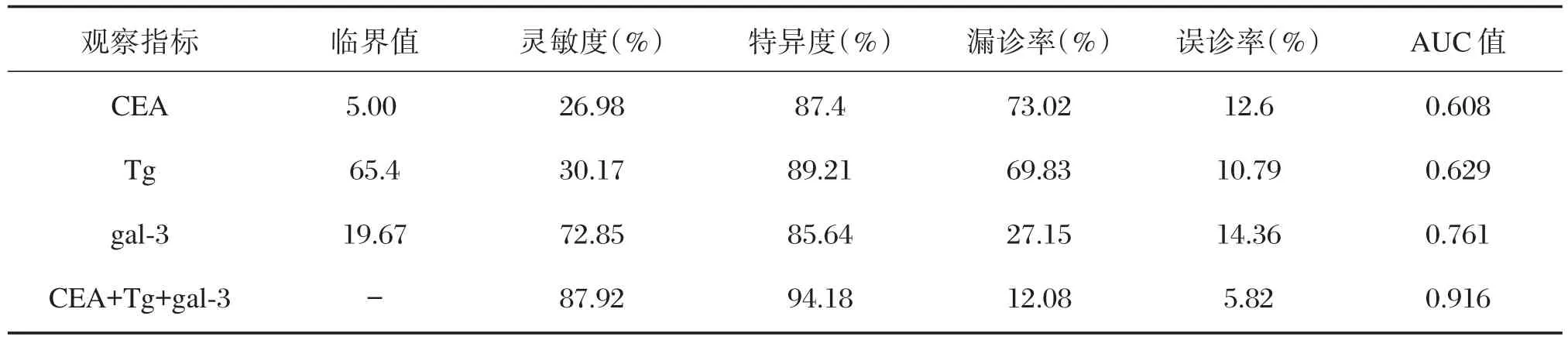
表2 血清CEA、Tg及gal-3鉴别诊断甲状腺癌与甲状腺良性疾病的诊断学分析Table 2 Diagnostic analysis of serum CEA,Tg and gal-3 for differential diagnosis of thyroid cancer and benign thyroid diseases
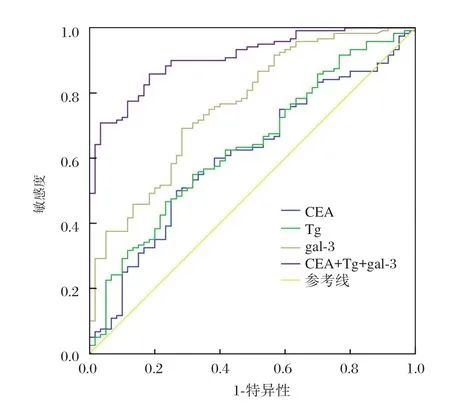
图1 血清CEA、Tg及gal-3单独及联合应用鉴别诊断甲状腺癌与甲状腺良性疾病的ROC曲线图Figure 1 ROC curve of serum CEA,Tg and gal-3 in the differential diagnosis between thyroid cancer and thyroid benign disease
3 讨论
射线因素、遗传等均可以促进甲状腺癌的发生,在我国部分地区甲状腺癌的发病率可持续性维持在较高的水平。甲状腺癌的五年生存率不足45%,治疗后的远期生存指标如中位生存时间或者无瘤生存期等均无明显的改善[5-6]。恶性肿瘤的早期诊断对于疾病的治疗具有重要的意义,其可以为恶性肿瘤的根治性切除术提供契机,降低中晚期恶性肿瘤的检出率。但现阶段临床上主要通过超声检查评估甲状腺恶性病变的发生风险,超声检查虽然较为简便,但其对于早期甲状腺癌的检出水平仍然不能令人满意[7]。
CEA是临床上较为常见的广谱上皮细胞来源恶性肿瘤糖蛋白成分,在胚胎组织或者成人癌细胞中可显著异常高表达,CEA的高表达主要考虑与甲状腺上皮细胞的异常增殖过程中过度释放的细胞内囊泡有关,过度的囊泡内糖蛋白结合成分的释放,促进了血清中信号通路蛋白的激活,促进了肿瘤下游信号转导因子的激活,增加了癌细胞的增殖或者分化障碍的风险[8]。Tg作为甲状腺球蛋白,其表达浓度的上升可以促进患者滤泡上皮细胞或者乳头状上皮细胞癌细胞DNA异常扩增的风险,导致癌细胞分化诱导凋亡抑制因子a的上调,促进癌细胞对于淋巴结内皮细胞的粘附能力,增加癌细胞的转移可能[9-10]。gal-3作为糖蛋白末端结合成分,其与癌细胞表面的巯基结合,能够增加细胞内三磷酸腺苷的浓度,促进癌细胞的凋亡抑制[11]。
本次研究发现,在甲状腺癌患者血清中存在明显的相关指标的异常表达,其中甲状腺癌患者血清中CEA、Tg及gal-3水平均显著高于良性组,差异具有统计学意义(P<0.05),提示 CEA、Tg及gal-3等均可能参与到了恶性肿瘤的发生发展过程中。相关指标的高表达可以通过影响到下列几个方面的因素,进而促进甲状腺滤泡或者乳头状细胞的异常病变[12-14]:①CEA可以提高甲状腺滤泡上皮细胞癌变的风险,在癌细胞增殖过程中过度释放的CEA可以通过正反馈调控机制进一步增加癌细胞周期的紊乱风险:②gal-3对于甲状腺癌的发生的影响,主要考虑gal-3对于癌细胞表面糖蛋白的结合增加了癌细胞的NOTCH或者AKT等信号通路的激活程度。王宗平等[15]研究者在探讨了52例不同类型的甲状腺癌的发病机制的过程中发现,CEA、Tg在甲状腺癌患者血清中的异常阳性表达率可在55%以上,同时其蛋白表达浓度可在发生了转移或者淋巴结浸润的患者中进一步上升。CEA单独诊断甲状腺癌的灵敏度较低,而特异度较高,可达80%左右,提示CEA对于甲状腺癌的特异性标志作用较为明显,诊断灵敏度较低则主要考虑与在早期癌细胞的凋亡或者分化过程中CEA的活性较弱、释放浓度不足有关。血清Tg诊断甲状腺癌的灵敏度或者特异度均有所上升,血清Tg在甲状腺结节或者甲状腺自身免疫性疾病中均可能显著上升,临床上对于可疑甲状腺癌血清Tg上升的患者,应综合评估其他参考指标,降低误诊的风险。综合考虑3种评估指标CEA、Tg及gal-3的诊断学灵敏度或者特异度,发现CEA、Tg的单独诊断的灵敏度较低,而gal-3单独诊断的灵敏度可显著上升,差异较为明显,存在相关显著的差异考虑可能与CEA、Tg作为肿瘤相关标志物,其对于甲状腺恶性肿瘤的特异性标志作用较低,同时甲状腺良性增生性病变或者甲状腺功能性病变等,均可能影响到Tg的表达,进而干扰到CEA、Tg的诊断灵敏度。gal-3诊断的灵敏度或者特异度均较为理想,但本次研究与部分国内外相关研究存在一定的不同之处,部分研究认为单独gal-3诊断甲状腺癌的灵敏度或者特异度均不足60%[5],这与本研究存在较大的差异,考虑主要由于gal-3检测方法、检测时间节点或者相关临床研究未考虑到甲状腺癌的病理分型有关。单独检测诊断甲状腺癌的价值不足,而在联合了3种血清学指标进行诊断后,其诊断学价值较为理想,诊断的特异度可达90%以上,但临床上应综合影像学检查、临床症状、查体等,提高甲状腺癌的早期诊断水平。
相比于其他研究,本次研究的创新性在于分别探讨了CEA、Tg及gal-3的单独诊断或者联合诊断的相关灵敏度、特异度情况。综上所述,血清CEA、Tg及gal-3水平在甲状腺癌患者中异常高表达,同时联合三者进行诊断的临床参考价值较高。