响应面法优化多黏类芽孢杆菌BD3736发酵脱脂乳产α-葡萄糖苷酶抑制剂的工艺条件
冯华峰
(光明乳业股份有限公司乳业研究院,上海乳业生物工程技术研究中心,乳业生物技术国家重点实验室,上海 200436)
糖尿病是一种以高血糖为特征的内分泌代谢疾病,由于口服降糖药使用方便、价格相对便宜,大部分患者更愿意接受。以α-葡萄糖苷酶(α-glucosidase)为靶标的口服降糖药能有效控制餐后血糖波动,目前是我国治疗糖尿病的一线药物[1]。α-葡萄糖苷酶抑制剂(α-glucosidase inhibitors,AGIs)通过竞争性抑制小肠α-葡萄糖苷酶的活性,来延缓肠道对碳水化合物的消化与吸收,降低餐后血糖水平并抑制过多的胰岛素分泌,最终达到控制血糖的目的[2]。
目前,阿卡波糖(Acarbose)是临床上最常用的AGIs类药物之一,是由游动放线菌(Actinoplanes)SE50/110规模化发酵获得的伪寡糖[3]。米格列醇(Miglitol)作为1-脱氧野尻霉素(1-desoxynojirimycin,DNJ)的衍生物,是首个假单糖类的AGIs,也是临床上常用的AGIs类药物[4]。在临床使用过程中,上述2 种药物均会有胃肠道不适、过敏和肝损伤等不良反应[5]。因此,筛选和设计新型的AGIs仍是当前口服降糖药的开发热点之一[6-8]。
根据目前报道,在各种微生物的次生代谢产物中筛选新型AGIs仍是研究首选,其中芽孢杆菌属(Bacillus)和类芽孢杆菌属(Paenibacillus)逐渐被人们所重视。Yamada等[9]从巨大芽孢杆菌(Bacillus megaterium)G45C的次级代谢产物中检测出能够抑制小肠α-葡萄糖苷酶活性的羟基柠檬酸。Abd El-Hady等[10]从海绵中分离出芽孢杆菌,并在培养液中分离出二酮哌嗪(diketopiperazines),其对α-葡萄糖苷酶的抑制能力超过阿卡波糖。Nguyen等[11]将类芽孢杆菌TKU042菌株的发酵产物经多步分离纯化后,发现类芽孢杆菌的次级代谢产物高龙胆酸(homogentisic acid)具有很强的α-葡萄糖苷酶抑制活性,其半数最大抑制质量浓度(half maximal inhibitory concentration,IC50)为0.22 mg/mL,最大抑制率为95%,而阿卡波糖的IC50为1.51 mg/mL,最大抑制率为65%。
多黏类芽孢杆菌(Paenibacillus polymyxa)是类芽孢杆菌属的模式菌种,其代谢产物中含有多种可被利用的生物活性物质,主要包括脂肽、蛋白水解酶、胞外多糖和植物激素等[12-14]。本实验室从江南传统泡菜中分离筛选出一株多黏类芽孢杆菌BD3736[15]。本研究以脱脂乳为发酵介质,对多黏类芽孢杆菌BD3736高效合成AGIs的条件与特性进行研究,旨在为此领域的研究提供参考。
1 材料与方法
1.1 材料与试剂
菌株:多黏类芽孢杆菌BD3736(P. polymyxaBD3736),其在中国普通微生物菌种保藏中心的编号为CGMCC10062,由乳业生物技术国家重点实验室提供。
脱脂乳粉 新西兰恒天然集团;α-葡萄糖苷酶(E.C 3.2.1.20,源自酵母)、4-硝基苯-α-D-吡喃葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside,pNPG)和阿卡波糖 美国Sigma公司;其他试剂均为分析纯 国药集团化学试剂有限公司。
1.2 仪器与设备
HVE-50高压灭菌锅 日本Hirayama公司;GNP-9270隔水恒温培养箱 上海精宏实验设备有限公司;PB-100 pH计 德国Sartorius公司;HZQ-X500C大型恒温振荡器 上海一恒科学仪器有限公司;Spectra Max M5多功能酶标仪 美国Molecular Devices公司;Millipore-Q超纯水仪 德国默克-密理博公司;Biofuge Strators高速冷冻离心机 德国Heraeus公司;FreeZone冻干机 美国Labconco公司。
1.3 方法
1.3.1 培养基的配制
菌株活化和活菌计数培养基的配制:配制20 mL质量浓度10 g/100 mL的脱脂乳液体培养基,再取1.4 g琼脂粉溶于80 mL水中,分别于115 ℃灭菌15 min取出,待冷却至60 ℃时,将二者混匀,倒入无菌平板中,配成质量浓度2 g/100 mL的脱脂乳琼脂平板。
种子和发酵培养基的配制:配制质量浓度8 g/100 mL的脱脂乳液体培养基,于115 ℃灭菌15 min,冷却备用。
1.3.2 多黏类芽孢杆菌BD3736种子液的制备
将多黏类芽孢杆菌BD3736冻存管从超低温冰箱中取出,划线于质量浓度2 g/100 mL的脱脂乳琼脂平板中,30 ℃好氧培养2 d;活化2 代后,挑取单菌落,接种于质量浓度8 g/100 mL的脱脂乳液体培养基中(装量为20 mL/100 mL三角瓶),30 ℃、180 r/min振荡培养2 d后,将发酵液10 000×g离心20 min,弃上清,取菌体用无菌水清洗2 次,以去除残留的培养基,最后将菌体悬浮于少量质量浓度8 g/100 mL脱脂乳液体培养基中,调整其活菌数为109CFU/mL作为种子液,备用。
1.3.3α-葡萄糖苷酶抑制率及IC50的测定
用0.1 mol/L的磷酸盐缓冲液(PBS,pH=6.80)溶解或稀释待测样品,取100 µL于1.5 mL离心管,加入50 µL 100 mU/mLα-葡萄糖苷酶,混匀,37 ℃温育15 min,再加入80 µL 2.0 mmol/L的pNPG,混匀,37 ℃反应15 min,最后加入80 µL 0.2 mol/L Na2CO3终止反应,10 000×g离心2 min,取200 µL上清于96孔板中,于405 nm波长处测定吸光度(A)。
同时,为避免脱脂乳本身对α-葡萄糖苷酶抑制剂筛选模型的影响,本研究采用无菌脱脂乳(质量浓度8 g/100 mL)上清作为阴性对照。制备方法如下:用乳酸将已灭菌的脱脂乳(质量浓度8 g/100 mL)pH值调节至与待测发酵样品相同,10 000×g离心2 min后取上清,用1.0 mol/L NaOH调节pH值至6.80,再次10 000×g离心2 min后取上清,即得阴性对照组。取3 次平行实验的平均值,按照下式计算样品对α-葡萄糖苷酶的抑制率。以质量浓度1.0 mg/mL的阿卡波糖作为阳性对照。
式中:阴性对照为用无菌脱脂乳替代待测样品;阴性空白为用PBS替代阴性对照组中的α-葡萄糖苷酶;样品空白为用PBS替代待测样品组中的α-葡萄糖苷酶。
IC50的测定:以倍半稀释的方法将待测样品溶液进行稀释,获得不同质量浓度的待测样品,利用上述检测方法测定不同质量浓度的待测样品对α-葡萄糖苷酶的抑制率,根据质量浓度与α-葡萄糖苷酶抑制率的线性关系,计算得出样品对α-葡萄糖苷酶的IC50。
1.3.4 多黏类芽孢杆菌BD3736在脱脂乳中的生长情况测定
将多黏类芽孢杆菌BD3736划线于脱脂乳琼脂平板(质量浓度2 g/100 mL)上,观察菌株生长特性。
将多黏类芽孢杆菌BD3736以2%(V/V,下同)的接种量接种于质量浓度8 g/100 mL的脱脂乳液体培养基中(装量为100 mL/250 mL三角瓶),在180 r/min、30 ℃条件下振荡培养,分别于0、3、6、9、12、24 h及2、3、4、5、6、7 d,测定发酵体系pH值和活菌数,并观察不同培养时间(1、3、5 d)的发酵液颜色。
取培养2 d的发酵乳样品,10 000×g离心20 min,取上清,在沸水浴中加热灭活15 min后,冷却至室温;用1.0 mol/L NaOH调节pH值至6.80,再次10 000×g离心20 min,取上清,并测定其对α-葡萄糖苷酶的抑制率和IC50。
1.3.5 不同因素影响AGIs产量的单因素试验设计
1.3.5.1 接种量对AGIs产量的影响
将多黏类芽孢杆菌BD3736种子液分别以1%、2%、3%、5%、8%和10%的接种量接入质量浓度8 g/100 mL的脱脂乳发酵培养基中(装量为100 mL/250 mL三角瓶),30 ℃、180 r/min振荡培养2 d;实验结束后,按照1.3.4节所述方法对发酵液进行后处理,再按照1.3.3节所述方法测定不同接种量样品对α-葡萄糖苷酶的抑制率(n=3)。
1.3.5.2 发酵温度对AGIs产量的影响
将多黏类芽孢杆菌BD3736种子液以2%的接种量接入质量浓度8 g/100 mL的脱脂乳发酵培养基中(装量为100 mL/250 mL三角瓶),分别置于28、30、32、34、37、40 ℃,180 r/min振荡培养2 d;实验结束后,按照1.3.4节所述方法对发酵液进行后处理,再按照
1.3.3节所述方法测定不同发酵温度样品对α-葡萄糖苷酶的抑制率(n=3)。
1.3.5.3 培养时间对AGIs产量的影响
将多黏类芽孢杆菌BD3736种子液以2%的接种量接入质量浓度8 g/100 mL的脱脂乳发酵培养基中(装量为100 mL/250 mL三角瓶),于30 ℃、180 r/min振荡培养1、2、3、4、5、6、7 d;实验结束后,按照1.3.4节所述方法对发酵液进行后处理,再按照1.3.3节所述方法测定不同培养时间样品对α-葡萄糖苷酶的抑制率(n=3)。
1.3.5.4 脱脂乳质量浓度对AGIs产量的影响
将多黏类芽孢杆菌BD3736种子液以2%的接种量分别接入脱脂乳质量浓度为2、4、8、10、12 g/100 mL的发酵培养基(装量为100 mL/250 mL三角瓶),30 ℃、180 r/min振荡培养2 d;实验结束后,按照1.3.4节所述方法对发酵液进行后处理,再按照1.3.3节所述方法测定不同质量浓度脱脂乳样品对α-葡萄糖苷酶的抑制率(n=3)。
1.3.6 响应面优化影响AGIs产量的因素
对上述单因素试验结果进行显著性分析,选取3 个最显著的影响因素,以AGIs对α-葡萄糖苷酶的IC50为响应值(减少抑制活性水平较高时的误差),设计响应面试验(n=3)。
1.4 数据处理
实验数据采用Design Expert 8.0软件和SPSS 17.0软件进行单因素方差分析和Student’st检验,P<0.05(P<0.01)为有统计学显著(极显著)差异;采用GraphPad Prism 8.0软件进行图表绘制。
2 结果与分析
2.1 多黏类芽孢杆菌BD3736在脱脂乳中的生长情况
由图1A可知,随着培养时间的延长,多黏类芽孢杆菌BD3736发酵体系颜色逐渐加深。这是由于发酵体系中含有大量氨基酸、肽和蛋白质,与乳糖、半乳糖和葡萄糖等还原性糖发生美拉德反应(又称“非酶褐变”)所造成的[16]。发酵体系的颜色越深,代表多黏类芽孢杆菌BD3736对乳蛋白和乳糖的水解程度越深。
由图1B可知,多黏类芽孢杆菌BD3736菌落周围呈现澄清、透明的乳蛋白水解圈,表明多黏类芽孢杆菌BD3736具有很强的乳蛋白水解能力,这种发酵特性被发现于多种类芽孢杆菌中。Li Yunxia等[17]从桂皮类芽孢杆菌(Paenibacillus lautus)CHN26中克隆并异源过量表达出一种由466 个氨基酸组成、分子质量为51.94 kDa的羧基末端蛋白酶;Hang Feng等[18]则从一株类芽孢杆菌新种牛类芽孢杆菌(Paenibacillus bovis)BD3526中分离获得一种新型、高效、性能稳定的金属蛋白酶(分子质量35 kDa);另外,牡丹类芽孢杆菌(Paenibacillus peoriae)[19]以及幼虫类芽孢杆菌(Paenibacillus larvae)[20]等均有相关报道,因此,蛋白质水解能力是大部分类芽孢杆菌的常规特性。
由图1C可知,多黏类芽孢杆菌BD3736接种于发酵培养基后的2 d内,其活菌数逐渐增长,直至达到峰值1.0×109CFU/mL之后,开始缓慢下降,这可能是由于发酵体系中营养物质的匮乏或部分不利于菌体生长的代谢产物过度积累。发酵终点(7 d)时,活菌数降至2.0×106CFU/mL。发酵体系pH值的快速下降在菌体快速增长阶段表现最明显,发酵前2 d内,pH值由接种时的6.40下降至5.76,随后以每天0.05~0.10的速率缓慢下降至发酵终点(pH 5.40)。与乳酸菌不同的是,类芽孢杆菌发酵体系中pH值的下降不仅得益于乳糖代谢所合成乳酸的贡献,而且与菌株分泌的多种乳蛋白水解酶将酪蛋白水解成偏酸性的肽和氨基酸有关。
经测定,接种多黏类芽孢杆菌BD3736发酵2 d的脱脂乳上清的α-葡萄糖苷酶抑制活性明显,对α-葡萄糖苷酶的抑制率为53.8%,IC50为47.4 mg/mL。
2.2 多黏类芽孢杆菌BD3736产AGIs的单因素试验结果
2.2.1 接种量对α-葡萄糖苷酶抑制活性的影响
发酵体系种子的接种量会直接影响发酵液中的初始活菌数,从而影响整个发酵过程中代谢产物的合成与积累速率。由图2可知,当接种量较低时(1%、2%、3%),发酵液对α-葡萄糖苷酶的抑制效果与接种量呈正相关,当接种量为3%时,α-葡萄糖苷酶的抑制率达到极值,为64.3%。但进一步提高接种量并未有效提高发酵液的α-葡萄糖苷酶抑制活性,相反地,抑制效果随着接种量提高呈明显下降趋势。这可能是由于接种量过高时,过多的营养物质被消耗用于菌体增殖,使菌体代谢产物总量降低,最终造成AGIs合成与积累受到限制。因此,优选的发酵接种量为3%。
2.2.2 发酵温度对α-葡萄糖苷酶抑制活性的影响
温度是影响酶活性的重要外因,通过对温度的调控可以有效控制菌体的各种相关生命活动,只有适宜的温度环境才能使微生物的生长和代谢过程更高效、有序。由图3可知,当发酵温度过低(28 ℃)或过高(40 ℃)时,发酵液中AGIs含量相对偏低,α-葡萄糖苷酶抑制率分别为33.3%和21.0%。前者的成因可能是低温条件下菌体代谢能力不足,后者的成因则可能是高温条件加速菌体衰亡,二者均直接导致AGIs产量骤降。而在30~37 ℃条件下,发酵液对α-葡萄糖苷酶的抑制率均达50%以上,32 ℃条件下,发酵液对α-葡萄糖苷酶的抑制率最高(75.6%)。因此,选取32 ℃作为多黏类芽孢杆菌BD3736发酵产AGIs的最佳温度。
2.2.3 培养时间对α-葡萄糖苷酶抑制活性的影响
由图4可知,在多黏类芽孢杆菌BD3736接种后的前4 d里,发酵液的α-葡萄糖苷酶抑制率逐渐上升,直至第4天达到相对峰值(87.3%),此后,随着发酵时间的延长,尽管α-葡萄糖苷酶抑制率略有升高,但与第3天相比无显著性差异,因此,从时间成本考虑,选择4 d为较适培养时间。
2.2.4 脱脂乳质量浓度对α-葡萄糖苷酶抑制活性的影响
在本研究的发酵体系中,脱脂乳是多黏类芽孢杆菌BD3736唯一的营养来源,因此,选择合适质量浓度的脱脂乳有利于多黏类芽孢杆菌BD3736快速、高效地合成AGIs。由图5可知,采用不同质量浓度(2、4、8、10、12 g/100 mL)脱脂乳制备的发酵液对α-葡萄糖苷酶的抑制率分别为17.3%、38.3%、54.8%、57.8%和60.6%。发酵液中AGIs的产量随着脱脂乳质量浓度的增加而增加,在8 g/100 mL以下的较低质量浓度时,抑制效果随着脱脂乳质量浓度的增加明显增加,继续增加脱脂乳质量浓度并未显著提升发酵液对α-葡萄糖苷酶的抑制率,这可能是由于固定接种量的多黏类芽孢杆菌BD3736的代谢能力相对有限,无法将生长环境中充足的营养物质有效转化与利用,另外,高质量浓度脱脂乳的渗透压往往偏高,不利于菌体的正常生长与增殖。同时,为了后续对发酵乳中AGIs分离纯化的要求,选择8 g/100 mL作为脱脂乳培养基的质量浓度。
2.3 AGIs产量的响应面优化试验结果
2.3.1 响应面优化试验设计及结果
将上述单因素(接种量、发酵温度、培养时间及脱脂乳质量浓度)优化结果经SPSS 17.0软件分析发现,接种量、发酵温度和培养时间的P值均小于0.05,因此选取接种量、发酵温度和培养时间3 个显著因素,以IC50为响应值,采用3因素3水平的响应面优化试验进行进一步优化。响应面优化试验设计及结果如表1~2所示。

表 1 Box-Behnken试验设计因素水平及编码Table 1 Factors and their coded levels used for Box-Behnken design

表 2 Box-Behnken试验设计及结果Table 2 Box-Behnken design with experimental results
2.3.2 响应面优化试验结果分析
将表2的数据通过Design Expert 8.0软件进行回归拟合,得多元二次响应面回归模型:IC50=30.50-7.88A-2.75B-3.63C-0.25AB+1.00AC-0.75BC+28.75A2+10.50B2+12.75D2。该模型的R2=0.868 5,调整R2=0.981 2,表明回归方程与数据的拟合度较高,模型有一定代表性,可以解释98.12%试验所得结果。
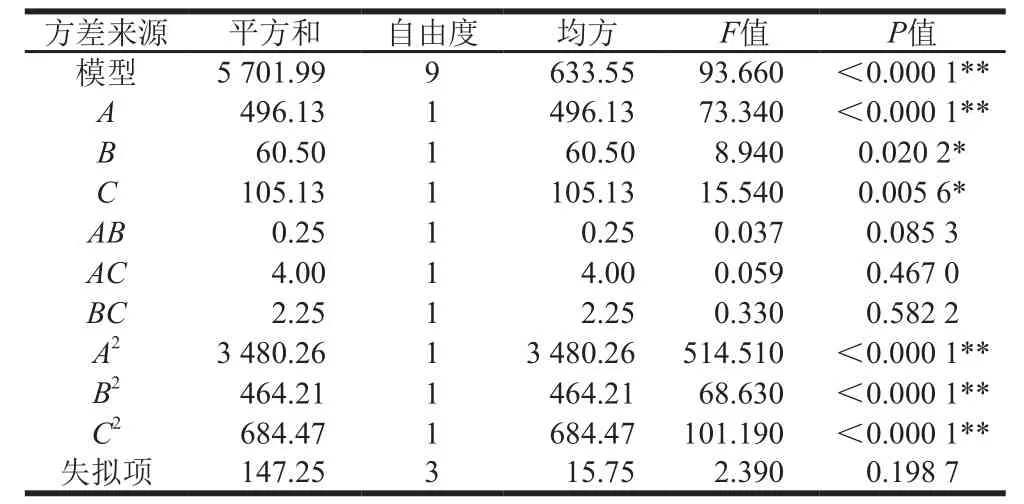
表 3 Box-Behnken试验结果的方差分析Table 3 Analysis of variance of response surface regression model
由表3可知,模型极显著(P<0.000 1),且无失拟因素存在(失拟项P>0.05)。各因素之间的交互作用影响各异,且顺序依次为AB(P=0.085 3)>AC(P=0.467 0)>BC(P=0.582 2)。
由图6~8可知,各因素在所选范围均存在响应极值,这与表2模型的显著性结果一致。根据二次回归模型的预测,当发酵温度为31.46 ℃、接种量为3.44%、培养时间为3.98 d时,发酵液上清对α-葡萄糖苷酶的IC50为30.5 mg/mL。为了便于后续验证实验的可操作性,将上述优化条件调整为发酵温度31.5 ℃、接种量3.5%、培养时间4 d。
2.3.3 验证实验
为了验证模型的可靠性,按照调整后的培养条件进行发酵,测得该条件下多黏类芽孢杆菌BD3736发酵体系对α-葡萄糖苷酶的IC50为33.4 mg/mL,与预测值(30.5 mg/mL)无显著性差异,表明该模型能够较好地预测实验结果,与优化前(接种量2%、发酵温度30 ℃、培养时间2 d)相比,IC50降低29.5%,说明优化效果达到预期。
3 结 论
本研究发现多黏类芽孢杆菌BD3736具有代谢脱脂乳、合成AGIs的能力。单因素试验结果表明,多黏类芽孢杆菌BD3736产AGIs的最佳培养条件为接种量3%、发酵温度32 ℃、培养时间4 d、脱脂乳质量浓度8 g/100 mL。在此基础上,利用响应面法进一步优化,得到优选培养条件为接种量3.5%、发酵温度31.5 ℃、培养时间4 d。该条件下,多黏类芽孢杆菌BD3736发酵脱脂乳对α-葡萄糖苷酶的IC50为30.5 mg/mL,较优化之前降低29.5%,达到预期优化目标。后续将对多黏类芽孢杆菌BD3736发酵脱脂乳产生的AGIs进行分离纯化,分析活性馏分的化学结构,并对AGIs在选取的特定动物模型(自发性2型糖尿病GK大鼠)中的活性进行评价。

