车前子多糖抗肿瘤作用的实验研究
冯 娜,王素敏
(天津市东丽区东丽医院,天津 300300)
多糖是存在于高等植物、真菌、藻类、细菌和动物细胞膜上由醛糖或酮糖通过糖苷键连接而成的天然高分子化合物[1]。多糖以其抗肿瘤活性、免疫活性而备受关注,且毒副作用较小[2]。根据早期研究发现,多糖为车前子中主要活性成分之一,该多糖具有整肠通便、降低血脂、调节血糖的作用,还具有明显的抗氧化、清除自由基作用及防治动脉粥样硬化功能[3],但在抗肿瘤作用方面研究甚少,本文拟探讨车前子多糖的抗肿瘤作用及机制。
1 材料与方法
1.1实验材料
1.1.1实验动物 清洁级昆明种小鼠,体质量18~22 g,雌雄不限;清洁级BALB/C雄性小鼠,体质量18~22 g,动物生产许可证号:SCXK(冀)2013-1-003,合格证号:804020,均由河北医科大学动物实验中心提供。动物饲养环境为清洁级环境,温度(24±2) ℃,湿度50%~60%。
1.1.2主要试剂 市售车前子采用微波技术[4]提取车前子多糖,车前子多糖得率为1.84。噻唑蓝(MTT,Sigma公司)、丙二醛(MDA)试剂盒(南京建成生物工程研究所)、总超氧化物歧化酶试剂盒(T-SOD,南京建成生物工程研究所)、肿瘤坏死因子(TNF-α)试剂盒(上海蓝基)、 印度墨汁(索莱宝公司)、ConA(天根生化科技有限公司)、LPS(索莱宝公司)。车前子多糖配制方法:根据PSP给药组计算每只小鼠(平均体重20 g)的给药量,小鼠的灌胃容积以0.2 ml/10 g为标准,然后以相应浓度按每组小鼠的数量用生理盐水进行配置。以PSP高剂量组(800 mg/kg)为例:每20 g体重小鼠,需要PSP 16 mg,灌胃容积为0.4 ml,则每只小鼠的给药浓度为16 mg/0.4 ml,以每组10只小鼠计算出灌胃体积和药物量为4 ml和160 mg,然后用生理盐水进行配置。
1.1.3实验仪器 Centrifuge 5412R离心机(德国eppendorf公司)、Floustar多功能分仪(美国BMG公司)、倒置生物显微镜(日本olympus公司)、-80 ℃超低温冰箱(美国Thermo Forma公司)、AG135电子天平(Mettler Toled公司)、Millipore纯水机(美国Millipore公司)、恒温水浴(德国Edmund Buhler公司)、CO2培养箱(上海力申仪器公司)、AnkeTDL-80-2C低速台式离心机(上海安亭科学仪器厂)。
1.2实验方法
1.2.1PSP对H22实体瘤小鼠瘤重及脾、胸腺指数的影响 肿瘤接种:取小鼠腹腔内扩增的H22肝癌细胞,用生理盐水洗2次,每次1 000 r/min离心5 min。经细胞计数后,用生理盐水调整至浓度为1×107/ml的细胞悬液,取0.2 ml细胞悬液接种于小鼠(昆明种,雌雄不限,体质量18~22 g)右腋下皮肤,建立实体瘤小鼠模型。实体瘤小鼠模型建立后,进行随机分组,分为5组,每组10只,即阴性对照组(生理盐水)、阳性对照组(环磷酰胺30 mg/kg)、PSP剂量组(100、400和800 mg/kg)。灌胃给药,1次/d,连续10 d,停药后次日脱臼处死小鼠。剥离肿瘤并取脾脏、胸腺,去血污称重,按下式计算抑瘤率和各脏器指数[5],比较PSP对肿瘤组织、免疫器官的影响。抑瘤率(%)=(对照组平均瘤重-实验组平均瘤重)/对照组平均瘤重×100%;脾脏指数=(脾重/体重)×10;胸腺指数=(胸腺重/体重)×10。
1.2.2PSP对H22实体瘤小鼠血清中MDA、SOD、TNF-α含量的影响 分组及给药方法同前,停药后次日小鼠眼眶静脉取血,所得样品于3 000 r/min离心10 min,上层清液移取到1.5 ml Eppendroff管中[6]。采用丙二醛测试盒测定小鼠血清中丙二醛(MDA)含量,采用超氧化物歧化酶测试盒测定小鼠血清中总超氧物歧化酶活性(SOD)活力,采用肿瘤坏死因子-α(TNF-α)测试盒测定小鼠血清中TNF-α含量。
1.2.3PSP对正常及免疫力低下小鼠吞噬指数的影响 取昆明种小鼠(雌雄不限,体质量18~22 g)90只,分两批。将第一批40只小鼠进行随机分组,分为对照组(生理盐水)、PSP剂量组(100、400和800 mg/kg),每组10只。第二批50只小鼠随机分组,分为对照组(生理盐水)、模型组(生理盐水)和PSP剂量组(100、400和800 mg/kg),每组10只。灌胃,1次/d,连续7 d。第5日第二批除正常组外,其余各组每只小鼠腹腔内注射环磷酰胺60 mg/kg,连续3 d,造成免疫力低下小鼠模型。第8天对第一批和第二批每只小鼠尾静脉注入经稀释的印度墨汁(0.10 ml/10 g),2 min(t1)和10 min(t2)后分别从眼底静脉丛取血20 μl,立即吹入盛有2 ml 0.1%Na2CO3溶液试管,吹吸数次以充分洗出采血血管壁附着的血液,摇匀,15 min后于分光光度计600 nm波长处测定吸光度值OD1(2 min 取血所测吸光度值)和OD2(10 min取血所测吸光度值),并于第二次采血后,脱臼处死小鼠,称体重,取肝、脾并称重[7]。按公式计算碳粒廓清指数K和吞噬指数α:碳粒廓清指数K=(lgOD1-lgOD2)/(t2-t1),吞噬指数α=K1/3×体重/(肝重+脾重)。
1.2.4MTT法测定PSP对ConA及LPS 诱导T、B淋巴细胞增殖反应的影响 取雄性BALB/C小鼠2只,脱臼处死,取脾,用培养液制备成浓度为4×1010/ml的脾细胞悬液。实验用96孔培养板,各孔加入ConA或LPS溶液各50 μl, PSP给药组分别加入0.125、0.25、0.5和1 mg/L的药液 100 μl,阴性对照组加入100 μl完全培养液,所有各孔均加入4×1010/ml的脾细胞悬液50 μl,混匀。ConA和 LPS的终孔浓度分别为7.5 mg/L和7.8 mg/L。培养板置于37 ℃、5%CO2、饱和湿度条件下培养。48 h后取出,1 500 r/min离心5 min,吸弃上清液100 μl,每孔分别加入MTT液20 μl后再培养4 h,取出,各孔加入80 μl DMSO,充分混匀,静置[8]。以200 μl/孔的蒸馏水调零点,用分光光度仪在波长为570 nm处测定各孔的光密度(OD)值。
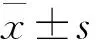
2 结果
2.1PSP对H22实体瘤小鼠瘤重及脾、胸腺指数的影响 与阴性对照组相比,PSP各组及阳性对照组实体瘤的重量明显减轻;PSP各组脾及胸腺的指数显著增加,而阳性对照组明显减轻,说明PSP 对脾、胸腺等免疫器官有一定保护作用。见表1。
2.2PSP对H22实体瘤小鼠血清中MDA、SOD、TNF-α含量的影响 与阴性对照组相比,PSP中、高剂量组MDA含量减少,差异有统计学意义(P<0.05),而低剂量组无明显差异。PSP各组SOD、TNF-α的含量明显增加,差异有统计学意义(P<0.05)。见表2。
2.3PSP对正常及免疫力低下小鼠吞噬指数的影响 PSP对免疫力正常小鼠吞噬指数无明显作用,差异无统计学意义(P>0.05)。而与模型组相比,PSP低、中剂量组小鼠吞噬指数明显增加,差异有统计学意义(P<0.05),提示PSP可显著增加CTX诱导的免疫力低下小鼠的吞噬指数。见表3。

表1 PSP对H22实体瘤小鼠瘤重及脾、胸腺指数的影响
与阴性对照组比较,*P<0.05,**P<0.01
2.4PSP对ConA及LPS诱导T、B淋巴细胞增殖反应的影响 PSP各剂量组促进ConA及LPS诱导的T、B淋巴细胞的增殖作用,与对照组相比,差异均有统计学意义(P<0.05)。见表4。

表2 PSP对H22实体瘤小鼠血清中MDA、SOD、TNF-α含量的影响
与阴性对照组比较,*P<0.05,**P<0.01

表3 PSP对免疫力正常及低下小鼠吞噬指数的影响
与模型组比较*P<0.01

表4 PSP对ConA及LPS诱导T、B淋巴细胞增殖反应的影响
与对照组比较,*P<0.05,**P<0.01
3 讨论
肿瘤是目前全世界的主要死亡原因之一,已经成为严重危害人类生命健康、制约社会经济发展的一大类疾病。世界卫生组织下属国际癌症研究机构(IARC)于12日发布了2018年最新全球癌症统计数据《全球癌症报告》,报告显示,2018年全球新增1 810万例癌症病例,死亡人数达960万,全球癌症负担进一步加重。肿瘤的治疗方法很多,从中草药中开发具有抗肿瘤的活性成分已经成为当前抗肿瘤药物的研究热点[9]。中药多糖的抗肿瘤作用的研究已达到分子受体水平,且多数学者认为多糖的抗肿瘤作用机制主要是通过增强肌体的免疫力而达到的[10]。
免疫系统主要包括淋巴器官、淋巴组织和淋巴细胞等。脾、胸腺是人体重要的免疫器官,胸腺是T细胞分化成熟的场所,脾是成熟T、B细胞定居的场所之一,也是这些细胞受到抗原等异物刺激后产生免疫应答的部位,对细胞免疫、体液免疫和巨噬细胞吞噬功能等发挥重要的作用[11],因此在药理免疫实验中,经常以药物对动物脾脏、胸腺重量的作用来初步探讨其对免疫功能指标的作用。本研究结果表明,PSP可明显抑制体内实体瘤生长,提高脾、胸腺指数。
免疫细胞是参与免疫应答或与免疫应答有关的细胞,包括淋巴细胞、单核巨噬细胞等。T细胞是淋巴细胞的主要组分,具有直接杀伤靶细胞、辅助或抑制B细胞产生抗体及抵御疾病感染、肿瘤形成等多种生物学功能。B细胞是主要的抗体分泌细胞,主要产生体液免疫。B淋巴细胞可在体液免疫中识别抗原,增殖分化形成记忆细胞和浆细胞,其通过细胞间接触和分泌细胞因子,参与免疫应答的调节。T、B淋巴细胞是肌体重要的免疫细胞,淋巴细胞转化实验是检测T、B淋巴细胞增殖活性的一种有效方法,常用来观察药物对肌体免疫功能的影响[12]。ConA(刀豆蛋白A)能诱导T细胞表达IL22受体,使T细胞活化。LPS (脂多糖)是B细胞的多克隆激活剂,能刺激B细胞发生有丝分裂。本实验结果表明,在没有其他免疫细胞参与的情况下,PSP对ConA诱导的T淋巴细胞和LPS诱导的B淋巴细胞的增值有明显的作用。说明PSP可直接作用于T、B淋巴细胞,促进T、B细胞的增殖,进而发挥抗肿瘤作用。
单核巨噬细胞系统是肌体非特异性免疫系统的重要组成部分,单核巨噬细胞的吞噬能力是衡量肌体非特异性免疫功能的标志之一。作为非特异性免疫功能之一,吞噬功能是免疫系统排除异物,清除自身衰老及突变细胞维持自身内环境稳定的重要手段。碳粒廓清实验是免疫学实验技术中非特异性免疫功能测定的常用方法之一。目前,国内外学者广泛使用小鼠碳粒廓清实验作为药物对非特异性免疫功能影响的检测指标。小鼠碳廓清实验中所测得的廓清指数K可反映网状内皮系统的吞噬功能,而吞噬指数α则可反映单核巨噬细胞的吞噬能力[13]。本研究结果显示,PSP可显著提高免疫力低下小鼠的吞噬指数。
MDA是活性氧对生物膜脂质分子过氧化作用的产物, MDA 高水平表达与癌侵袭力增强、恶性程度增高有关[14]。SOD 是氧自由基的清除剂,其与肿瘤的发生密切相关[15]。SOD上调能降低肿瘤细胞活力,抑制肿瘤细胞的转移[16]。肿瘤坏死因子(TNF)是一种主要由巨噬细胞分泌的多活性蛋白质细胞因子, 参与了癌症患者的病情发展和病理生理学变化[17]。研究表明TNF-α具有杀灭肿瘤组织的作用[18]。通过测定MDA 、SOD 和TNF-α含量可判断药物的抗肿瘤作用。本研究结果显示,PSP可明显降低MDA的含量,提高SOD和TNF-α活性,说明PSP抗肿瘤作用与氧自由基有一定的关系。
本文通过研究PSP的体内抗肿瘤作用表明,PSP可通过增强肌体免疫功能,发挥抑制体内肿瘤生长的作用,且其抗肿瘤作用与氧自由基也有一定的关系。PSP的抗肿瘤机制还需进一步研究,为其作为新型辅助抗肿瘤药物的开发提供理论基础。

