冰川消退带微生物群落演替及生物地球化学循环
周汉昌,马安周,刘国华,庄国强,*
1 中国科学院生态环境研究中心, 北京 100085 2 中国科学院大学, 北京 100049
冰川是全球冰冻圈生态系统的重要组成部分,主要分布在两极与各大洲高山顶部,覆盖近10%的地球陆地面积[1]。白色冰面能反射接受到的大部分太阳辐射,对于调节全球气候、缓解温室效应具有重要的意义[2]。从贮水量而言,冰川是全球最大的淡水生态系统,储存超过全球近80%的淡水水量。更重要的是,在每年的融冰期约10%的冰盖面积会发生消融[3]。而融水贡献了大陆性气候国家旱期径流总量的近50%,是下游区域居民用水、农业用水、工业用水的重要来源,同时对于缓解旱情及其引发的社会冲突尤为关键[4]。
自1850年代上个小冰川时代结束开始,全球气温以平均每10年0.6℃的速率上升[5]。这给全球各地生态系统的物质循环、物种组成、以及相关的多种生态过程带来不同程度的影响[6- 7]。冰川生态系统对于温度的升高极为敏感,最直观的体现是融冰期的延长、融水量的增大、消融速度的加快[8]。而冰川的消融暴露了前部原本位于冰川底部的岩石和沉积物,使得这些原本有机质含量、营养物含量、生物量均低的“三低”场所得以更直接地接受外界物质和能量输入,经过初生生态系统演替最终发育为成熟的生态系统[9- 10]。至20世纪末,冰川前部区域植物群落的演替已经得到相对充分地研究。而伴随着高通量测序技术发展,生态学家现在得以高效地探究冰川前部区域微生物群落的演替过程。
本文将从冰前区域生态演替过程中主要的物质循环建立、微生物群落动态变化、气候变化对微生物群落演替的影响三个方面综述近年冰川微生物学的研究成果。
1 物质循环
生态系统的演替过程伴随着物质循环的建立与完善,尤其是C、N、P和S循环的建立。由于每种元素在自然界的主要存在形式具有物理、化学性质差异,不同元素循环的建立过程并不完全一致。例如生态系统C和N的获取在演替初期主要来自外来物质的分解,而在演替后期则几乎完全由植物和固氮微生物提供。但演替过程中P主要来自土壤母质的矿化,难以由生物体从大气中持续性获得,导致P最终成为生态系统的主要限制性营养元素。本文将从主要的C、N、P和S元素循环的建立角度描述冰川前部环境生态系统演替的一般规律。
1.1 C循环的建立
生态学家之前认为冰前区域群落的演替开始于苔藓、地衣等植物的定殖,但后续研究发现蓝细菌在裸露岩石上的定殖远早于植物。Jinbo等[11]发现土壤有机C积累与蓝细菌光合相关基因cbbL丰度呈显著正相关,相似的结果也被报道出现在南极Anvers半岛、Damma等冰川前部土壤生物群落的演替中,表明蓝细菌是冰川前部生态系统植物定殖之前土壤有机C的主要来源[12- 13]。总体而言,演替初期蓝细菌生物量、土壤有机C和演替时间呈正相关。但值得注意的是一些具有特殊地理环境的冰川由于其自身独特的历史因素或地形因素,土壤蓝细菌丰度与土壤有机C的相关关系并不显著。例如Mendenhall冰川由于输出径流携带了大量的古旧有机C,动摇了蓝细菌固C的霸主地位[9]。而Larseman Hill冰川则是由于线路多变的径流和较高的土壤空间异质性导致演替过程中固C量失去了随时间以及蓝细菌丰度的线性关系[14]。此外,已有若干研究发现冰前土壤中存在一定丰度的化能自养型细菌,如自养反硝化菌和氨氧化菌等,暗示化能自养型微生物在早期土壤发育中可能存在可观的固C贡献度[15- 16]。
虽然蓝细菌对于演替最初期土壤的发育非常重要,它作为演替起始的地位却受到多方挑战。主要原因是冰川前部生态系统严格意义上不属于完全的初生演替,其C库至少包括3个方面[17]。第一类被称作当地C(Autochthonous organic carbon),代表蓝细菌等自养微生物固定生成的有机C[18]。第二类是近距离外来C(Local allochthonous organic carbon),包括来自冰川底部沉积物或表层冰尘洞等活跃微生物栖息地的C,也可能是外界植物凋落物和动物排泄物或尸体等[19]。第三类是随大气和降雨沉降的C,可能来自遥远的其他生态系统,称为远距离外来C(Distant allochthonous organic carbon)[20]。在蓝细菌定殖之前,原本遗留的冰川古旧C和大气沉降C就足以为异养微生物提供相对理想的栖息地,方便其分泌有机酸风化岩石促进土壤生成[13, 21]。目前多数研究发现在最新暴露区域(蓝细菌定殖之前)中存在丰富度较高的异养微生物群落,并检测出与有机质分解相关的纤维素酶和几丁质酶活性[22-23]。Mark等[24]在Odenwinkelkees冰川通过对土壤有机质14C同位素的定位研究直接证明冰川古旧C是早期演替阶段微生物重要的有机C来源。虽然现在冰前生态系统C库的组成已得到共识,但对于三种成分各自的比例、可利用性以及对于微生物群落演替的贡献度都存在知识空白[25]。
植物的出现加速土壤的分化、增加土壤有机质[26]。植物的凋落物和根系分泌物能向表层土壤和周边土壤输送大量种类丰富、可利用性各异的C源,极大地改变土壤C库的容量和性质,导致土壤C周转速率增加、呼吸速率的上升、酶活性的增强[26-27]。例如Allison等[28]发现植物凋落物显著促进演替后期土壤纤维素酶活性上升。而过氧化物酶和酚氧化酶是真菌细胞用于分解木质素等顽拗型植物有机物的两类主要酶,其活性在植物定殖后的土壤中显著高于裸露土壤[26]。对土壤不同阶段的有机物性质及成分进行分析发现,演替后期的有机物芳香性、大分子性显著高于前期[29]。这也与后期土壤单位质量有机C呼吸释放CO2速率低于前期土壤的实验结果相一致(虽然单位质量土壤CO2释放速率显著高于前期),表明C的可利用性随演替呈现下降的趋势[30]。随着植被覆盖度的增加,总有机碳(TOC)向土壤的输入逐渐达到阈值,TOC随演替的增量逐渐趋向零[31]。
除固C和呼吸作用外,可溶性有机碳(DOC)的淋融和CH4的释放与消耗也是C循环的重要组成。然而目前关于两者在消退带演替中变化情况的研究相对较少。已有部分研究发现DOC的淋融量会随演替呈增加的趋势[32]。但Sollins等[33]发现DOC的淋融与否不仅来自上方有机C的输入,还取决于土壤中Fe、Al等氧化物可进行吸附DOC的接触面大小,当吸附面积的风化形成速度高于有机C输入时,DOC的淋融会呈现减小的趋势。而岩石母质的风化是一个相对漫长的地理化学过程,因此关于冰前演替过程中C淋融的定量需要确保更长演替时间跨度的相关研究[34]。温度和DOC被报道是影响Alps高山地区CH4释放的主要原因,产甲烷菌和甲烷氧化菌的活性都随海拔的升高而下降、且与DOC呈正相关,表明演替时间越长土壤甲烷代谢活性越高[35]。室内培养实验也发现在田间持水量条件下演替后期的土壤甲烷释放速率高出前期土壤近30倍[36]。但在全年尺度上,整个土壤系统甲烷氧化活性高于甲烷产生活性,呈现出对甲烷的净消耗[37]。目前尚不存在研究对任意演替阶段包括固C、有机C输入、呼吸、甲烷代谢和淋融五个方面在内的C通量进行报道。
1.2 N循环的建立

土壤N库的建立和C库的建立呈现明显的相关关系,因为蓝细菌的nifH基因相对丰度远高于其他细菌,而且在演替过程中N的积累与蓝细菌的丰度呈正相关性[11]。所以有研究认为在植物定殖之前,微生物固氮作用主要由蓝细菌承担[40-41]。但与C循环最初建立阶段相似,N循环的建立也被认为起始于异养微生物。Brankatschk等[38]发现Damma冰前区域演替过程中外来有机N的矿化是演替初期的最主要N来源,而在演替50—70年随着固氮菌丰度陡然上升,主要N来源才逐渐转向固氮作用。对Mendenhall冰川前部最新裸露土壤的研究发现在演替0—4年的土壤中固氮酶活性均低于检测下限[42]。类似的结果陆续在其他冰川被发现,这些研究结果都指向固氮作用对演替过程中N的提供晚于矿化作用这一结论[26, 43]。Sarah等[12]甚至发现南极Anvers半岛即便是在蓝细菌定殖之后,土壤演替中的N也依旧主要由矿化作用承担。但在多数山地冰川消退区域的演替中后期,固氮过程最终取代矿化作用成为整个生态系统N输入的主体,甚至发育到能向下游生态系统输送多余N的程度[38]。
虽然矿化作用和固氮作用在演替的早期就已经存在,硝化作用和反硝化作用却在并未在该阶段表现出明显的活动迹象。不同演替阶段硝化势、反硝化势的测定结果表明直到植物定殖、土壤进一步发育之后硝化作用和反硝化作用才逐渐活跃[44]。但出人意料的是在演替的最初阶段硝化微生物与反硝化微生物的功能基因丰度就已经相当可观[44]。目前认为是演替初期的N含量低于硝化作用和反硝化作用所需的底物下限1.9—4.2 μmol/L,不足以引发相关功能基因表达[45]。Ashley等[46]发现冰川径流能从冰川底部带出可观数量的微生物,同时缺氧低温的冰川底部被报道存在活跃的硝化和反硝化微生物群落,因此在演替最初期不展现活性的硝化微生物和反硝化微生物可能是来自冰川底部尚未适应外界好氧、高温度波动(相对冰川底部)、强辐射条件的微生物群体[47]。也可能是植物的出现才营造出富含有机质、湿度适宜的土壤微环境供给反硝化微生物生长[48]。但造成硝化活性、反硝化活性延迟出现的具体原因目前还有待进一步研究。图1显示不同演替阶段C、N来源与各组分的相对比例(非定量)。可以看出演替早期C和N主要来自对外来物质的分解和固氮作用,之后微生物贡献的C和N输入比例开始增加,但最终成熟生态系统C和N的输入主要来自植物凋落物。
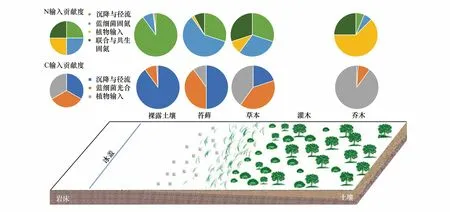
图1 不同演替阶段C和N不同来源的相对贡献度Fig.1 The relevant contribution of different source of C and N under different succession stage
1.3 P与S循环的建立
P是土壤微生物构建核酸、质膜等结构的基本元素,但目前对于冰川前部土壤演替过程中P动态变化的研究相对较少。Prietzel等[49]对比Hailuogou和Damma两处冰川发现演替初期磷灰石P和Al结合态P会被迅速消耗,有机态P的相对含量随演替逐渐增多并作为成熟生态系统表层土最主要的P存在形式,此时P具有较高的生物可利用性。植被的出现对P的转化产生重大影响,根系分泌物造成土壤酸化能显著提高P的移动性和可利用性[49]。对其他冰川生态系统的研究也发现P在演替中的生物可利用性增加,但土壤总P含量却因为土壤酸化和淋融而下降,而且随着演替进行P对于植物和微生物群落发育的限制性逐渐增强,并最终取代C和N成为生态系统中的最主要限制性营养元素[9, 23]。目前对于冰前区域演替过程中S的研究相对稀缺,Prietzel等[50]的报道发现Hailuogou冰川消退区土壤的发育伴随着S组分的变化,演替中期土壤总S浓度最高,在土壤A层可达到近1.36g/kg的浓度。但值得注意的是,不同S组分随演替的变化规律依土壤深度而变化,土壤C层S组分随演替的变化程度显著高于O层;同时演替最初期S组分中就包含占总S量30%—50%的有机S,表明冰川表层和冰川底部等具有活跃微生物代谢的栖息地可能是前部区域演替过程中重要的S输入源[50]。此外,对于其他具有不同气候、地理特征的冰川消退带S循环研究的需求仍很迫切。
1.4 C、N、P、S在各演替阶段的限制性
根据最小因子法则,群落发育受限于一种或几种关键的制约性因素。演替可看作一个群落不断变化并逐渐被取代的过程,在不同演替时期各营养物的限制性也不断变化。Yoshitake等[51]通过营养物添加实验发现Ny-Ålesund冰川演替早期受到C和N的共同限制;而伴随演替的进行 N的限制性逐渐减弱、C的限制性却依然持续。2016年他通过类似实验对富士山冰川消退带土壤的元素限制性进行探究,并发现演替后期C的限制主要来自C性质的变化而非C含量的变化,并发现后期土壤顽拗型C的增多是导致C限制性的原因[52]。这与其他实验从Damma冰川获得的实验结果相一致,单位质量有机C产生的呼吸量随演替逐渐下降、C的可利用性呈降低趋势[41]。目前多数研究发现C∶N随演替呈现增长趋势,都表明演替后期C在含量上已经相比N不处于限制地位,也进一步反应出C在性质上的限制性[31, 53]。
对于N的限制性研究结果存在较大差异,例如Goransson等[30]2011年发现从Damma冰川消退带150年的发育尺度看,N的限制性呈现逐渐缓解的趋势;但是他们也发现在群落演替的50—80年间会出现一段N限制性增高的现象,主要是由于植物的出现与微生物竞争利用N,但后来植物的根系共生固氮缓解了这一竞争[41]。而Joseph等[54]则发现给演替早期的土壤添加N肥能促进其中的微生物群落结构迅速进化为演替后期群落结构,体现出演替早期强烈的N限制性。而最近Turner等[15]对Franz Josef冰川前部0—120000年不同发育阶段的代表性土壤进行室内培养实验,发现C和P的添加并未对群落结构造成显著的影响,暗示整个土壤发育阶段N都对生态系统发育存在最大的限制性。因此,对于演替各阶段N元素的限制性仍然需要更广时间尺度和更多不同气候类型条件下的研究。
P能以磷灰石等成分直接贮存在岩石中并随着母质的风化不断释放。即便在母岩含P量较低的环境中,演替初期也未发现明显的P限制性[31]。P的大气沉降速率相对较低,随着演替过程生物量的增多与土壤母质中P的淋溶,生态系统对P的需求难以得到满足,因此P的限制性在后期达到最大,甚至被认为是导致后期演替进入衰退阶段的主因,引起植物生物量、生产力、多样性等多个指标的下降,而且P的这一变化趋势在诸如火山活动导致的其他土壤初生发育过程中也基本一致[30, 55]。目前对于S限制性的研究尚为空白。
2 微生物群落

图2 影响演替过程微生物群落多样性的主要因素 Fig.2 The main factors that affect microbial community biodiversity of succession
在生态系统演替过程中微生物群落的变化是一个动态且复杂的过程,主要包括微生物丰度、多样性的增加以及群落组成与结构的变化,而这些过程又与土壤的发育、理化因素的变化、植物和动物群落的定殖与发育、冰川自生所处环境等因素密切相关(图2)[56-57]。演替过程中造成微生物多样性增加的因素来自多个方面,包括但并不限于如图5个方面。而各因素对于微生物多样性的贡献度、以及它们在不同演替阶段贡献度的差异仍有待进一步研究。在非冰川生态系统的其他样地研究中,凋落物的多样性能直接增加微生物、尤其是真菌群落的多样性。而隔离动物采食会加速植被增长但是限制演替过程植物多样性的增加。
2.1 冰川消退带群落演替的一般规律
总体而言,冰川消退带生态系统演替中微生物(包括藻类、细菌、真菌、古菌、原生动物)的丰度和多样性随着演替均逐渐上升直至最大值,并在之后的一段演替时期内保持相对稳定,之后出现下降[58-59]。而且,微生物群落组成也随着演替发生较为规律性的变化;例如在演替初期细菌群落中一般以β-变形菌和拟杆菌的相对丰度最高,但随着演替进行两者相对丰度下降并逐渐被酸杆菌、放线菌、α-变形菌和γ-变形菌取代[60, 61]。真菌群落在演替初期多以子囊菌为主,但演替的后期则以担子菌为主[59, 62]。古菌群落则由以广古菌为主的群落向以泉古菌为主的群落偏移[59, 63]。随着植物有机C输入的增加,土壤真菌丰度/细菌丰度的值随演替上升[29]。值得注意的是驱动细菌群落、真菌群落、古菌群落演替的主要因素存在差异,三者的演替轨迹并不相同,有研究反应出细菌群落多样性更受到植物根系分泌物和N源种类的调控,而自由生真菌群落则对叶片凋落物的依赖程度更大[64-65]。同时从更低级的分类单元(例如纲、目,而非域、门)观察群落结构随演替的动态变化能获得更多的信息,也能避免由于分辨率过低造成对群落结构变化的误判[66-67]。
演替前期和后期土壤理化性质的变化被认为是造成群落组成差异的主要原因,其中pH、土壤有机质、土壤湿度被认为是最主要的影响因素[68-69]。一般土壤pH会随着土壤发育和群落演替下降,这导致更适应酸性条件的氨氧化古菌(AOA)的相对丰度和活性逐渐赶超氨氧化细菌(AOB)成为主要的硝化活动承担者;同样酸杆菌相对丰度在演替后期的上升也被认为和pH的降低有关[60]。在盐湖演替过程中含有nirK基因的反硝化微生物群落组成受到来自TOC的强烈影响,而含nosZ基因的反硝化微生物相对丰度则受到土壤湿度或者氧气含量的制约[70]。与此相似,冰前土壤发育形成的理化梯度也造成不同演替阶段反硝化微生物群落结构的差异[40, 70]。演替后期土壤有机质的增多显著提高放线菌中诺卡氏菌的比例;担子菌凭借更优秀的纤维素和半纤维素分解能力逐渐取代子囊菌成为演替后期真菌群落的优势物种[71-72]。伴随着各种环境基因组学技术的日益成熟,我们可以较为细致的比对不同演替时期土壤微生物群落功能、结构的微小变化,对各个功能微生物群落在演替过程中与环境因素相关关系的分析也将更为澄清[16]。
此外,对病毒群落演替过程的研究相对稀缺,这一方面源于病毒基因组相比常规微生物短小因而容易在测序结果的筛选中被作为垃圾序列清除,另一方面也是因为病毒基因组多变,难以设计通用引物进行针对性扩增[73]。但目前仍有少数研究对病毒群落的演替进行探讨。Bellas等[74]对冰尘洞的研究发现T4噬菌体群落甚至能2天发生一次周转,并且理论上是它导致全部异养微生物群落的死亡,暗示接受其物质和微生物输入的前部土壤可能也存在相关的病毒群落变化。而针对Svalbard冰川的研究发现噬菌体群落结构和宿主群落结构密切相关,土壤演替过程理化性质的变化可以改变噬菌体侵染活性,进而反过来影响微生物群落结构[75]。溶源态病毒侵染甚至被认为是细菌获得免疫其他烈性病毒攻击、增加功能性状、抵抗恶劣冰川环境的手段之一,体现了病毒和宿主之间奇特的“互助”关系[76]。生物芯片技术反应出演替过程中病毒群落的改变和宿主群落的演替关系复杂,是一个涉及侵染从蓝细菌等初级生产者到线虫等微生物顶级捕食者在内的网络结构,病毒因此既可以通过攻击生产者调控微生物群落也可以通过攻击顶端消费者解除食物链对某些微生物的限制[16]。
2.2 演替与微生物生理生态特征
微生物群落在冰川前部的演替行为体现出其竭尽所能占据可利用资源、最大化程度利用生态位进行生长和繁殖的集体智慧。在演替的最初,冰川底部暴露的裸露岩石占据主要的空间,只有来自大气沉降和冰川底部遗留的少量沉积物能为最初定居的微生物提供有限的C源、N源和能源;同时环境条件极其严苛,岩石表面昼夜温差甚至能达到50℃以上,自由水只在短时期内存在,白天紫外线强度甚至超过大多数藻类能承受的上限[77-78]。因此最初阶段定殖的微生物必须能够迅速利用周边资源进行存活、生长和繁殖,这要求它们代谢能力多样、具有较高的生长速率和繁殖能力,同时具有相应的环境抗性。而β-变形菌和拟杆菌门中的相当一部分微生物具备利用多种有机物进行呼吸产能的能力[79-80]。例如β-变形菌门中的Janthinobacterium就能利用来自冰川表层的少量沉积物寡养生存[21]。而伴随着演替的进行,尤其在植物出现以后,根系和凋落物一方面涵养水源保持土壤湿度,一方面向土壤输送大量的有机C,土壤温度以及辐射等环境波动显著变小,对于微生物而言整体生存环境变得更加舒适;土壤的分化程度增加、层与层之间理化性质差异变大,这造就了更多具有显著理化性质差异的生态位,因而可以滋养更为丰富多样的微生物群落[81-82]。例如表层土壤有机质含量较高,因而更适宜富养型α-变形菌等细菌的栖息,而底部土壤寡养、含氧量低,更适宜古菌的居住[15]。同时,根系是大量共生固氮菌、联合固氮菌、寄生型和共生型真菌的乐园,而远离根系的土块则主要以自生固氮菌和腐生型真菌为主,且丰度远小于根系区[83-84]。因此生态位的分化促进冰川前部演替过程微生物群落多样性的增加。
冰川消退带的演替还提供了一个验证“适用于宏观生物群落演替的规律是否同样适用于微生物群落演替”这一命题的天然平台。例如随着海拔和纬度的增加、年均积温下降,宏观生物成熟群落的物种丰富度也随之下降[85]。但是目前也有诸多研究报道即便是极地冰川消退区在微生物物种多样性方面也不亚于温带甚至热带冰川消退区[86-87]。这一方面是由于研究方法的精度差异导致,另一方面也可能是冰川环境本身较为特殊,因而其自身环境性质掩盖了纬度因素导致的差异。此外冰川消退带的演替也帮助我们理解随机过程和选择过程如何左右微生物群落的发展[88]。目前认为演替初期微生物群落受到扩散、定殖等随机因素影响更大,多变的环境因素导致演替前期的微生物群落具有更大的空间异质性和季节变异性,这也与演替早期群落结构更容易受外界环境变化干扰这一结果向符合;伴随着演替进行,环境波动逐渐稳定,环境对特定微生物的筛选效果逐渐增加,选择过程越加占据优势[89]。相比细菌而言,真菌由于细胞更大、随空气等介质扩散的能力更小,导致样地受到空间距离最近的真菌群落的影响最为显著,因而演替初期不同样地之间真菌群落相比细菌群落差异一般更大[62]。如图3所示,在演替初期面对新鲜空白的生态位,依靠随机扩散过程优先定殖的微生物如何在随后的演替中取得优势的现象:假设存在四种不同类型的微生物可以定殖,分别以不同颜色表示;那么在不存在环境选择的情况下,优先定殖的物种将成为优势微生物。这种随机过程将造成演替早期群落的空间异质性较大。
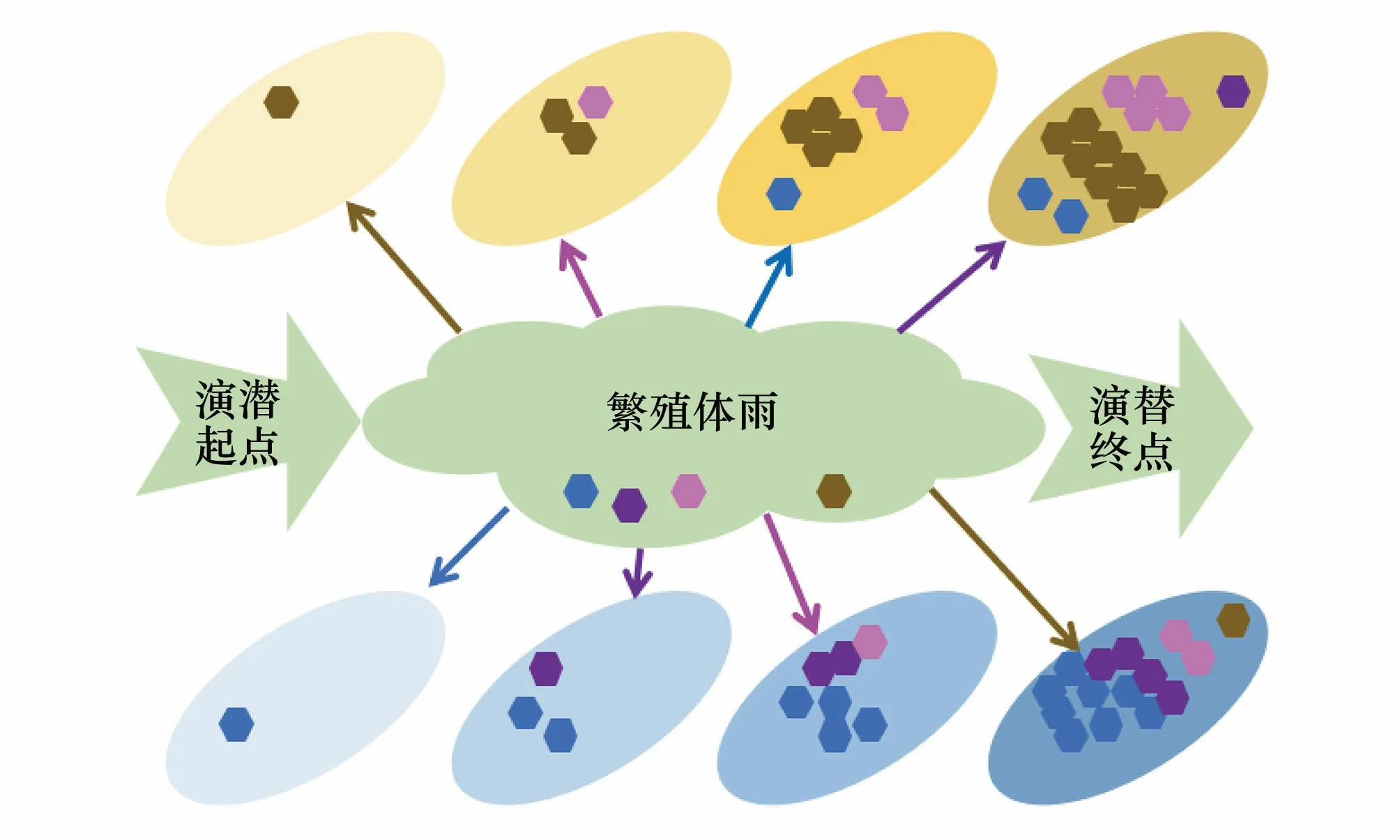
图3 定殖先后影响演替进程Fig.3 Colonization sequence influence succession progress
最后,冰川消退区土壤是稀有微生物的种质资源宝库。Yan等[66]发现Larsemann Hill冰川前部存在的大量低丰度微生物多个可操作分类单元(OTUs)在其他生境中的对应物都具有较为罕见的代谢功能。无独有偶,Miguel等[16]发现delFuegal冰川前部环境的微生物含有产多种抗生素以及其他药用型次生代谢产物的基因。而冰川径流作为冰前环境重要的微生物来源之一,其含有的微生物代谢多样化程度甚至可以和深海热泉口相媲美[90]。这些研究结果都反映出冰川消退带在物种资源方面具备的价值。
3 气候变化的影响
21世纪的全球气候变化引发的生态系统响应程度引发国际社会的广泛关注,各生态系统中的非生物组分和生物组分都受到不同程度的影响,但冰冻圈响应程度最为剧烈[91]。以Alps山区为例,过去50年间当地年均气温上升幅度是全球年均气温上升幅度的两倍;若如此持续,当地许多为下游地区提供重要水源的中小型冰川将在未来几十年彻底消失,总冰盖损失面积达到80%以上,这为生态系统的演替提供出大量新空间[10]。
不仅如此,升温是群落演替有效的促进剂。对世界范围内植被线的宏观分析显示高达52%的研究位点植被线都在经历上移,只有1%的植被线在下降[92]。植被甚至开始在消融仅一年的区域定殖,相比之前文献记录的定殖速率高出近四倍,而且生物量比之前的最早期植物群落高两倍[10]。这意味着共生固氮和联合固氮作用相比以前能更早在演替中达到优势地位,缓解早期演替的N限制性;同时,植物的定殖能提高土壤呼吸约20倍[93]。Panikov等[94]通过室内培养实验发现3℃的升温能导致寒温带土壤呼吸速率增加4倍以上。C周转的加速导致土壤发育的加速,使得冰前区域从最初的C积累生态系统更快的变为具有高C流通量的成熟生态系统[95]。气候变化对冰前环境演替的效应和对其他冰冻圈栖息地的效应存在一定区别。例如冻土区存在大量冰封有机C,解冻将释放之前储备的CO2,加剧温室效应[96-97]。但是气温升高会导致冰前区域演替初期的蓝细菌和植物群落加速对有机C的固定、促进CO2的净沉降,因此结合上述两个相反的效果,整个过程对温室效应不一定起到正反馈作用(图4:图中红色箭头代表促进、绿色箭头代表削弱、黄色箭头代表效果未知),具体的响应程度和行为需要更多原位观测数据与更精细的模型共同验证[25]。
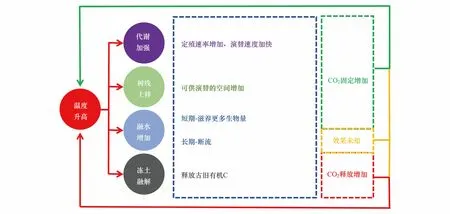
图4 温室效应对于冰前环境的影响以及相应反馈Fig.4 The influence of Greenhouse effects to glacier foreland and the corresponding feedback
气候变化对于冰前生态系统演替的影响还在于其深刻地影响微生物群落的丰度、结构和功能。例如温度的升高会促进植物向土壤输送更多的凋落物(增加约60%)和分泌物(增加约40%),并导致土壤厌氧微生物群落相对丰度的提高[94]。Cauvy-Fraunié[98]也发现温度的升高导致冰前径流中藻类生物量的上升,这可能造成演替初期以藻类及其分泌物为食的异养微生物更快更多地定殖。生态学家之前认为微生物群落相比宏观动植物群落面对气候变化更具恢复性,但通过多年野外直接观测Martiny等[99]发现微生物群落并没有预想那么坚韧;宏基因组测序结果也发现土壤微生物群落分解碳水化合物等较为基础的代谢能力受到温度和降水格局变化的强烈扰动。不仅如此,虽然山地栖息地和群落的数目因气温上升而普遍增加,但微生物的物种多样性却受到了严重的威胁,原本属于高度特化的山地植物物种正逐渐消失,这意味着与这些植物相关的微生物也存在消失的潜在风险[100-101]。Alps区域被报道已经出现稀有微生物物种的迅速减少[102-103]。很多低丰度稀有种是微生物群落功能的重要承担者,它们的消失会带给群落功能怎样的变化我们仍不得而知[90]。
另外,气候变化对于冰川体系的影响是复杂的,因此对于冰前环境演替的作用也很难一概而论。例如降雪的减少和降雨的增多、融冰速度的加快等原因提高了冰前径流的输出量,这为营养物贫瘠的冰前环境提供更多来自冰川表层和底部的沉积物[104-105]。但是如果径流量过大,尚未充分发育的早期演替土壤非但不能接受沉积物加速演替,反而会被冲向下游将之前的演替成果归零[106]。目前全球多数冰川都因升温导致融冰期径流的增加,但是若干年后,多数冰川会因为冰储存量的耗竭而无法继续在旱季输出足够融水供给下游生态系统发展,那时群落演替受到气候变化的影响可能与现在截然相反,只是目前无法预测[107]。因此,对于气候变化带给冰前区域群落演替影响的评估需要结合更多气象、水文、生态、生物甚至人文政策的指标,采用更精细、考虑更多参数的模型加以预测,并通过对全球典型冰川系统的监测值进行验证才能达到全面详尽[25, 108]。
4 结论
人们能在不同演替阶段冰川消退带观测到不同景观特征。而土壤微生物群落的演替也呈现出明显的阶段性,物质循环与群落功能逐步完善。群落结构与物种组成随着演替不断变化,各物种最大化利用有限的生态位。随着生态位的多样化,物种丰富度逐渐增加。最终,生态系统从一个以依赖外源营养物和有机C输入为主的初期生态系统逐渐成长为一个自给自足且具有高物质通量的成熟生态系统。微生物群落的演替及其所在的生态系统都受到来自气候变化的影响,虽然已有研究认为升温会导致演替的加速和稀有物种的减少,但从长远角度看气候变化对冰前生态系统造成的影响可能远不仅如此,这仍需进一步的研究。
虽然从物质循环、群落变化及应对气候变化方面对冰川消退带的生态演替有了一定的认知,但仍存在诸多空白与不足。第一,在演替各个阶段,尤其是演替初期,定量不同途径来源的物质通量以及它们对微生物群落演替的限制程度仍有待研究;此外演替初期化能自养菌是否提供了可观的固C也有待证明。第二,目前大多数研究都没有涉及全年尺度或者季节性变化对于演替的影响,但季节因素可能造成微生物群落功能和结构的较大变化;同时,受气候变化最为敏感的季节是冬季,对于该季节微生物群落活动的研究是我们准确估算气候变化对冰前生态系统影响的重要前提之一,但目前此部分研究相对匮乏[46, 109]。在全球典型冰川设立合适的野外观测实验站、进行全年物质通量监测对于我们深入理解冰前生态系统微生物群落应对气候变化的响应机制、响应程度以及确定冰前生态系统与外界的物质交换十分必要。第三、将演替过程作为一个空间生态位分化的过程去理解不同微生物的演替轨迹和最终定位,结合微生物生理行为分析微生物在空间上的分布、变化模式甚至相互作用模式与协同演替规律。第四、动物群落,例如土壤线虫、节肢动物、小型食草类脊椎动物等对于土壤微生物群落演替的影响尚缺乏研究,动物的进食、运动、排泄等行为都可能加速营养物循环和微生物物种的扩散。最后,随着冰川的不断消融甚至消失,冰川消退带作为研究微生物演替天然实验室的价值也与日俱增,充分利用当下资源是当务之急[25]。

