MRI结合PET-CT在脑胶质瘤术前诊治中的应用*
新乡医学院第一附属医院神经外科(河南 新乡 453000)
徐大伟 马鹏举 高国军黄立勇 王仲伟 金保哲周文科
脑胶质瘤是起源于神经上皮组织的颅内恶性肿瘤,临床较常见,居于儿童恶性肿瘤的第二位,约占脑内肿瘤的40%~50%[1]。目前关于胶质瘤的分级中最常用的为世界卫生组织(WHO)的分级系统[2],根据此系统及病理表现,脑胶质瘤可分为低级别脑胶质瘤及高级别脑胶质瘤两大类。近年来,脑胶质瘤的发病率逐年递增,增长率达1.2%/年,据统计,我国脑胶质瘤年发病率达3-6人/10万人,死亡人数达3万/年,提高脑胶质瘤的治疗效果对我国人民健康水平的提高至关重要[2]。脑胶质瘤治疗方法包括手术、放疗、化疗、靶向治疗等,临床需要综合考虑患者肿瘤位置、恶性程度、预后等情况采取个性化的治疗,对于高度怀疑为脑胶质瘤的患者,临床常采用常规头部 CT及MRI检查脑胶质瘤进行初步诊断,其对脑胶质瘤的恶性程度分级及预后判断价值还有待提高[3],本实验拟采用MRI结合PET-CT检查,旨在探索更多有效途径,为脑胶质瘤的术前诊断提供更准确全面的信息,提高脑胶质瘤的治疗效果,具体如下。
1 资料与方法
1.1 一般资料研究我院神经外科近两年(2016年3月~2018年3月)收治的84例临床怀疑为脑胶质瘤患者术前MRI及PET-CT检查影像及术后病理检查资料。纳入标注:①有头痛、恶心及呕吐、癫痫、视物模糊等症状;②所有患者检查前未接受任何治疗;③无精神障碍配合良好;④无肝、肾及其严重器质性疾病;⑤患者及家属同意,并通过经我院伦理会审核。排除标准:①造影剂过敏;②合并心、脑、肾等严重脏器功能不全;③有精神障碍不能配合检查;④体内留有金属异物不能去除;⑤恶性肿瘤疾病;⑥孕妇及哺乳期妇女;⑦图像质量差影响诊断。所有受试者年龄10~65岁,平均(40.12±9.32)岁;男女比例为51/33;临床症状中头痛62例、恶心25例、癫痫25例、视力下降9例、肢体运动障碍23例、语言障碍5例、无症状者1例。
1.2 检查方法
1.2.1 MRI检查:所有被检者均采用Siemens TRIO 3.0 T MR扫描仪,加用8通道头部专用线圈,对比剂采用钆喷酸葡甲胺注射液(Gd-DTPA)(北京北陆药业股份有限公司,国药准字H10860002,规格:10mL:4.69g)。检查前嘱被检者取下假牙、眼镜、项链等体表金属物品。患者取仰卧位,双手置于身体两侧或胸前,成像范围从听眶线至颅顶。
MRI平扫:扫描序列包括自旋回波序列(SE)、快速自旋回波序列(TSE),液体反转恢复序列(FLAIR)、弥散加权序列(DWI),常规行横断面T1WI、T2WI、FLAIR、DWI扫描,矢状面T1WI,扫描野(FOV)为220mm×220mm,层厚5mm,间隔2mm,层数18,矩阵512×512;
MRI增强扫描:被检者在检查前半小时做对比剂过敏试验。采用高压注射器以2mL/s速率注射Gd-DTPA,注射完立即做增强扫描,成像序列一般与增强前T1WI相同,常规行冠状面、矢状面、横断面T1WI扫描,FOV为220mm×220mm,层厚1mm,间隔1mm,层数160,矩阵512×512。
按照相关操作规范进行扫描,扫描过程密切关注被检者有无不适,结束后检查图像,确认无误,释放受检者。
1.2.2 PET-CT检查:所有被检者均采用GE Discovery LS PET-CT扫描仪,显像剂选用11C-蛋氨酸(11C-MET)。受检者无需禁食禁水,取仰卧位,封闭视听,先经静脉注射11C-MET,注射剂量为0.15~0.20mCi/Kg ,休息20min后进行扫描。扫描范围为范围为颅顶至颅底,包括CT平扫及发射扫描,CT平扫层厚2.5mm,矩阵512×512,PET图像采集选用3D模式,层厚5.0mm,矩阵128×128。选择11C半衰期行衰减校正,校正后行重建三维图像,层厚5mm。在病灶MET聚集最高的区域勾画感兴趣区(ROC),并以勾画出对侧同样位置同样大小的区域,进行定量分析,计算病变标准摄取值(SUV)及T/N值(病变组织SUV最大值/对侧相同位置正常脑组织SUV值)。
1.2.3 病理检查:84例患者中36例行开颅手术,其余48例行立位定向穿刺活检。所有操作均由经验丰富的神经外科医生严格按照操作要求进行。
1.3 结果及评估
1.3.1 MRI及PET-CT诊断标准:MRI诊断脑胶质瘤标准[4]:(1)低级别脑胶质瘤:病灶边缘清楚或不清,T1WI上呈均匀低信号,T2WI上呈均匀高信号,肿瘤出血、坏死、囊变等少见,周围组织水肿较轻,MR增强后,肿瘤无明显强化。(2)高级别胶质瘤:病灶边缘边界不清,T1WI上呈不均匀低信号,T2WI上呈不均匀高信号,形状欠规则,肿瘤内可有出血、坏死、囊变等,周围水肿明显,MR增强后肿瘤不均匀强化,部分可见环形强化。
PET-CT采用T/N值评定脑胶质瘤[5]:(1)低级别脑胶质瘤,T/N值<1.5。(2)高级别胶质瘤:T/N值≥1.5。
MRI结合PET-CT诊断,在MRI诊断基础上增加T/N值进行胶质瘤等级评定,以PET-CT诊断结果为主。
由我院1位经验丰富的影像科医生及1位神经外科医生采用“双盲法”对患者MRI及 PET-CT影像图像进行查阅并给出详细的诊断,若有分歧,则相互协商或寻求第三者意见,最终达成一致诊断。
1.3.2 病理检查结果:脑胶质瘤病理分级标准[2]:(1)低级别胶质瘤(WHO1~2级),分化良好,虽然在生物上不属于良性肿瘤,但预后相对较好。(2)高级别胶质瘤(WHO3~4级),分化差的恶性肿瘤,且预后较差。
由2位经验丰富病理科医生行病理切片并进行免疫组化检查、电子显微镜下检查、流式细胞术检查等,详细记录检查结果,若有分歧,则相互协商或寻求第三者意见,最终达成一致诊断。
1.4 数据分析MRI及PETCT术前检查结果及灵敏度、准确度、特异度的评估以例(n)及百分数(%)形式表示,选用χ2检验,数据分析用SPSS 19.0软件处理,P<0.05,差异有统计学意义。
2 结 果
2.1 病理检查结果84例高度疑似脑胶质瘤患者病理检查阳性76例,阴性8例,均为单发肿瘤。根据脑胶质瘤分级,高级脑胶质瘤21例,低级脑胶质瘤55例。
2.2 MRI检查与病理检查结果比较MRI诊断为脑胶质瘤阳性73个,阴性11个,MRI检查的灵敏度、特异度、准确性分别为96.05%(73/76)、100%(8/8)、96.43%(81/84),评估脑胶质瘤分级的准确性为75.00%(57/76)。
2.3 MRI结合PET-CT与病理检查结果比较MRI结合PET-CT对脑胶质瘤术前诊断的灵敏度、特异度、准确性分别为98.69%(75/76)、100%、98.81%(83/84),评估脑胶质瘤分级的准确性为93.42%(71/76)。
2.4 MRI结合PET-CT与单独MRI检查诊断脑胶质瘤分级比较MRI结合PET-CT对脑胶质瘤术前评估的准确性显著优于单独MRI检查(P<0.05)。
3 讨 论
脑胶质瘤的诊断需要综合患者的临床表现、辅助检查及术后病理等结果。患者临床表现多取决于肿瘤生长位置,肿瘤占位效应可引起局部脑组织功能障碍,根据患者相应的症状、体征及病史可以初步推断肿瘤所在部位及肿瘤恶性程度[4-5]。脑胶质瘤的影像学表现是胶质瘤诊断及鉴别的主要依据,常规头颅MRI平扫及增强扫描可判断肿瘤的良恶性,明确肿瘤大小、数目和累及范围,指导手术,并常用于患者术后随访复查[5-6]。通过MRI图像中病变组织的信号表现可以反应出肿瘤出血、囊变、坏死、水肿、占位等情况,且肿瘤在T2WI图像及增强前后T1WI图像中信号特点及变化常作为脑胶质瘤分级的依据[6]。但有学者发现病变部位强化程度并不能真正反映肿瘤血管生成情况及肿瘤的恶性程度,局部组织新生血管内皮不完整或者是血脑屏障功能受损时,对比剂进入细胞间隙增多,均会导致组织增强明显[7],因而MRI检查不能完全准确判断脑肿瘤的分级。
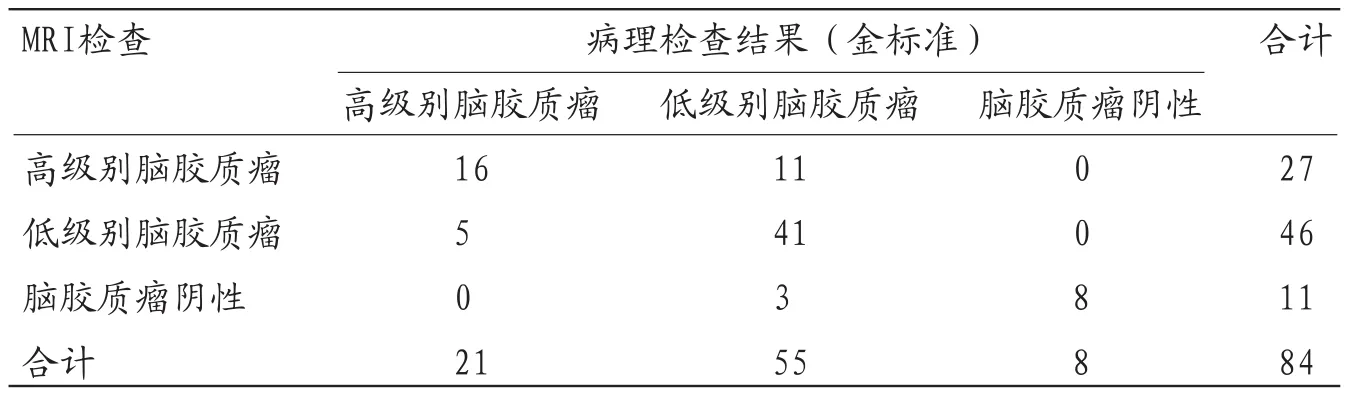
表1 MRI诊断结果与病理结果比较
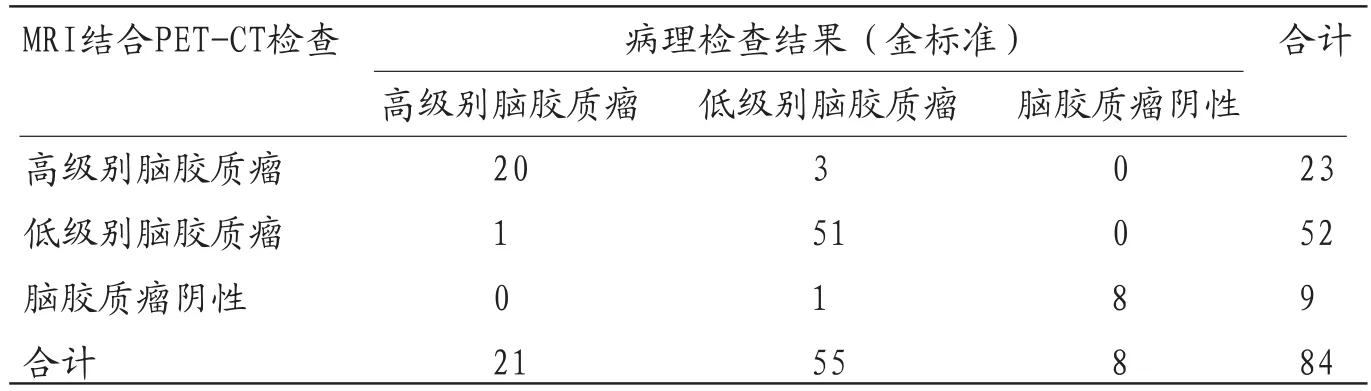
表2 MRI结合PET-CT诊断结果与病理结果比较

表3 MRI结合PET-CT与单独MRI检查评估脑胶质瘤分级比较
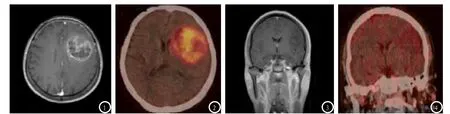
图1-4 脑胶质瘤MRI 结合PET-CT检查图像。图1-2 患者女性,71岁,右手乏力,语言障碍,术后病理诊断为胶质母细胞瘤(高级别脑胶质瘤)。图1示左侧额颞叶类圆形肿块,MR增强后病灶表现不均匀强化,图2 PET-CT示左侧额颞叶病灶11C-MET摄取高,SUV最大值5.8,对侧同样位置正常脑组织SUV2.0,T/N值为2.9,诊断为高级别脑胶质瘤。图3-4 患者男性,36岁,头痛伴抽搐,术后病理诊断为星形细胞瘤(低级别脑胶质瘤)。图3示左侧岛叶及左额叶皮层下类圆形肿块,MR增强后病灶内可见散在点片状强化区,图4 PET-CT示左侧额颞叶弥漫性轻度11C-MET摄取轻度增高,SUV最大值1.9,对侧同样位置正常脑组织SUV1.6,T/N值为1.19,诊断为低级别脑胶质瘤。
常规MRI检查在反映脑胶质瘤生理学特性方面存在一些不足,不能提供肿瘤血管生成、肿瘤细胞代谢、病灶细胞构成等信息[6]。随着影像学技术的发展,PET-CT显像技术及放射性药物的研究为脑胶质瘤的诊断提供了新的依据和方法,其显像原理是追踪正电子核素标记的分子运动状态来评估肿瘤的生理及生化功能状态,在判断肿瘤范围、分级、异质性、增殖活性等方面更具有优势[8]。目前常用的脑胶质瘤的显像剂包括18F-脱氧葡萄糖(18FFDG)、11C-蛋氨酸(11C-MET)等。18F-FDG为葡萄糖类代谢产物,临床应用广泛,由于恶性肿瘤增殖快,代谢水平高,对葡萄糖利用率也随之增加,18F-FDG可以从分子水平反映出肿瘤的病理变化,但由于正常脑组织对18F-FDG的摄取率较高,无法与低级别脑胶质瘤区分,在脑胶质瘤PET-CT显像中具有一定的局限性[9]。11C-MET为氨基酸类显像剂,在脑胶质瘤PET-CT显像中应用最多,可以反映机体氨基酸及蛋白质的代谢及运动状态,恶性肿瘤代谢旺盛,蛋白质合成增加,对11C-MET摄取增多,病变坏死组织对11C-MET摄取明显减少[10]。由于正常脑组织对11C-MET摄取率低,故该显像剂能清楚显示脑胶质瘤,尤其对低级别的脑胶质瘤显示效果明显优于18F-FDG[10],因此本次实验选用11C-MET。
实验结果显示PET-CT对脑胶质瘤的术前诊断的灵敏度、特异度、准确度方面显著优于常规MRI检查,具有较高的临床诊断价值,但是PET-CT属于核医学检查方法,辐射剂量较大,可能增加患癌风险,且价格较高,不宜作为常规检查[12]。MRI常规检查无辐射且安全可靠,在脑胶质瘤的术前诊断中具有一定的价值,PET-CT可作为MRI检查的补充检查手段,在肿瘤诊断以后判断肿瘤的分级及预后,并指导脑胶质瘤的临床治疗。MRI结合PET-CT对脑胶质瘤术前诊断具有更高的价值。

