相同摄氧量下向心运动和离心运动对脂代谢肌肉因子激活作用的对比研究
刘阳 何玉秀 梅家顺
1 河北师范大学体育学院人体运动生物信息测评省重点实验室(石家庄 050021)
2 河北师范大学体育学博士后科研流动站
肥胖已经成为日益严重的社会问题,而运动是目前公认的安全、有效的减肥方法之一,然而何种运动方式或运动强度的减肥效果最佳目前仍不能确定[1,2]。运动减肥的最主要机制是骨骼肌收缩引起的能量代谢改变和脂肪分解增强。近年来研究发现,骨骼肌可作为一个内分泌器官向血液中释放调节物质,Pedersen等在2003年首次将这些物质命名为“肌肉因子(Myokine)”[3]。在常见的肌肉因子中,鸢尾素(Irisin)和肌联素(C1q tumornecrosis factor-related rotein 15,CTRP15)与脂代谢密切相关。Irisin是肌细胞内合成纤维连结蛋白Ⅲ型域包含蛋白5(fibronectin typeⅢ domain-containing protein 5,FNDC5),经蛋白酶剪切分泌入血的肌肉因子,可通过诱导解耦联蛋白1(UCP-1)高表达,促进脂肪氧化分解。CTRP15同样由骨骼肌分泌,可以促进游离脂肪酸向脂肪细胞内的转运。这两种脂代谢肌肉因子在运动减肥过程中扮演着重要作用[4,5]。
研究证明[6],不同的运动方案,即使能量消耗水平相当,其减肥效果也不相同。这可能与不同运动方案对肌细胞的刺激不同有关。我们之前的研究显示[7],离心收缩对骨骼肌的刺激更为明显,相对于向心收缩可以造成更显著的肌细胞胞浆“钙超载”现象,而细胞内钙离子浓度的升高对CTRP15和Irisin的上游调控蛋白过氧化物酶体增殖物激活受体γ辅激活因子1α(PPARγ coactivator 1-alpha,PGC-1α)均有激活作用。因此离心运动相比于向心运动,可能会更强烈地刺激肌肉分泌脂代谢相关的肌肉因子。Trevor的研究显示,能量消耗更低的下楼(离心收缩)运动与能量消耗更高的上楼(向心)运动的减体重效果相同,但离心运动对血脂、血压和安静心率的改善效果较向心运动更好[8]。这种现象可能与离心收缩刺激骨骼肌分泌更多脂代谢肌肉因子有关。
本研究给予大鼠一次相同摄氧量的向心和离心运动干预,对比观察两种运动后0~48小时内骨骼肌FNDC5、血清Irisin和Ctrp15的变化,初步从分子层面探讨减肥运动处方中,肌肉的离心收缩形式是否能够有效地刺激脂代谢肌肉因子的分泌,从而更显著地改善机体脂代谢。
1 对象与方法
1.1 实验动物与分组
洁净级8周龄雄性SD大鼠78只,体重200.0±19.8 g,购于北京维通利华动物公司。自由摄食饮水,温度控制在24℃±3℃、湿度40%~60%。随机分为摄氧量测试组(OE组和OL组,n=6)、安静对照组(C组,n=6)、向心运动组(E组,n=30)与离心运动组(L组,n=30)。参考相关研究,由于离心训练会使骨骼肌在运动后0~6小时与24~48小时出现显著的结构改变与细胞胞浆钙超载现象[7],而钙离子浓度又正是Irisin与CTRP15的上游信号,故对运动干预组在运动后0、6、12、24、48小时分别进行取材。具体分组见表1。

分组 亚组 干预方式 运动后取材时间点向心运动组(E组)E0 E6 E12 E24 E48向心运动即刻6小时12小时24小时48小时离心运动组(L组)L0 L6 L12 L24 L48离心运动即刻6小时12小时24小时48小时
1.2 运动方案
首先对OE和OL组在动物气体分析仪(Oxymax Equal Flow,Columbus,美国)内的跑台上进行特定跑速下的摄氧量测试。3天适应性训练后进行正式测试。根据Høydal的动物模型[9],OE组采用约70%VO2max强度跑台训练,跑速20 m/min,坡度为0°。OL组用相同的跑速,相比常用的-10°或-15°下坡跑方案,使用较小的下坡跑坡度(-5°)进行训练时,OL组摄氧量与OE组较为接近。也有研究者使用接近-5°的坡度(相对坡度8.5%~10%)成功进行了离心运动训练[10,11],故本研究最终选用-5°作为下坡跑运动干预的坡度。
通过观察训练时摄氧量曲线稳定至出现摄氧量平台,取平台期摄氧量平均数为该鼠在此训练方案下的摄氧量,如测试时间超过10 min仍未出现平台则实验终止。测试所得OE组与OL组摄氧量数据见表2,两组摄氧量独立样本t检验P=0.94,无显著性差异,说明大鼠在20 m/min的跑台运动中,采用0°平坡跑运动与-5°下坡跑运动摄氧量相同。

表2 向心与离心运动平台期摄氧量
在OE与OL组确定运动摄氧量后,对E组与L组进行一次与OE和OL组相同跑速的跑台运动。由于本研究采用一次运动的干预方法,参考相关研究[7,9],为避免大鼠对未知环境产生应激,首先进行3天低强度适应性运动,跑速5 m/min,时间10 min,之后进行正式运动干预,E和L组跑速均为20 m/min,时间60 min,E组跑台坡度0°,L组为-5°。如有大鼠无法完成1小时的训练而提前达到力竭,则将其从实验对象中剔除。
1.3 取材
E组与L组进行一次运动后,分别在0、6、12、24、48小时取材。C组在E和L组取材结束后3小时内完成取材。大鼠腹腔注射5%戊巴比妥钠(50 mg/kg),右心耳处取血,4℃静置20 min,3500转/min离心15 min后,抽取血清-80℃冻存。取血后剥离腿部肌肉,取右侧腓肠肌肌腹部分液氮保存以备蛋白表达测试。E0、L0、E12、L12组左侧腓肠肌固定后进行电镜观察(方法见1.4)。
1.4 骨骼肌微细结构观察
根据以往研究[7],离心运动后12~24小时肌细胞微细损伤达到峰值。为验证本研究-5°下坡跑训练方案能够达到离心运动对肌细胞造成的微细损伤效果,采用透射电镜观察运动后即刻与12小时腓肠肌微细结构变化。取材获得的肌肉组织纵切成为3 mm×2 mm小块,4%戊二醛固定,1/15 m磷酸缓冲液洗3次,1%锇酸固定,1/15 m磷酸缓浸洗2次,丙酮梯度脱水(50%、70%、80%、90%、100%),丙酮渗透3小时,包埋剂渗透5小时,37℃聚合12小时,超薄切片,醋酸双氧铀和酸铅双重染色。随机选取视野,观察Z线和线粒体形态。
1.5 骨骼肌PGC-1α、FNDC5蛋白表达
使用蛋白质免疫印迹法(Western blot)测试大鼠腓肠肌PGC-1α、FNDC5蛋白表达量。肌肉匀浆并裂解后,BCA法测定蛋白浓度。加入5倍Loading Buffer,煮沸。SDS-PAGE凝胶体系,浓缩胶4%,分离胶10%~12%。80 V,50 mA电泳至样品进入分离胶,120 V电泳直至结束。PVDF膜湿转,恒流300 mA,90 min。脱脂奶粉封闭2小时,一抗4℃孵育过夜(PGC-1α、FNDC5一抗为兔抗鼠抗体,稀释比例均为1∶2000,购自Abcam)。TBST洗四次后二抗(羊抗兔抗体,稀释比例1∶10000,购自中杉金桥)孵育2小时,再洗5次后发光。凝胶成像系统分析蛋白质印迹灰度,使用GAPDH作为内参计算蛋白质表达。
1.6 血清Irisin、CTRP15含量
血清Irisin和CTRP15浓度采用酶联免疫法(ELISA)测试,严格依照试剂盒步骤操作(Irisin试剂盒购自Phoenix Pharmaceuticals,CTRP15试剂盒购自 Nordic BioSite)。
1.7 统计学方法
数据使用平均数±标准差(±s)表示。蛋白表达的计算以对照组数据作为干预前基础值(baseline),取其表达量为1,并将所有组条带灰度值除以对照组灰度值,得到相对蛋白表达量。使用双因素方差分析(Twoway ANOVA)进行数据统计,以运动方式(向心和离心)和取材时间(对照组作为运动前、运动后0~48小时)为固定因子。如两因子存在显著交互作用,则以简单效应(simple effect)分别分析两种运动前后不同时间点的变化差异;如不存在显著交互作用,则以主效应(main effect)来反映两种运动的效应差异;多重比较采用最小显著性差异法(least significant difference,LSD)两两比较各时间点间和各运动组间差异。统计软件为SPSS24.0,取P<0.05为显著性差异,P<0.01为非常显著性差异。
2 结果
2.1 离心与向心运动对骨骼肌微细结构的影响
如图1所示,在一次运动结束后即刻,向心运动组骨骼肌细胞Z线排列较为整齐,离心运动组则出现了Z线扭曲的现象。在运动结束后12小时,向心运动组出现了少量的Z线扭曲,而离心运动组则出现了大量的Z线扭曲和明显的线粒体膨大现象,显示坡度缩小至-5°的下坡跑依然能够造成相当程度的骨骼肌微细结构改变。
2.2 离心和向心运动对骨骼肌PGC-1α和FNDC5蛋白表达的影响
如图2、表3所示,双因素方差分析显示,取材时间(0~48小时)和运动方案(向心、离心)两因素无显著交互效应(P>0.05),不同运动方案间存在非常显著的主效应(P<0.01),说明离心运动比向心运动对PGC-1α表达作用更明显。不同时间点之间也存在显著主效应(P<0.01),多重比较显示,运动后即刻、6小时、24小时和48小时,两组PGC-1α蛋白表达量均显著高于对照组(P<0.05或P<0.01),12小时与安静对照无显著差异。说明离心和向心训练后,PGC-1α除12小时回落至基线值外,在48小时内一直维持着高表达。
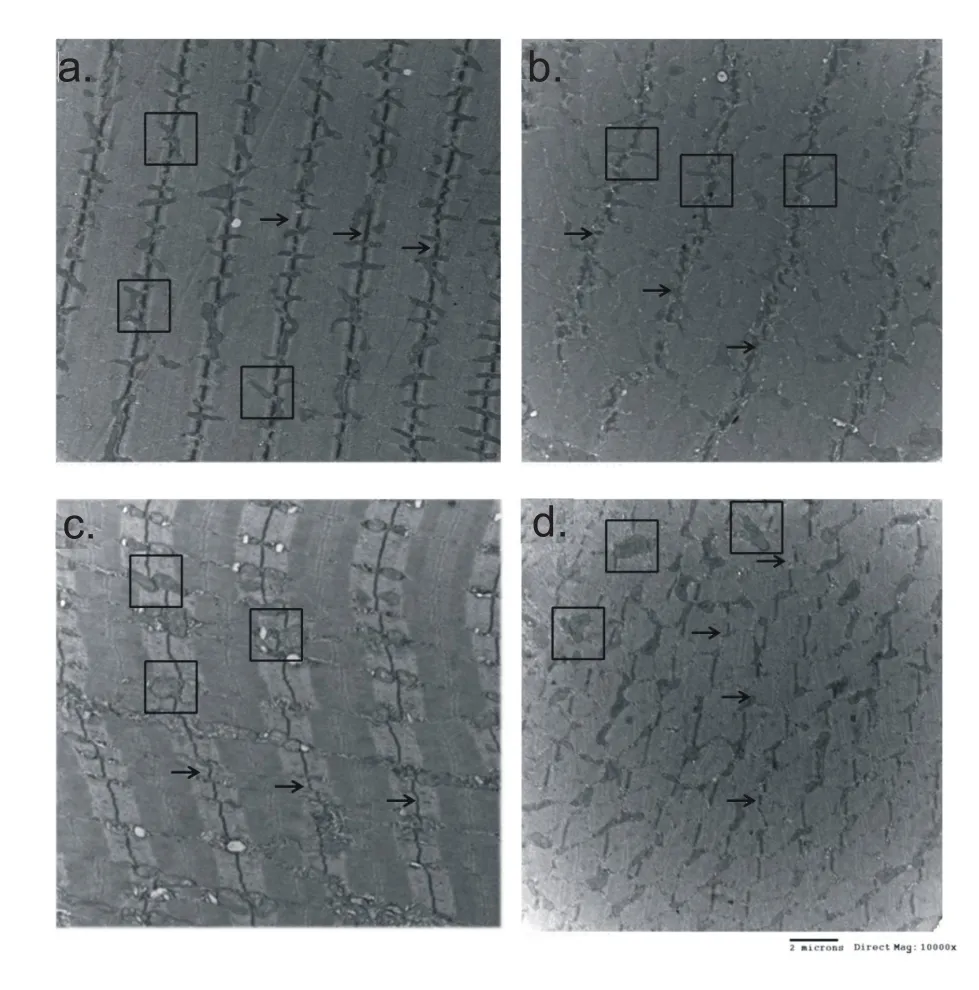
图1 运动后即刻与12小时骨骼肌微细结构变化
双因素方差分析结果显示,取材时间(0~48小时)和运动方案(向心、离心)两因素无显著交互效应(P>0.05),运动方案存在显著的主效应(P<0.05),取材时间存在非常显著的主效应(P<0.01)。说明离心运动相比向心运动能更高地激活FNDC5表达,且运动后不同时间点FNDC5的表达具有显著性变化。多重比较结果显示,在运动后6小时和24小时,FNDC5蛋白表达量相比对照组基线值有非常显著性升高(P<0.01),其他时间点无显著差异。这说明离心和向心运动后,FNDC5出现6小时和24小时两次高峰表达。

图2 训练后48小时内PGC-1α与FNDC5蛋白印迹

表3 训练后48小时内PGC-1α与FNDC5蛋白表达
2.3 离心和向心运动对血清Irisin浓度的影响
血清Irisin浓度表达如表4所示。双因素方差分析显示,取材时间(0~48小时)和运动方案(向心、离心)两因素存在非常显著的交互效应(P<0.01),提示不同的运动组,Irisin在不同的时间点变化规律不同。
以取材时间点为单因素进行简单效应分析显示,相比于对照组:向心运动后48小时内,只有6小时有非常显著的升高(P<0.01),其余时间点变化无显著性;而离心运动组在运动后12和48小时有非常显著的升高(P<0.01),其余时间点无显著性变化。
以不同训练方法为单因素进行简单效应分析显示,运动后6小时离心运动组Irisin浓度显著性低于向心运动组(P<0.05),运动后12和48小时离心运动组非常显著性高于向心运动组(P<0.01)。
2.4 离心和向心运动对血清CTRP15浓度的影响
血清CTRP15浓度表达如表4所示。双因素方差分析显示,取材时间(0-48小时)和方案(向心、离心)因素存在非常显著的交互效应(P<0.01),提示两组数据变化规律不一致。
以取材时间点为单因素进行简单效应分析显示,相比于对照组,向心运动后48小时内,只有6小时有非常显著的升高(P<0.01),其余时间点变化无显著性;而离心运动组在运动后即刻、12和48小时有非常显著的升高(P<0.01),其余时间点无显著性变化。
以不同训练方法为单因素进行简单效应分析显示,运动后0小时向心运动组CTRP15浓度显著性低于离心运动组(P<0.05),12和 48小时后向心运动组CTRP15浓度非常显著性高于离心训练组(P<0.01),而在6小时向心运动组CTRP15浓度显著性高于离心运动组(P<0.05)。

表4 训练后48小时内血清Irisin与CTRP15浓度
3 讨论
3.1 离心和向心运动对骨骼肌PGC-1α蛋白表达的影响
PGC-1α是细胞内重要的能量调节因子,普遍存在于线粒体丰富的组织如骨骼肌、肝脏、棕色脂肪内。它可作用于多种与能量代谢密切相关的转录因子及核受体,进而调节脂肪酸氧化、糖异生、组织产热、线粒体合成等能量代谢过程。运动、寒冷、饥饿等多种应激状态都可以激活PGC-1α信号,以促使机体改变能量代谢状态进而适应新的环境[12]。运动可增加骨骼肌PGC-1α表达,进而改变肌细胞的能量代谢,但不同的运动方式对其作用不同。相对于向心收缩,离心收缩可更强烈地促使肌细胞质内Ca2+的释放[13],而Ca2+浓度又是刺激PGC-1α表达的重要信号,PGC-1α的提高反过来又能够抑制过高的Ca2+浓度[14],所以离心运动是否可以更强烈地激活PGC-1α值得进一步研究。
不同肌肉收缩形式对PGC-1α的影响研究相对较少,Conwright对绝经期女性进行共10组、每组10次最大力量的离心抗阻训练后发现,PGC-1α蛋白表达并没有显著性升高[15]。宋超对小鼠分别进行上坡跑向心训练(5°,10 m/min)和下坡跑离心训练(-10°,13 m/min)后发现,离心训练在运动结束后1小时可显著提升PGC-1α表达,但升高程度没有上坡跑提升幅度高[16]。离心收缩对骨骼肌是一个较强的刺激,而PGC-1α过表达可以有效地保护离心收缩导致的骨骼肌微损伤[17],该研究中离心训练对PGC-1α提升的效果不明显可能是由于训练强度的不适宜所导致的。Conwright的研究采用的是最大力量的离心抗阻训练,训练强度很高,但抗阻训练导致肌肉实际的运动时间很短,训练量不足。Edgett对青年男性分别进行3组不同峰值强度(分别为最大摄氧量的73%、100%、133%)的高强度间歇训练,通过肌肉活检发现,虽然3种训练方法都可提高PGC-1α的mRNA量,但峰值为133%最大摄氧量的训练对PGC-1α的mRNA提升量显著性低于73%、100%组,提示并非运动强度越高,对PGC-1α信号的激活越明显[18]。
本研究采用中等强度下坡跑离心训练(-5°,20 m/min)对SD大鼠进行干预,在我们前期的研究中,此模型已经被证实能够较为有效地使肌细胞Ca2+浓度升高。大鼠PGC-1α蛋白表达在运动后0~6小时和24~48小时分别出现两次峰值,与肌细胞离心训练后钙超载的变化规律基本相似[7],且电镜照片结果也与离心运动造成的骨骼肌微细结构变化类似(实验结果2.1),表明本研究采用的离心训练方案可能是通过造成胞浆Ca2+浓度升高,进而激活PGC-1α信号。同时,离心训练和向心训练两者存在非常显著的主效应(P<0.01),且离心训练的值较高,说明即使摄氧量不同,离心运动依然比向心运动更显著地激活了PGC-1α的表达。
3.2 骨骼肌细胞内合成的FNDC5经剪切修饰后释放入血的
运动对FNDC5与Irisin的影响是目前的研究热点,Irisin是骨骼肌细胞内合成的FNDC5经剪切修饰后释放入血的细胞因子,可通过调控UCP-1促进脂肪燃烧。细胞内的FNDC5受PGC-1α调控激活合成,骨骼肌是合成FNDC5并向血液分泌Irisin的最重要的组织[19],其次脂肪也具备类似的功能。
离心运动可较为明显地通过Ca2+的释放激活PGC-1α,那么是否可以对FNDC5与Irisin产生激活作用呢?此方面的研究较少。于涛等[20]研究发现一次-16°的下坡跑离心运动后,1~3天内FNDC5 mRNA较安静时明显升高,而血清Irisin含量只在运动后24小时升高,之后便回落。但该研究并未与向心运动进行对比。本实验结果显示,在20 m/min的跑速下,平坡跑与较小坡度下坡跑的摄氧量强度没有显著差异(见1.2训练方案),造成FNDC5/Irisin的不同变化趋势,可能主要是由不同肌肉收缩形式造成的。本研究发现,无论离心或向心运动,都可以显著提升运动后FNDC5在6小时和24小时的表达,且离心训练较向心训练提升的更明显(存在显著的主效应)。这与PGC-1α的变化规律类似,说明相同摄氧量强度下离心运动较向心运动能更显著地提升Ca2+—FNDC5信号。
值得注意的是,本研究中虽然离心运动组FNDC5显著高于向心运动组,但离心组血清Irisin只在12和48小时显著高于向心组,在6小时却低于向心组。这可能是由于运动虽然可以通过PGC-1α提高FNDC5的合成量,但血清Irisin浓度不仅受骨骼肌FNDC5合成量的影响,同时受到血容量、机体代谢等诸多因素影响,从而表现出一种快速变化且与PGC-1α和FNDC5不同步的规律。大量研究表明,一次运动可以迅速提高血清Irisin浓度,而长期运动后Irisin浓度不变甚至降低[20-22],且FNDC5与Irisin的变化并不同步[23],这与本研究的中FNDC5与Irisin变化不同步的结果是相符的。以上这些结果说明,FNDC5相比于Irisin作为反映运动刺激骨骼肌分泌促脂肪氧化的细胞因子的指标,更为稳定可靠。本研究发现,虽然E组与L组在不同的时间点各有Irisin的升高,但离心运动组FNDC5表达在48小时内始终显著高于向心组(主效应显著),说明离心运动对PGC-1α—FNDC5的激活作用比向心运动更显著,促Irisin分泌的效果更明显。
3.3 离心和向心运动对CTRP15的影响
2012年Seldin等发现了参与调节脂代谢的肌肉因子CTRP15[5]。CTRP15主要在骨骼肌表达,释放入血后可上调脂肪细胞与肝对血液游离脂肪酸的摄取。目前调控CTRP15的上游信号尚不完全清楚,运动、饮食、代谢与应激都可以影响到CTRP15的合成量。目前已知的是,肌细胞内CTRP15受cAMP和Ca2+浓度的调节[21]。运动对CTRP15的作用的研究结果也不完全一致,Seldin对大鼠进行2周的跑轮训练后发现,无论是骨骼肌还是血液内的CTRP15都显著升高,但Seldin的研究发现,在9周的跑轮训练后,骨骼肌CTRP15的mRNA显著降低[5]。造成这些研究结果不尽相同的原因可能与不同运动对Irisin的作用效果差异很大的机制类似:CTRP15和Irisin都是受Ca2+浓度或激素调节的肌肉因子,其运动后变化的时程可能较短。目前对CTRP15进行运动干预都是采用数周的长期干预,长期训练后,机体对不同的训练方式的适应程度不同,同时取材时间点的差异都可能造成结果的不同。所以对CTRP15进行一次运动后不同时间点的研究就较为必要。
本研究发现,与对照组相比,无论是离心还是向心运动,都可以显著提高血清CTRP15浓度,但两组在不同的时间点升高的幅度不同,造成这种现象的主要原因,可能是离心和向心运动激活了不同的CTRP15上游调控信号。在摄氧量相同的条件下,离心运动对胞浆Ca2+浓度的作用虽然更显著,但向心运动可能通过cAMP等其他途径提高了骨骼肌CTRP15的分泌量。但同时应该注意到,向心运动组CTRP15只有在运动后6小时显著升高;离心运动组虽然在6和24小时回落到基线水平,但在0、12和48小时持续维持在高浓度,说明离心运动可以使肌肉在更长时间内维持CTRP15的高分泌水平,在更长的时间内持续调节机体脂肪转运。
科学合理地制定减肥或改善脂代谢的运动处方,就必须考虑肌肉的收缩形式造成的影响。已有学者发现特定的离心运动可以达到更理想的提高有氧能力和改善脂代谢的作用[8,24,25]。本研究对离心运动促进骨骼肌脂代谢肌肉因子的分泌的相关结果,可为相关运动处方的制定提供理论依据。
4 结论
(1)相同摄氧量下,离心运动对PGC-1α、FNDC5的激活作用比向心运动更显著。
(2)相同摄氧量下,离心和向心运动均可提高Irisin与CTRP15浓度,但离心运动可在运动后更长时间内促进两肌肉因子的高分泌。

