mTOR复合物在有氧运动改善小鼠骨骼肌糖代谢过程中的作用
张鑫愉 周晓勐 牛燕媚 傅力
1天津医科大学生理学与病理生理学系(天津 300070)
2航空总医院康复医学科(北京 100012)
3天津医科大学康复系(天津 300070)
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是哺乳动物体内与能量代谢相关的关键信号蛋白。mTOR在细胞内以复合物形式存在,分别为雷帕霉素敏感型mTOR复合物1(mTORC1)和非雷帕霉素敏感型mTOR复合物2(mTORC2)。其中mTORC1具有调节细胞增长及蛋白合成的功能,而mTORC2则调控细胞蛋白激酶B(Protein kinase B,PKB or Akt)活化及细胞骨架重新合成[1]。在细胞能量代谢过程中,一磷酸腺苷激活激酶(adenosine monophosphate-activated kinase,AMPK)可磷酸化mTORC1核心组分Raptor从而抑制其活性[2]。而 mTORC2在调节组织糖代谢稳态过程中发挥重要作用。骨骼肌特异性敲除其核心组分 Rictor可抑制 mTORC2活性并促进糖原合成,导致机体糖耐量稳态失衡,提示,mTORC2在维持机体糖耐量并抑制糖原合成过程中发挥重要作用[3]。
骨骼肌包括氧化型和酵解型两大类肌纤维,其中比目鱼肌(Soleus)以氧化型肌纤维为主,是进行葡萄糖有氧氧化的主要肌纤维,而腓肠肌(Gastrocnemius)以酵解型肌纤维为主,主要以糖酵解方式参与运动过程中的能量供应,二者共同调控机体糖摄取过程。在安静状态下,小鼠骨骼肌摄取葡萄糖量占机体总葡萄糖摄取量的75%。 因此,增加骨骼肌糖摄取对改善机体胰岛素抵抗(insulin resistance,IR)及缓解2型糖尿病具有积极作用[4]。胰岛素是调节机体血糖水平的主要激素,胰岛素通过与细胞膜受体结合引起细胞内α受体亚基构象改变,从而促进胰岛素受体底物(insulin receptor substrates,IRS)赖氨酸位点磷酸化[5]并结合至磷酸肌醇3激酶(phosphoinositide 3-kinase,PI3K)上,随后PI3K将3-磷酸肌醇依赖性蛋白激酶(3-phosphoinositide-dependent protein kinase-1,PDK1)募集至细胞膜,促进Akt-Thr308磷酸化[6]并活化mTORC2结构蛋白的应激活化蛋白激酶作用蛋白1(stress-activated protein kinase interacting protein 1,SIN1)从而激活mTORC2,并在mTORC2与Akt-Ser473之间形成正反馈,最终激活胰岛素信号通路[7]。另一方面,胰岛素可通过抑制结节硬化蛋白复合物1(tuberous sclerosis complex 1,TSC1)激活Akt从而活化mTORC1,并激活其下游因子核糖体蛋白S6激酶1(ribosomal protein S6 kinase 1,S6K1)诱导核糖体合成[8]。
Akt作为IRS的下游信号分子,在胰岛素信号通路中发挥重要作用。生理状态下,IRS与p58结合募集PI3K[9],从而将Akt从胞浆转移至胞膜上[10],促使Akt-Thr308及Ser473磷酸化并结合至PDK1及mTORC2[11],从而调节胰岛素信号通路活性。在这一过程中,Akt可磷酸化Akt 160KD亚基(Akt substrate of 160 KD,AS160)促进葡萄糖转运子 4(glucose transporter 4,GLUT4)转位至胞膜从而增加细胞糖摄取;同时,胰岛素活化Akt引起转录活化因子叉头框蛋白O(fork head box protein O,FOXO)磷酸化,以此促使FOXO与14-3-3蛋白结合,进而促使FOXO从细胞核转移至细胞质从而抑制糖异生相关酶的表达、催化糖原合成及脂质生成[12]。
除此之外,Akt还可通过TSC和富含脯氨酸的40kDa Akt亚基(the proline-rich Akt substrate of 40 kDa,PRAS40)激活mTORC1进而影响机体代谢:一方面Akt直接磷酸化TSC2[13]促使TSC2与TSC1形成复合体从而活化mTORC1;另一方面,PRAS40可与mTORC1相互作用,对mTORC1信号传导进行负向调节[14]。在这一过程中,Akt作为细胞能量代谢的重要调节因子,通过磷酸化PRAS40并促进其与 14-3-3蛋白结合[15],引起PARAS40与mTORC1解离,从而活化mTORC1[16]。
目前,由于采用的运动干预方案的不同,有关运动影响骨骼肌细胞mTOR信号通路及其与糖代谢之间的调控关系尚不完全清楚,为进一步探究长期有氧运动对小鼠骨骼肌糖代谢的影响,本实验采用C57BL/6小鼠,通过6周高脂饮食喂饲诱导胰岛素抵抗模型,后进行8周、强度为75%VO2max的跑台运动干预,观察IRS/Akt/mTOR信号通路活性,分析有氧运动对长期高脂饮食小鼠骨骼肌糖代谢的影响,以期为揭示运动改善代谢性疾病的机制提供依据。
1 材料和方法
1.1 实验动物和分组
实验动物购于北京华阜康生物科技股份有限公司,室温控制在22℃~25℃,湿度控制在30%~40%,光照/黑暗时间为12/12,小鼠自由进食、水。实验动物喂养在天津医科大学实验动物中心,符合中国科学院指导下的天津医科大学实验动物关怀及使用管理条例。
50只4周龄C57BL/6小鼠适应性喂养1周后,随机分为正常饮食组(C组,n=10)和高脂饮食组(n=40),并分别喂饲正常饮食和高脂饮食(脂肪含量为45%)。6周后根据口服糖耐量(OGTT)和空腹胰岛素检测结果将高脂饮食组25只成模小鼠随机分为高脂饮食安静组(H组,n=10)及高脂饮食运动组(HE组,n=15)[19]。H组继续喂饲高脂饮食,而HE组小鼠在高脂饲养的同时给予8周有氧跑台运动干预。
1.2 运动方案
HE组小鼠运动干预前先进行为期1周的适应性跑台训练,首次训练时长为20 min、强度为10 m/min,随后渐增至12 m/min。运动干预时长为8周、速度为12 m/min,相当于小鼠75%VO2max[17],1小时/天、5天/周。
1.3 动物组织取样
6周高脂饲料喂养及 8周运动干预结束后进行取材。取材前,各组小鼠禁食 14 h,小鼠经利多卡因眼球局部麻醉后内眦静脉取血。血液4℃静置30 min后3000 g离心15 min,取上层血清保存于-80℃冰箱备用。取血后立即分离小鼠比目鱼肌及腓肠肌,经液氮速冻后移至-80℃冰箱备用。
1.4 Western Blot 检测小鼠比目鱼肌胰岛素信号通路相关蛋白表达
用乙基苯基聚乙二醇裂解液提取比目鱼肌与腓肠肌总蛋白,用垂直电泳仪(Bio-Rad)加入等量比目鱼肌蛋白质样品并经10%SDS-PAGE胶分离后湿转至PVDF膜(Millipore)上,随后使用10%脱脂奶粉封闭1小时,抗体稀释液(5%BSA/TBST,Sigma)按1∶2000比例稀释一抗pAkt-S473、pAkt-T308、pAMPK-T172、pIRS1-S307、pS6K1-T389、Raptor、Rictor、mTOR(Cell Signaling Technology),β-actin(北京锐抗生物科技有限公司),4℃摇床孵育过夜。次日,使用1×TBST洗涤3次,每次10min,随后使用同一抗体稀释液按1∶20000比例稀释二抗,室温摇床孵育1小时后,重复上述洗涤过程。随后以发光底物ECL反应液显影,暗室曝光,胶片扫描后采用Quantity One软件定量分析并统计各条带相对灰度值。
1.5 免疫共沉淀法检测骨骼肌组织Raptor-mTOR,Rictor-mTOR 表达
研究表明,Raptor-mTOR结合反映mTORC1表达量,Rictor-mTOR结合反映mTORC2表达量[18]。用乙基苯基聚乙二醇裂解液提取比目鱼肌及腓肠肌总蛋白,利用Invitrogen公司Dynabeads R蛋白G免疫沉淀反应试剂盒分别检测小鼠比目鱼肌及腓肠肌Raptor-mTOR及Rictor-mTOR结合。采用清洗缓冲液(Ab Binding&Washing Buffer)以1∶200比例稀释mTOR抗体,随后转移至装有磁珠的1.5 ml EP管中,室温孵育15 min(间歇摇动)。用Washing Buffer重悬磁珠并去除废液,随后加入蛋白稀释液稀释(1×PBS,0.1%Tween-20)的蛋白样品(80~100 μg),室温孵育15 min(间歇摇动),Washing Buffer重悬后弃废液,20 μl Elution Buffer洗脱抗体-蛋白结合物,-20℃贮存以备Western Blot检测。
1.6 统计学分析
本实验数据均由 SPSS软件处理。采取单因素方差分析(One-way ANOVA),计算各组标准差和均值,各组之间的显著性定为P<0.05。
2 结果与分析
2.1 8周有氧运动对高脂饮食小鼠代谢表型的影响
在本实验室前期建造模型实验中发现,高脂喂养14周后小鼠体重、血糖及空腹胰岛素水平均显著增加,提示14周高脂饮食可诱发小鼠产生胰岛素抵抗,而在高脂饮食的同时进行8周有氧运动干预可有效降低胰岛素抵抗小鼠的空腹血糖及胰岛素水平[19]。
2.2 8周有氧运动对小鼠比目鱼肌Akt/mTOR信号通路的影响
检测小鼠比目鱼肌胰岛素信号通路相关蛋白磷酸化水平,结果显示,与 C组相比,H组小鼠比目鱼肌pAkt-T308(P<0.05),pIRS1-S307表达显著降低(P<0.001),而pS6K1-T389显著增高(P<0.05);与H组小鼠对比,HE 组 pAkt-S473(P<0.05),pAkt-T308(P<0.05),pAMPKα -T172(P<0.05),pIRS1-S307(P<0.001)表达显著增加,而pS6K1-T389表达显著降低(P<0.05)(图1)。
2.3 长期高脂饮食和8周有氧运动对小鼠骨骼肌mTORC1/C2蛋白表达的影响
14周高脂喂养后,与C组相比,H组小鼠比目鱼肌Rictor-mTOR结合量显著降低,而Raptor-mTOR结合量明显增加(P<0.05)(图2)。与H组相比,HE组Rictor-mTOR结合量显著增加,Raptor-mTOR结合量显著降低(P<0.05),提示长期高脂饮食可显著增加比目鱼肌mTORC1表达、降低mTORC2表达;而8周有氧运动可显著降低mTORC1表达、增加mTORC2表达(P<0.05)(图2)。
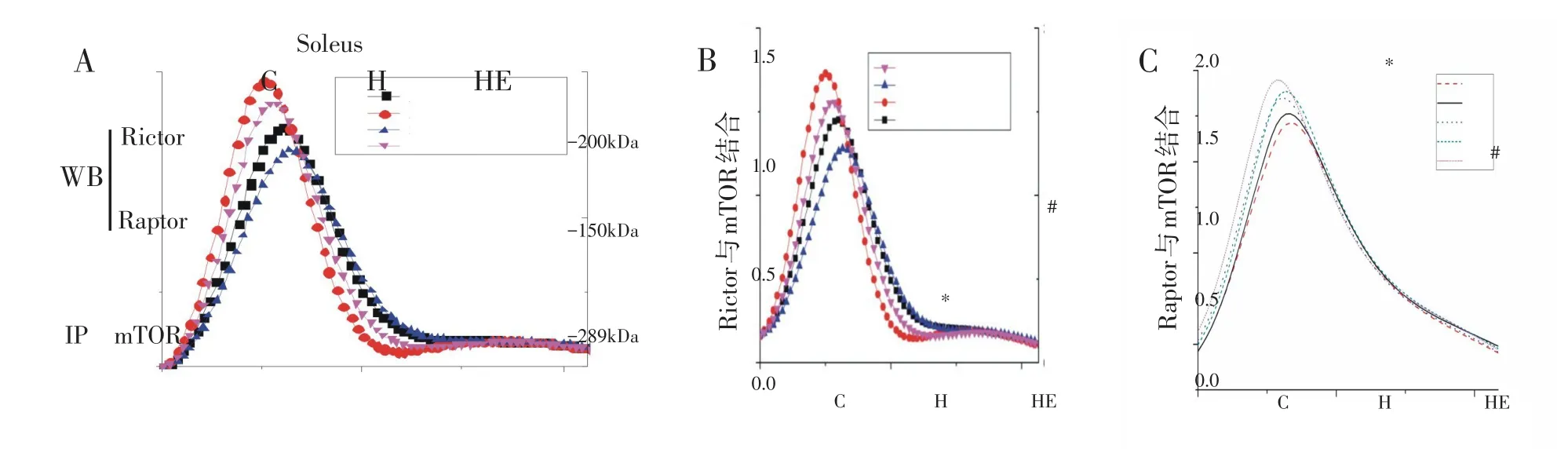
图2 免疫共沉淀实验研究各组小鼠比目鱼肌Rictor-mTOR(B)、Raptor-mTOR(C)在高脂/高脂+运动干预下的结合水平
与C组相比,H组小鼠腓肠肌Raptor-mTOR结合显著增加(P<0.05),而Rictor-mTOR结合虽有增加趋势,但无统计学意义(P>0.05);与H组对比,HE组小鼠腓肠肌Raptor-mTOR显著降低(P<0.05),Rictor-mTOR虽有降低趋势,但无显著性意义(P>0.05),提示长期高脂饮食可增加腓肠肌mTORC1含量,但对mTORC2含量无显著影响;8周有氧运动可显著降低小鼠腓肠肌mTORC1含量、对mTORC2含量无显著影响(P>0.05)(图3)。
3 讨论
3.1 mTORC1/C2与高脂饮食诱导小鼠胰岛素抵抗之间的关系
mTOR在感受机体能量状态的过程中发挥重要作用。生理状态下,餐后氨基酸及血糖升高可刺激胰岛β细胞分泌胰岛素,进而磷酸化IRS并使其结合至PI3K,从而活化下游效应器Akt和蛋白激酶C(protein kinase C,PKC)等[20]。其中,Akt一方面抑制糖原合酶激酶3(glycogen synthase kinase 3,GSK-3)活性从而抑制糖原合成,另一方面可促进骨骼肌细胞GLUT4转位至胞膜从而增加糖摄取[21]。细胞葡萄糖及支链氨基酸长期过量可活化mTORC1,并促进S6K1磷酸化IRS、抑制IRS与胰岛素受体结合,此负反馈调节机制可降低细胞胰岛素敏感性,导致胰岛素抵抗[22,23]。在体实验发现,S6K1敲除小鼠可抵抗高脂饮食诱导胰岛素敏感性降低及肥胖[24],而脂肪细胞特异性敲除Raptor小鼠表现出胰岛素敏感性增加并对抗高脂饮食诱导肥胖的发生[25]。已有大量研究表明,在胰岛素抵抗情况下,细胞IRS1含量显著降低。当过表达Rheb或敲除TSC1/2时,mTORC1/S6K1可持续活化并促进IRS1及IRS2蛋白降解,从而导致胰岛素受体及 PI3K含量降低,最终引发胰岛素抵抗[26]。
除mTORC1外,mTORC2对IRS1或Akt也发生作用,但二者在胰岛素抵抗发生发展过程中的作用并不完全一致。敲低或抑制mTORC2表达可通过泛素连接酶Fbw8促进IRS1蛋白降解,引起细胞浆内非活化的IRS1累积,提示mTORC2在调节胰岛素敏感性过程中发挥着重要作用[27]。此外,mTORC2还通过调节Akt活性参与胰岛素信号转导,具体表现为Rictor敲除小鼠脂肪及肌肉组织mTORC2及Akt活性均受到抑制,胰岛素诱导的葡萄糖摄取量也随之减少[28]。同时,抑制mTORC2还可增加肝脏糖原合成并抑制糖酵解及脂质合成。因此,mTORC2含量及活性降低可导致血糖升高及糖耐量受损[29]。
3.2 骨骼肌组织mTORC1/mTORC2 与有氧运动改善胰岛素抵抗的关系
mTOR可参与调节包括细胞生长分化、蛋白合成及细胞骨架蛋白构建等多种过程。作为胰岛素信号通路的重要组分,mTOR活性受骨骼肌重复收缩活动的调控并在骨骼肌运动适应过程中发挥重要作用。由于各家研究所采用的运动形式或时长的不同,目前关于运动调节mTOR信号的机制尚不明确。
研究发现,单次抗阻运动可增加人体肌肉含量并促进mTORC1及S6K1活化,提示单次抗阻运动后mTORC1的活化与肌纤维蛋白质合成代谢有关[30],而运动个体肌肉的增速与mTORC1活性密切相关[31]。研究发现,野生型小鼠训练14天后肌肉含量增加43%,而给予雷帕霉素的野生型小鼠肌肉含量则无显著变化。对于含有雷帕霉素抗性的骨骼肌特异性mTOR突变小鼠,无论是否给予雷帕霉素,其肌肉含量均明显增加[32],提示mTORC1在调控骨骼肌合成代谢过程中发挥重要作用。人体试验表明,对给予雷帕霉素的受试者进行抗阻训练后,其混合型肌肉增加并不显著[33]。同样,雷帕霉素也可抑制运动小鼠产生骨骼肌肥大[34]。综上所述,mTORC1的活化促进骨骼肌蛋白质合成代谢。
Kleinert等发现,mTORC2在运动中参与调节骨骼肌糖摄取[35]。研究表明,敲除Rictor对小鼠运动能力并无显著影响,但会引起运动后小鼠血糖及血乳酸含量升高、糖原合成降低。在安静状态下,敲除Rictor对骨骼肌糖摄取无显著影响,但敲除Rictor小鼠运动后骨骼肌糖摄取能力较野生型小鼠下降40%[35]。此外,Hodson等通过人体试验发现,当进食及抗阻运动后,骨骼肌mTORC1被激活,同时S6K1活性也增加,而mTORC2无显著变化[36]。本研究中,我们发现mTORC1及mTORC2在调节骨骼肌糖代谢过程中表现出相互拮抗作用,具体表现为高脂饮食可增加骨骼肌mTORC1表达、降低mTORC2表达,8周有氧运动可显著逆转长期高脂饮食引发的上述改变,并且mTORC2的变化只出现在氧化型肌纤维内(比目鱼肌),在酵解型肌纤维(腓肠肌)mTORC2的变化并不显著。
4 结论
长期高脂饮食可引发机体代谢稳态失衡,有氧运动可显著改善高脂饮食引起的机体代谢紊乱现象。本研究证明,长期高脂饮食可增加骨骼肌纤维mTOR与Raptor结合,降低比目鱼肌(氧化型肌纤维)mTOR与Rictor结合及胰岛素信号通路相关蛋白活性。8周有氧运动通过增加小鼠比目鱼肌纤维胰岛素信号蛋白(pAkt-T308,S473)表达、降低mTOR与Raptor结合,从而逆转高脂饮食导致的机体代谢失衡。

