肝片吸虫SAP-2蛋白的基因克隆、表达及其诊断潜力初步评估
王熙凤,乔 军,孟庆玲*,陈 英,钟文强,贡莎莎,黄运福,才学鹏
(1. 石河子大学动物科技学院, 新疆 石河子 832003; 2. 中国农业科学院兰州兽医研究所, 甘肃 兰州 730046)
【研究意义】肝片吸虫病是由肝片吸虫(Fasciolahepatica,Fh)引起的温带地区常见的一种人兽共患寄生虫病。成虫可寄生在草食动物肝胆管内[1],可造成家畜消化障碍、生长发育不良等症状,尤其对羔羊的危害最大[2-3]。同时,Fh也可感染人,引起人的肝片吸虫病,因此研发早期快速诊断方法对于该病的防治意义重大。【前人研究进展】草食动物感染Fh后,成虫在宿主体内可长期存在,虫体的移行和排泄分泌产物可对宿主造成严重的危害,可致患病动物生产力低下,饲料利用率降低,每年给全球畜牧业造成的经济损失高达30亿美元[4]。近年来,随着气候的改变,该病逐渐扩散蔓延,目前在全球60多个国家均有发生。在我国,该病在新疆、内蒙、青海等畜牧业发达的省区发病率逐年增高,在一些牧区,牛羊的感染率高达45 % ~100 %[5-6]。鞘脂激活蛋白样蛋白(SAP)是一个大的蛋白家族,该蛋白含有5个半胱氨酸残基和2个α-螺旋。该蛋白家族主要在Fh感染早期表达,在Fh成虫分泌产物(ESP)中大量存在。SAP-2蛋白含有1个保守的三级结构和3个二硫键,而二硫键的形成和正确折叠能提高蛋白的抗原性,并具有较强的细胞溶解酶活性,能杀死宿主红细胞和白细胞,破坏宿主的免疫系统[7-8],因此Fh SAP-2在虫体的寄生和致病过程中发挥着重要的作用。【本研究切入点】目前,对动物肝片吸虫病诊断主要依赖于粪便中虫卵检查,但该方法敏感性较低,不适合早期感染的诊断。因此,研发Fh的早期感染诊断方法对于该病的防控具有重要的意义。已有研究发现,SAP蛋白在Fh感染早期可大量表达,造成宿主血细胞溶解,裂解肝细胞,是Fh重要的致病蛋白之一。【拟解决的关键问题】克隆SAP-2基因后在原核表达系统中进行表达,Western blot分析重组蛋白的反应原性,以重组蛋白SAP-2为包被抗原建立检测Fh抗体的间接ELISA,初步评估了SAP-2蛋白作为Fh血清学诊断抗原的潜力,为Fh血清学诊断试剂的研发奠定了前期基础。
1 材料与方法
1.1 质粒、菌株及试剂
表达载体pET-32a(+)、E.coliDH5α和E.coliBL21(DE3)由石河子大学动物科技学院寄生虫实验室保存;限制性核酸内切酶EcoR I和XhoI、DNA Marker、pMD19-T(simple)、T4DNA Ligase、IPTG、蛋白Marke、反转录试剂盒均购自TaKaRa公司;琼脂糖凝胶DNA回收试剂盒、质粒小量提取试剂盒、TMB和DAB显色剂均购自天根生化科技(北京)有限公司;辣根过氧化物酶标记的兔抗羊IgG、NC膜购自康为世纪生物公司。
1.2 引物设计
根据GenBank已发表的SAP-2基因序列(登录号:AF286903),利用Premier 5.0软件设计一对特异性引物F1和F2,F1:5′-CGGAATTCATGAACCCACTGTTCGTG-3′(下划线部分为EcoR I酶切位点),F2:5′-CCCTCGAGCTAGCACAGCTTGATTAAA CG-3′(下划线部分为XhoI酶切位点),引物由新疆昆泰锐生物技术有限公司合成。
1.3 Fh总RNA的提取及反转录
取保存在-80 ℃的Fh成虫,剪虫体的1/3(约20 mg),加入200 μl Trizol研磨成浆,按照Trizol法提取Fh总RNA,用TaKaRa公司的反转录试剂盒将所提的RNA反转录为cDNA,-20 ℃保存。
1.4 SAP-2基因的扩增及双酶切鉴定
以反转录的cDNA为模板,设计的特异性引物进行扩增SAP-2基因。RT-PCR扩增条件为:94 ℃预变性4 min;94 ℃变性40 s,59 ℃退火40 s,72 ℃延伸45 s,32个循环;72 ℃延伸10 min,4 ℃保存。扩增产物用1 %琼脂糖凝胶电泳检测。切胶后用琼脂糖凝胶DNA回收试剂盒进行目的片段回收,与pMD19-T(simple)载体4 ℃过夜连接,连接产物转化入E.coliDH5α感受态细胞内,筛选出阳性转化子,经EcoR I和XhoI双酶切鉴定,送至新疆昆泰锐生物技术有限公司进行测序,将测序正确的质粒命名为pMD-SAP-2。
1.5 SAP-2基因及其编码蛋白质的分子特征分析
将测得的序列与NCBI上公布的SAP-2基因序列进行序列比对,并应用DNAMAN、ProtParam、TMHMM、Protscale、SignalP、MotifScan、NetCTL 1.2 Server、DNAStar和BepiPred-2.0软件分析预测SAP-2蛋白质的理论分子质量、等电点、疏水性、信号肽、跨膜区域、潜在的糖基化位点、细胞抗原表位等;通过Predictprotein和Swiss-model预测二级、三级结构;应用MEGA软件分析NCBI搜索得到的同源氨基酸序列,并构建系统进化树。
1.6 重组表达载体pET-SAP-2的构建
用EcoR I和XhoI分别双酶切pMD-SAP-2质粒和pET-32a(+)原核表达载体,回收目的片段,与T4DNA连接酶4 ℃过夜连接,连接产物转化入E.coliDH5α感受态细胞内,经菌液PCR和双酶切筛选出阳性克隆,进行测序。将鉴定正确的重组质粒命名为pET-SAP-2。
1.7 目的蛋白的诱导表达、鉴定及纯化
将重组质粒pET-SAP-2转化至E.coliBL21(DE3)中,37 ℃过夜培养,将300 μl菌液接种于200 mL含有氨苄抗性的LB培养基中,37 ℃过夜培养至OD600nm为0.6~0.8时,加入1.0 mmol/L IPTG(终浓度)诱导8 h,收集菌液,12 000 r/min离心1min收集菌体和上清,进行SDS-PAGE分析。将诱导后收集的菌液经超声破碎后,用镍离子亲和层析柱纯化,调整终浓度为1 mg/mL。将纯化的SAP-2蛋白转移到NC膜上,以绵羊Fh标准阳性血清(1∶
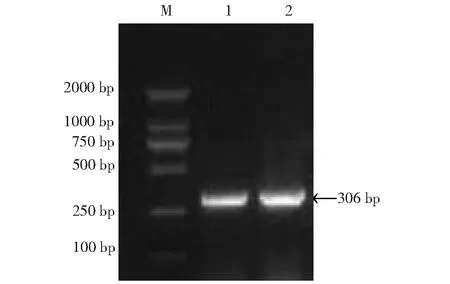
M: 标准DNA(DL2000); 1~2: SAP-2基因RT-PCR产物M: DNA marker(DL2000); 1-2: RT-PCR product of SAP-2 gene图1 SAP-2基因RT-PCR 扩增产物Fig.1 SAP-2 gene RT-PCR amplifications
1000稀释)为一抗,以HRP标记的兔抗羊IgG抗体(1∶3000稀释)为二抗,进行Westen blot分析。
1.8 基于SAP-2重组蛋白间接ELISA的建立及其对血清样品的检测评估
以纯化后的SAP-2蛋白为抗原包被ELISA反应板,蛋白稀释浓度为2、4、6、8、10 μg/mL。ELISA反应板每孔加100 μl抗原包被液,4 ℃过夜包被,弃去板内包被液,PBST洗涤5次;每孔加入300 μl封闭液(含5 %脱脂奶粉的PBST)37 ℃封闭2 h,拍干反应板,PBST洗涤3次;Fh阳性血清分别作1∶100、1∶200、1∶400和1∶800 4个梯度稀释,100 μl每孔,37 ℃孵育1 h,拍干,PBST洗涤4次;二抗用HRP标记的兔抗羊IgG以1∶5000稀释,100 μl每孔,37 ℃孵育1 h,拍干,PBST洗涤3次;用TMB显色剂避光显色15 min,H2SO4终止显色,用酶标仪于OD450nm测定数值。P/N最大值确定为抗原和血清最佳浓度。计算出平均值(X)、标准方差(SD),以临界值=X+3×SD判定阴阳性。用建立的间接ELISA对实验室保存的23份Fh阳性血清和10份阴性血清进行检测,分析SAP-2蛋白在Fh诊断中的特异性和敏感性。
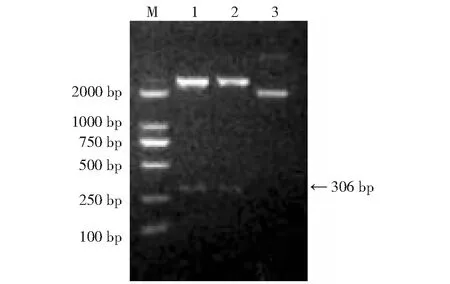
M:标准DNA(DL2000);1~2:重组质粒的双酶切3:双酶切对照M: DNA marker(DL2000); 1-2: Double enzyme digestion of recombinant plasmid; 3: Double enzyme contrast图2 pMD-SAP-2质粒双酶切鉴定Fig.2 pMD-SAP-2 plasmid was identified by double enzyme digestion
2 结果与分析
2.1 目的基因的克隆及双酶切鉴定
扩增产物经1 %琼脂糖检测得到大小约306 bp的目的片段,与FhSAP-2基因片段预测结果一致(图1)。回收目的片段与pMD19-T(simple)连接,转化入E.coliDH5α感受态细胞内,挑取单菌落,经菌液PCR和双酶切鉴定,得到了2692 bp的载体片段和306 bp的目的片段,表明克隆载体pMD-SAP-2构建成功(图2)。
2.2 Fh SAP-2蛋白基因测序结果及其遗传进化分析
图3所示,SAP-2基因的阅读框全长为306 bp,编码101个氨基酸,该序列已上传至NCBI(GenBank登录号:MG457758)。序列分析发现,该序列与GenBank上公布的SAP-2核苷酸的同源性为99.35 %,氨基酸的同源性为97.3 %。SignalP分析发现,该蛋白信号肽在第1~15个氨基酸之间。MotifScan预测该蛋白有1个N-糖基化位点(90~93),1个酪蛋白激酶Ⅱ磷酸化位点(49~52);有5个半胱氨酸残基、3个B细胞抗原表位和2个T细胞结合位点。Predictprotein预测二级结构中α-螺旋(α-helix)和无规卷曲(random coil)分别占70.3 %、29.7 %。Swiss-model预测三级结构呈“U”形,α-螺旋由3个无规卷曲连接。系统进化树分析结果发现,Fh SAP-2与曼氏裂体吸虫的SAP-2氨基酸序列同源性最高为98.02 %,其次是大片吸虫为88.12 %,与其他物种表现出较大的种属差异性(图4)。

SAP-2基因引物序列(下划线);1个N-糖基化位点(斜体);1个酪蛋白激酶Ⅱ磷酸化位点(波浪线);B细胞抗原表位(阴影);T细胞结合位点(黑体加粗);5个半胱氨酸残基(方框)Primer sequence (underline);one N-glycosylation site (italic);one casein kinaseⅡphosphorylation site (wave); B cell epitopes (shade); T cell binding site (Bold print); Five cysteine residues (block)图3 SAP-2基因cDNA序列及推导的氨基酸序列Fig.3 cDNA sequence of SAP-2 gene and deduced amino acid sequence
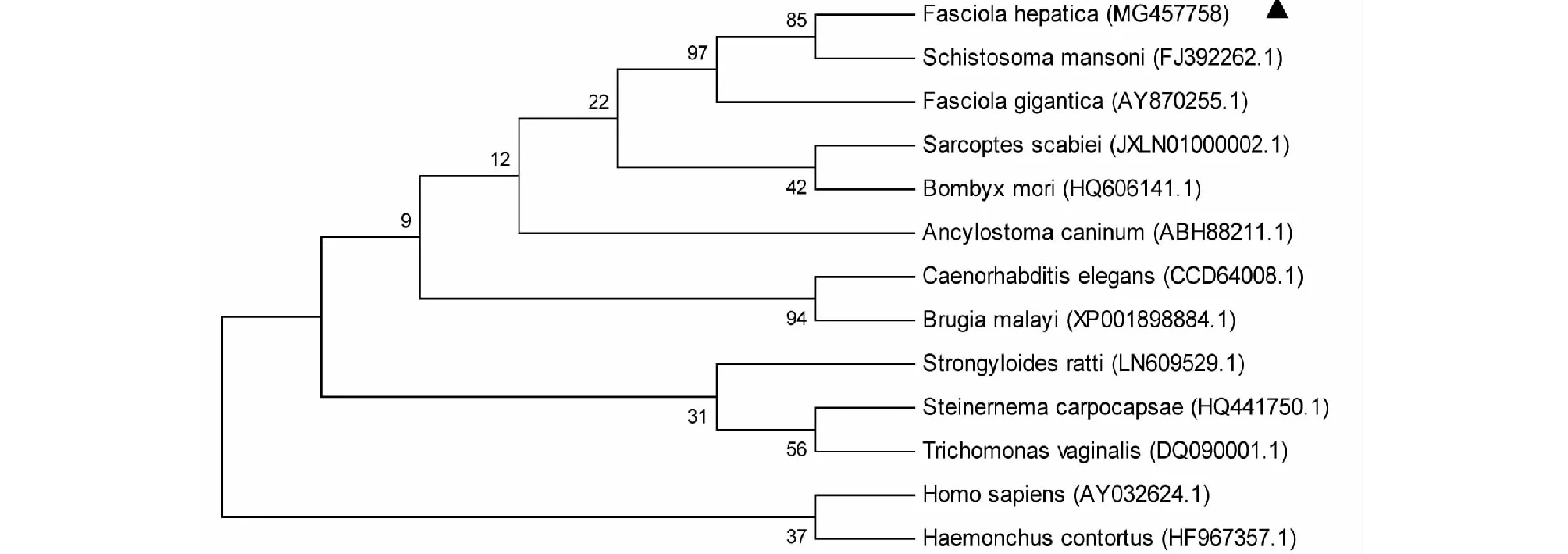
图4 SAP-2基因核苷酸序列的系统进化树分析Fig.4 Phylogenetic tree analysis based on nucleotide sequence of SAP-2 gene

M:标准DNA(DL5000);1~2:重组质粒的双酶切;3:双酶切对照M:DNA marker(DL5000); 1-2:Double enzyme digestion of recombinant plasmid; 3:Doube enzyme contrast图5 重组质粒的双酶切鉴定Fig.5 Identification of recombinant plasmid by double enzyme digestion
2.3 原核表达载体pET-SAP-2的双酶切验证
用EcoR I和XhoI对重组子进行双酶切,经琼脂糖验证切出大小约5900 bp的表达载体片段和约306 bp的目的条带(图5),与预期结果一致,表明原核表达载体pET-SAP-2构建成功。
2.4 SAP-2重组蛋白的SDS-PAGE及Western blot 分析
SDS-PAGE分析发现,在27 kDa处有一条与预期大小一致的目的蛋白,而在上清液该位置无条带,表明该蛋白以包涵体的形式表达。重组蛋白经Ni2+-NTA柱纯化后,SDS-PAGE检测可见到单一的目的蛋白条带(图6)。纯化后的重组蛋白经SDS-PAGE后,进行Western blot分析,结果显示在目的条带大小处可见到单一条带,证明纯化后的重组蛋白SAP-2能与Fh阳性血清发生特异性反应,具有良好的反应原性(图7)。
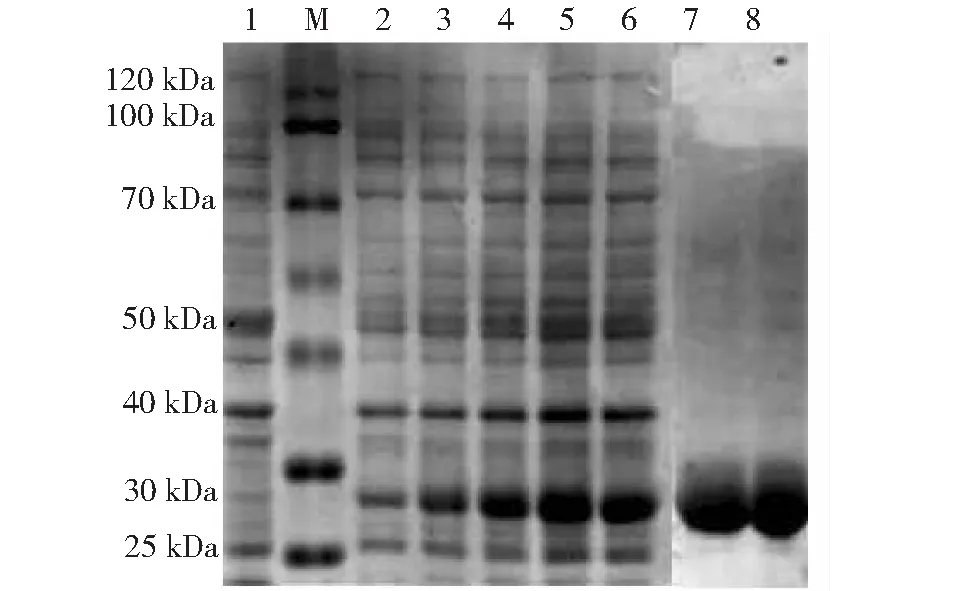
M:蛋白marker;1:IPTG诱导的空载体;2~6:表达产物诱导0、2、4、6、8 h; 7~8:SAP-2重组蛋白纯化后M: Protein marker; 1: Empty-carrier induced by IPTG;2-6: The expression products were induced by 0, 2, 4, 6 and 8 hours; 7-8: SAP-2 recombinant protein after purification图6 不同时间诱导融合蛋白表达的SDS-PAGE分析Fig.6 SDS-PAGE analysis of fusion protein expression induced by different time.

M:蛋白marker;1:纯化后重组蛋白SAP-2M: Protein marker; 1: Purified recombinant protein SAP-2图7 纯化的重组蛋白SAP-2进行Western blot 检测Fig.7 Western blot analysis of purified recombinant protein SAP-2
2.5 基于Fh SAP-2重组蛋白的间接ELISA的建立及其对血清样品的检测评估
经ELISA试验结果分析,阳性血清OD450nm为1.308,阴性血清为0.147时,P/N值最大,确定该蛋白的最佳包被浓度为6 μg/mL,一抗最佳稀释浓度为1∶200。经计算阴性平均值X为0.158,标准方差SD为0.062,计算出临界值为0.344,大于临界值的均为阳性,小于临界值的为阴性。23份Fh阳性血清和10份阴性血清经为1∶200稀释后,阳性血清OD450nm均大于临界值,均为阳性;阴性血清OD450nm均小于临界值,均为阴性;该方法的检测结果与预期结果完全吻合,证明该重组蛋白具有良好的特异性和敏感性。
3 讨 论
肝片吸虫病虽然已被世界卫生组织(WHO)列为被忽视的人畜共患病,但其严重危害人类和家畜的健康,给全球畜牧业带来巨大经济损失。目前,肝片吸虫病的诊断主要包括粪便中虫卵检查和特异性抗体检测。粪便中虫卵检查是Fh感染检测的常用方法,但是虫体一般都在感染后3~4个月才能成熟排卵,因此,粪便中虫卵检测不适合感染早期的诊断[9-13]。近年来,随着免疫学和分子生物学技术相结合的应用,可提高该病诊断的准确性。Calvani等人结合传统粪便沉淀方法,用实时荧光定量PCR技术,通过分离每克粪便中Fh虫卵的DNA来进行早期检测,该方法可用于特异性区分肝片吸虫、大片吸虫及其中间型,敏感度得到进一步提高[14]。
Fh成虫在宿主体内移行时可产生排泄分泌产物(ESP),使虫体逃避宿主的免疫反应。研究发现,ESP是由多种不同抗原蛋白组成,能诱导宿主获得保护性免疫,是主要的保护性抗原,同时与细胞免疫抑制有关[15-16]。SAP是吸虫ESP中的重要组成部分,SAP家族包含4种蛋白,在Fh中主要有SAP-1和SAP-2。SAP-1主要在成虫阶段表达,参与脂质代谢,而SAP-2在未发育的虫卵、童虫和成虫早期阶段均可大量表达[17]。SAP-2可引起宿主红细胞和白细胞的细胞膜溶解,还可裂解肝细胞[18],是Fh重要的致病蛋白之一。
目前,对于Fh SAP-2蛋白的研究证实,该蛋白具有较强的免疫原性和反应原性,可用于Fh诊断抗原和新型疫苗的研究[19]。Shin等通过免疫印迹(WB)和免疫荧光磁珠技术对Fh重组抗原GST-SAP2总IgG和IgG4进行检测,结果发现重组GST-SAP2的敏感性和特异性分别是94 %和98 %,证实Fh重组抗原GST-SAP2具有良好的反应原性,具有作为Fh早期诊断试剂的潜力[20]。因此,本研究对SAP-2基因克隆后进行原核表达,利用Western blot分析其反应原性。以纯化的重组蛋白SAP-2为抗原,建立检测Fh特异性抗体的间接ELISA,评估SAP-2蛋白作为Fh 诊断抗原的潜力。
4 结 论
试验克隆了SAP-2基因,并在原核表达系统中高效表达了重组蛋白SAP-2,Western blot鉴定表明表达的重组蛋白SAP-2可被Fh阳性血清特异性识别,有较强的反应原性。以纯化的重组蛋白SAP-2为抗原,建立了检测Fh特异性抗体的间接ELISA,结果证实重组蛋白SAP-2有良好的特异性和敏感性。本研究证实SAP-2蛋白具有作为肝片吸虫病诊断候选抗原的价值,为Fh血清学诊断试剂研发奠定了前期基础。
——一道江苏高考题的奥秘解读和拓展

