高糖土壤宏基因组文库β-葡萄糖苷酶基因克隆表达及酶学性质分析
陆 坚,路卫卫,李伟亮,郭晓敏,杜丽琴,韦宇拓,黄日波
(广西大学生命科学与技术学院/亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530005)
【研究意义】β-葡萄糖苷酶(EC 3.2.1.21;1.4-β-D-glucosidase)又称为纤维二糖酶,是一类能水解烷基糖苷、芳基糖苷和纤维低聚糖等糖链中β-D-葡萄糖苷键释放非还原性糖基的一种水解酶,是多功能酶类[1]。β-葡萄糖苷酶作为纤维素降解的限速酶,在降解纤维素生产燃料酒精中起着非常重要的作用[2]。然而,大部分β-葡萄糖苷酶活活力低,反应条件(如温度和pH值)适应范围相对较窄,稳定性差,酶活性易受产物葡萄糖的抑制等等,制约着β-葡萄糖苷酶的广泛应用,成为纤维素燃料酒精行业发展的瓶颈[3-4]。此外,由于纯培养技术局限,仍然有99 %的微生物未能实现人工纯培养[5],严重阻碍了微生物资源的利用和开发。宏基因组技术不依赖于微生物培养,以特定环境中微生物总DNA为研究对象,是一条寻找新基因及新酶的新途径。利用宏基因组技术,通过构建高糖土壤微生物宏基因组文库,有望获得新颖的纤维素酶及其基因资源,对纤维素燃料酒精行业的发展及能源短缺、环境污染问题的解决均具有重要意义。【前人研究进展】目前,国内外对β-葡萄糖苷酶的研究主要着眼于微生物来源的β-葡萄糖苷酶。其中一个研究趋势是通过传统微生物分离纯化的方法获得高活力或具有优良特性的β-葡萄糖苷酶,另一个研究趋势是通过建立宏基因组文库获得新的β-葡萄糖苷酶基因。此外,国内外许多研究还着眼于利用蛋白质分子改造技术提高β-葡萄糖苷酶的活力和热稳定性;提高β-葡萄糖苷酶的葡萄糖耐受性,减弱反馈抑制的影响[6-12]。【本研究切入点】自然界中蕴藏着巨大的微生物资源,然而,研究发现在现有实验条件和技术下只有1 %的土壤微生物能分离培养,大量新的微生物和基因资源仍未被发现[13-14]。采用宏基因组技术,获取土壤微生物总DNA,运用基因克隆、功能筛选、基因表达等手段,避开了绝大多数微生物难以分离培养的技术瓶颈,获取大量未培养微生物的基因资源,为挖掘新基因及新型生物活性物质开辟了新途径[15-18]。目前,有关高糖土壤宏基因组文库β-葡萄糖苷酶的研究鲜有报道。【拟解决的关键问题】提取高质量的高糖土壤宏基因组DNA,构建高糖土壤宏基因组文库,获得新型的β-葡萄糖苷酶,为进一步获取具有优良性状的β-葡萄糖苷酶奠定基础。
1 材料与方法
1.1 试验材料
试验土壤为采自广西南宁市蒲庙糖纸厂常年被废糖蜜侵染的土壤;大肠杆菌(Escherichiacoli)EPI300和载体pEpiFOS-5购自Epicentre公司,E.coliBL21 购自Stratagene 公司,载体pSE380购自Invitrogen公司;限制性内切酶、PCR 扩增聚合酶和T4DNA连接酶均购自TaKaRa公司;对硝基苯基-β-D-吡喃葡萄糖苷(p-NPG )及各对硝基苯基底物等均购自Sigma公司;文库构建试剂盒购自Epicentre公司,Ni-NTA 购自Qiagen 公司,PCR 产物纯化试剂盒、质粒DNA小量提取试剂盒及胶回收试剂盒均购自BioFlux公司;其他试剂均为国产分析纯。
1.2 宏基因组DNA文库构建
按照EpiFOSTMFosmid Library Production Kit试剂盒步骤进行操作,构建宏基因组文库。
1.3 宏基因组文库中β-葡萄糖苷酶活性克隆的筛选
将文库影印到七叶苷平板上,37 ℃培养12~15 h,经氯仿熏蒸破胞15 min,再在37 ℃培养箱显色2 h后观察,若菌落周围变黑则为阳性克隆子。将筛选出来的阳性克隆子进行培养、提取质粒,并转化到大肠杆菌EPI300,涂布到七叶苷平板上,若平板上仍显示活性,则确定该克隆子含有β-葡萄糖苷酶基因。
1.4 重组Fosmid质粒的亚克隆
提取已验证的阳性克隆子的质粒DNA,用适当的限制性内切酶对质粒进行DNA酶切,将已酶切的质粒DNA与去磷酸化的经相同限制性内切酶酶切的质粒载体pUC19连接。将连接产物转化到E.coliJM109中,涂布到七叶苷平板上。37 ℃培养,筛选出有酶活性的亚克隆。通过质粒提取及酶切验证后送交广州华大基因公司测序。
1.5 亚克隆序列生物信息学分析
使用VECTOR NTI Advance 10软件对已测序的DNA序列进行拼接,采用NCBI的BlastX和BlastN工具与GenBank数据库进行序列比对和分析。通过NCBI的在线ORF Finder工具对已测序的DNA序列进行开放阅读框的预测。用SMART分析氨基酸序列的组件结构,进行结构域预测。使用SignalP 4.1 server 进行信号肽预测。使用MUSCLE algorithm的Jalview软件进行在线序列分析和进化树构建。
1.6 β-葡萄糖苷酶基因的克隆
根据阳性亚克隆子的测序结果设计引物,上游引物unbgl3A-1:5’-CACTCATGATGCACCACCACCACCACCACCAAAGCTCCACTTCGTTAAAG-3’ (引入PagⅠ酶切位点和6×His tag),下游引物unbgl3A-2:5’-CCCGAATTCTTATTCCACAACGAAAGA ACC -3’(引入EcoR I酶切位点)。PCR 反应程序:95 ℃ 2 min;95 ℃ 10 s,55 ℃ 30 s,72 ℃ 120 s,30 个循环;72 ℃ 10 min。以pUC-unbgl3A质粒为模板,采用Prime STAR HS DNA 聚合酶进行PCR扩增β-葡萄糖苷酶基因unbgl3A。用小量PCR纯化试剂盒对PCR扩增产物进行纯化,纯化产物进行PagI和EcoR I酶切,与经NcoI和EcoR I酶切的表达载体pSE380连接,转化到E.coliBL21中,筛选阳性克隆子进行测序。将成功构建的重组质粒命名为pSE-unbgl3A。
1.7 重组酶UNBGL3A的诱导表达和纯化
把已验证正确的具有β-葡萄糖苷酶活性的重组菌株接种到LB(含100 μg/mL Amp)中, 37 ℃ 220 r/min振荡培养。培养至OD600约为0.6,加入诱导剂IPTG至终浓度为 1 mmol/L,继续振荡培养10 h后,收集菌体,超声波破胞后镍亲和层析Ni-NTA 纯化重组酶Unbgl3A。
1.8 重组酶Unbgl3A酶学性质分析
(1)β-葡萄糖苷酶酶活力单位(U)的定义:在酶的最适反应条件下,每分钟水解p-NPG 释放1 μmolpNP 所需的酶量为一个单位。
(2)β-葡萄糖苷酶的酶活力测定方法:取14 μlp-NPG(25 mmol/L)溶液和116 μl最适pH值的缓冲液混合,最适温度下预热10 min,加入10 μl稀释适当倍数的纯酶液,准确反应15 min后,立即加入70 μl 0.4 mmol/L的Na2CO3终止反应并显色。取200 μl上述反应液加到96孔板中,用酶标仪测定反应液的OD410(以加入10 μl已失活的酶液作为空白对照)。
以牛血清白蛋白为标准品,参照Bradford法[19]来测定纯化的蛋白质浓度。
(3)β-葡萄糖苷酶的最适pH值测定:按照酶活测定方法,37 ℃下,在一系列pH的缓冲液中测定 pH对酶的活力的影响。以最高活力为100 %计算各pH下该酶的相对活力,相对活力最高的pH即为该酶的最适pH值。
(4)β-葡萄糖苷酶的pH 稳定性的测定:将纯酶保存在不同pH(3.0~9.0)的缓冲溶液中,4 ℃放置12 h。然后按照酶活测定方法,在最适反应条件下测定残余的酶活力。以最高活力作为100 %,计算各个pH 值下该酶的相对活力。
(5)β-葡萄糖苷酶的最适温度测定:按照酶活测定方法,在酶的最适pH条件下测定不同温度条件下β-葡萄糖苷酶的活力,并以最高活力100 %计算各个温度下该酶的相对活力,相对活力最高的温度就是该酶的最适作用温度。
(6)β-葡萄糖苷酶的热稳定性的测定:将酶液在一系列不同的温度下中保温1 h,在该酶的最适反应条件下测定残余的酶活力。将4 ℃保存的酶液活力视为100 %,依此计算各个温度下酶液的相对活力。
(7)β-葡萄糖苷酶的Km和Vmax测定:在最适温度、最适pH的条件下测定不同底物浓度中的β-葡萄糖苷酶的活力,并利用Lineweaver-Burk作图法计算得到酶的Km和Vmax值。
(8)不同糖类对β-葡萄糖苷酶酶活力的影响:在最适作用条件下,在标准酶反应体系中分别加入终浓度为5 %~20 %(W/V)的果糖、阿拉伯糖、半乳糖、麦芽糖和蔗糖,测定β-葡萄糖苷酶以p-NPG为底物的酶活力。以不添加上述物质的酶活力为100 %,计算上述各种单糖和双糖在不同浓度下对β-葡萄糖苷酶活力影响。
(9)β-葡萄糖苷酶底物特性分析:在最适作用条件下,以对硝基苯基-β-D-半乳糖苷、对硝基苯基-α-D-吡喃葡萄糖苷、对硝基苯基-β-D-木吡喃糖苷、对硝基苯基-β-D-纤维二糖糖苷、对硝基苯基-β-D-吡喃葡萄糖苷(p-NPG)以及纤维二糖、乳糖、麦芽糖为底物进行特异性的活力测定分析。将底物分别为p-NPG和纤维二糖的酶活力视为100 %。
(10)葡萄糖对β-葡萄糖苷酶抑制性质的研究:以2.5 mmol/Lp-NPG为底物,在最适温度及最适pH条件下加入不同浓度葡萄糖测定酶活力。不添加葡萄糖的酶活力视为100 %,依此确定葡萄糖对β-葡萄糖苷酶的活力影响。
(11)β-葡萄糖苷酶的转糖苷产物的HPLC定性检测:分别以10 %纤维二糖和10 %葡萄糖为底物加入适量的β-葡萄糖苷酶在最适pH,37 ℃作用48 h,反应结束后放置沸水中10 min终止反应,室温冷却后用高效液相色谱仪(HPLC),检测其反应终产物。以各种糖为标准样,反应样品中出峰时间与某标准样一致的可认为是该种糖。
HPLC工作条件:Agilent 1100 Series检测仪,Alltech 2000ES型蒸发光散射检测器;流动相:乙腈∶双蒸水=75∶25;流速1.0 mL/min;进样量20 μl;柱温28 ℃。
以上试验均重复3次。
2 结果与分析
2.1 高糖土壤宏基因组文库构建及质量评估
从高糖土壤中提取的DNA经纯化后,其大小和纯度满足构建Fosmid文库要求。而后进行补平回收、连接和侵染E.coliEPI300,构建一个高糖土壤宏基因组文库,文库共有320块平板,以每块平板菌落总数为290计(随机取10块平板进行菌落总数计数,平均每块平板菌落总数为293个),构建了约含9.2万个克隆的Fosmid文库。

M:λ/HindIII DNA 标记;1~12:质粒 BamHI酶切产物M: λ/HindIII DNA Marker; 1-12: Fosmids digested with BamHI图1 琼脂糖凝胶电泳分析宏基因组文库质粒的BamHI酶切产物Fig.1 Agarose gel electrophoresis analysis of plasmids from metagenomic Fosmid library digested with BamHI
随机挑取Fosmid文库中的12 个克隆子,提取质粒并进行BamHI酶切,酶切产物经琼脂糖凝胶电泳,如图1 所示,12个质粒均含有7.5 kb载体条带,而且酶切带型绝大部分不相同,证明插入片段的随机性良好。其中插入的外源DNA 片段大小均分布在25~44 kb之间,估算平均插入片段的大小约为34 kb,文库含外源DNA 总量约为为3.1×109bp。
2.2 宏基因组文库中β-葡萄糖苷酶活性克隆子的筛选
采用平板影印方法把文库影印到七叶苷筛选平板,经过37 ℃过夜培养后进行颜色观察,共筛选到
了11个表达β-葡萄糖苷酶活性的克隆。图2-A是其中一个能在七叶苷筛选平板上表达活性的克隆,而后将其进一步分离纯化(图2-B)。
2.3 测序及生物信息学分析
2.3.1unbgl3A基因的获取和序列分析 挑选文库中高效表达β-葡萄糖苷酶活性的克隆子进行亚克隆,得到含有5.3 kb外源片段的具有β-葡萄糖苷酶活性的亚克隆,经测序后用NCBI的ORF Finder工具预测该DNA序列,得到一个编码β-葡萄糖苷酶基因的开放阅读框,命名为unbgl3A。
unbgl3A基因开放阅读框 (Open reading frame,ORF)由2241个核苷酸组成,用megablast (Highly similar sequences)软件比较,在DNA水平上,该序列在GenBank核苷酸数据库未发现任何的同源基因;而经用Blastx软件检索GenBank氨基酸数据库,发现该基因编码的产物与来自拟杆菌属Bacteroidessp. D20的β-葡萄糖苷酶同源性最高(一致性73 %,相似性85 %)。Unbgl3A蛋白由747个氨基酸组成,属于糖基水解酶家族3。相对分子量为80271.2;用SMART工具(Simple Modular Architecture Research Tool)对该基因编码的产物进行结构预测,结果显示该β-葡萄糖苷酶自N端的第 1~18位氨基酸为信号肽,自N端的第89~313位氨基酸为糖基水解家族3功能域,第367~378位氨基酸为糖基水解家族3C功能域。
2.3.2 Unbgl3A的进化分析 将Unbgl3A和10个糖基水解酶家族3的β-葡萄糖苷酶蛋白质序列进行蛋白质序列的进化树分析结果(图3)表明,Unbgl3A与拟杆菌属中的Bacteroidesuniformis和BacteroidesfluxusYIT 12057的β-葡萄糖苷酶亲缘关系较近,与其他来源的β-葡萄糖苷酶亲缘关系都较远。
A:影印平板上产生黑圈的克隆子;B:阳性克隆子的纯化A: Clone producing black in the selective plate; B: Purification of the positive clone图2 Fosmid文库中阳性克隆子筛选Fig.2 The screening of positive clones of fosmid library
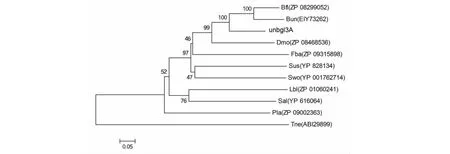
蛋白质序列和微生物来源如下:Bfl β-葡糖苷酶(ZP 08299052)来源拟杆菌菌种YIT 12057;Bun β-葡萄糖苷酶(EIY73262)来源单形拟杆菌;Dmo β-葡糖苷酶(ZP 08468536)来源莫氏八角单胞菌 DSM;Fba β-葡萄糖苷酶(ZP 09315898)来源黄杆菌细菌HQM9;Sus β-葡萄糖苷酶(YP 828134)来源Solibacter usitatus;Swo β-葡糖苷酶(YP 001762714)来源雪旺氏菌ATCC 51908;Lbl β-葡萄糖苷酶(ZP 01060241)来源Leeuwenhoekiella blandensis MED217;Sal β-葡萄糖苷酶(YP 616064)来源鞘氨醇单胞菌RB2256;Pla β-葡糖苷酶(ZP 09002363)来源乳酸芽孢杆菌154;The β-葡萄糖苷酶(ABI 29899)来源新阿波罗栖热袍菌 DSM 4359The sequences were identified as follows: Bfl β-glucosidase from Bacteroides fluxus YIT 12057(ZP 08299052); Bun β-glucosidase from Bacteroides uniformis (EIY73262); Dmo β-glucosidase from Dysgonomonas mossii DSM (ZP 08468536); Fba Flavobacteriaceae bacterium HQM9 (ZP 09315898); Sus β-glucosidase from Solibacter usitatus (YP 828134); Swo β-glucosidase from Shewanella woodyi ATCC 51908 (YP 001762714); Lbl β-glucosidase from Leeuwenhoekiella blandensis MED217 (ZP 01060241); Sal β-glucosidase from Sphingopyxis alaskensis RB2256(YP 616064); Pla β-glucosidase from Paenibacillus lactis 154 (ZP 09002363)I44874); Tne β-glucosidase from Thermotoga neapolitana DSM 4359 (ABI 29899)图3 Unbgl3A进化树Fig.3 Phylogenetic tree of Unbgl3A
2.4 unbgl3A基因的克隆
以含有unbgl3A基因的pUC19质粒为模板,PCR扩增出一条大约为2.3 kb的DNA条带。该DNA条带大小与预期的unbgl3A基因大小相符。
2.5 重组酶UNBGL3A的诱导表达和纯化
将重组质粒pSE-unbgl3A转化到宿主细胞E.coliBL21中进行诱导表达,用镍离子亲和层析柱对重组蛋白Unbgl3A纯化,纯化产物进行SDS-PAGE电泳分析。结果显示,在约为80 kD处有明显的蛋白质特征性条带,其分子量与理论计算分子量相符,表明unbgl3A基因成功表达,可以进行酶学特性分析(图4)。

1:E. coli BL21/pSE380 诱导菌体的裂解物;2:E.coli BL21/pSE-Unbgl3A 诱导菌体的裂解物;3:纯化的Unbgl3A;M:标准蛋白1: Induced cell lysate of E.coli BL21/pSE380; 2: Induced cell lysate of E.coli BL21/pSE-unbgl3A; 3:Purified Unbgl3A; M: Standard protein marker图4 Unbgl3A表达产物SDS-PAGE分析Fig.4 SDS-PAGE analysis of Unbgl3A
2.6 重组蛋白UNBGL3A酶学特性分析
2.6.1 温度和pH 对Unbgl3A 的影响 在37 ℃条件下,分别测定Unbgl3A在不同pH(3.6~8.0)下的酶活力。重组Unbgl3A的最适作用pH值为6.0。在pH 5.0~7.0时保留70 %以上酶活力,pH值在5.0 以下和7.0以上酶活力急剧下降,在pH值小于4.5或大于7.5时只有不到20 %的相对活力(图5-A)。将纯酶保存在不同pH(3.0~9.0)缓冲液中, 4 ℃下放置12 h,在最适反应条件下测定Unbgl3A的残余酶活力,结果表明酶在pH 6.0~9.0时较为稳定,在4 ℃条件放置12 h 仍保持70 %以上的酶活力,在pH 9.0 更是保持90 %以上的酶活力(图5-B)。由此可见,该酶在偏碱性条件下较为稳定。在最适pH条件下(柠檬酸-磷酸氢二钠缓冲液,pH 6.0)分别测定Unbgl3A在25~70 ℃的不同温度条件下的酶活力,结果表明Unbgl3A的最适温度为50 ℃,在温度35~50 ℃时,重组Unbgl3A保持相对比较高的活力(>70 %),温度超过50 ℃后,酶活力急剧下降(图5-C)。将纯化的重组酶在15~60 ℃温育1 h后在最适合条件下测定Unbgl3A 的残余活力,以在4 ℃ 保存的重组酶的酶活为对照,结果表明重组U nbgl3A在低于50 ℃时可保持有约90 %的相对酶活力,50 ℃以上其酶活急剧下降,60 ℃保温1 h后酶活力几乎完全丧失(图5-D)。
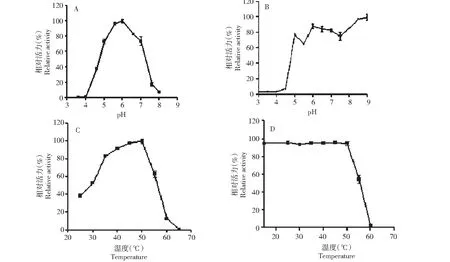
A:pH对Unbgl3A活力的影响;B:pH对Unbgl3A稳定性的影响;C:温度对Unbgl3A活力的影响;D:温度对Unbgl3A稳定性的影响A: Effect of pH on Unbgl3A enzyme activity; B: pH stability of Unbgl3A; C: Effects of temperature on Unbgl3A enzyme activity;D: Thermal stability of Unbgl3A图5 pH和温度对Unbgl3A活力的影响Fig.5 Effects of pH and temperature on the activity of Unbgl3A
2.6.2 Unbgl3A的酶反应动力学常数Km和Vmax测定 在酶反应最适温度和最适pH条件下测定Unbgl3A在0.5~8.0 mM的p-NPG浓度中的酶活力。通过与酶促反应速度的倒数1/V对底物浓度的倒数1/[S]作图,即Lineweaver-Burk双倒数作图法。X和Y轴上的截距分别代表酶的米氏常数(Km)和最大反应速度(Vmax)的倒数。计算出Km值为6.45 mM,Vmax为50 μmol/(mg·min)。
2.6.3 不同糖类对重组Unbgl3A的酶活力的影响 在最适作用条件下,在标准酶反应体系中分别加入5 %~20 %(w/v)的果糖、阿拉伯糖、半乳糖、麦芽糖和蔗糖,测定上述各种单糖和双糖对重组Unbgl3A的酶活力影响。阿拉伯糖、果糖、半乳糖和蔗糖对Unbgl3A有激活作用,而麦芽糖对重组Unbgl3A酶活力有抑制作用(图6-A)。
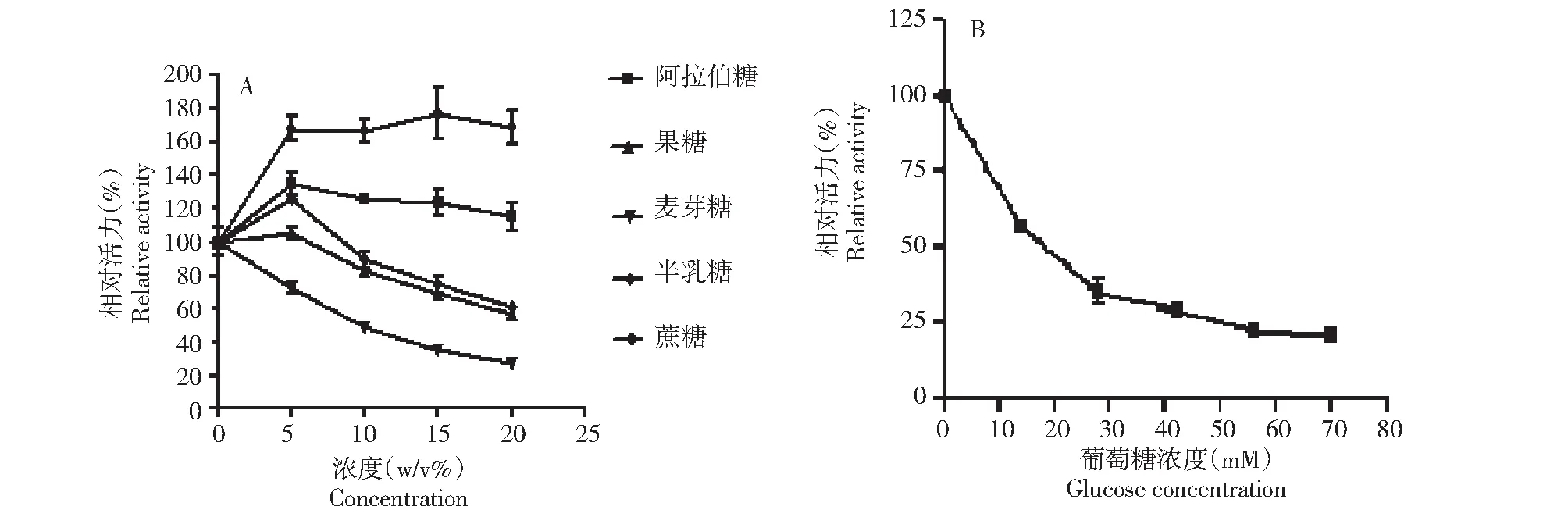
A:阿拉伯糖、果糖、麦芽糖、半乳糖和蔗糖对Unbgl3A活力的影响;B:葡萄糖对Unbgl3A活力的影响A: Effect of arabinose, fructose, maltose, galactose and sucrose on Unbgl3A enzyme activity; B: Effect of glucose on Unbgl3A enzyme activity图6 阿拉伯糖、果糖、麦芽糖、半乳糖、蔗糖和葡萄糖对Unbgl3A活力的影响Fig.6 Effect of arabinose, fructose, maltose, galactose, sucrose and glucose on Unbgl3A enzyme activity

底物Substrate 糖苷键Linkage of Glycosyl group相对水解活力(%)Relative initial rate of hydrolysis糖类(2 mg/mL) Saccharides 纤维二糖 Cellobioseβ-(1-4)Glc100乳糖 Lactoseβ-(1-4)Gal5.8±0.91麦芽糖 Maltoseα-(1-4)Glc5.7±0.84芳基糖苷(2.5 mM)Aryl-glycosides 对硝基苯基-β-D-吡喃葡萄糖苷 p-NPGβGlc100对硝基苯基-α-D-吡喃葡萄糖苷 p-NP-α-D-glucopyranosideαGlc2±0.32对硝基苯基-β-D-纤维二糖糖苷 p-NP-β-D-cellobiosideβCel44.1±0.97对硝基苯基-β-D-半乳糖苷 p-NP-β-D-galactopyranosideβGal2.3±0.41对硝基苯基-β-D-木吡喃糖苷 p-NP-β-D-xylopyranosideβxyl3.0±0.53
蔗糖对重组Unbgl3A酶活力有激活作用,随着蔗糖浓度的增大蔗糖的激活作用提高。15 %的蔗糖激活作用最大,使Unbgl3A的酶活力提高70 %;加入5 %~20 %(w/v)的阿拉伯糖对重组Unbgl3A酶活力有激活作用,激活作用随着阿拉伯糖浓度的增大而减弱,其中加入5 %的阿拉伯糖时重组Unbgl3A的酶活力提高最显著,提高了35 %;低浓度半乳糖和果糖对重组Unbgl3A的酶活力有激活作用,其中5 %的半乳糖对重组Unbgl3A的酶活力提高20 %,5 %的果糖对重组Unbgl3A的酶活力分别提高5 %。随着半乳糖和果糖浓度增加,激活作用逐渐减弱,直至最后抑制重组Unbgl3A酶活力。
2.6.4 葡萄糖对Unbgl3A抑制性质的研究 取纯化的Unbgl3A与不同浓度的pH 值为5.6葡萄糖溶液50 ℃作用15 min后,p-NPG法测定不同浓度的pH 5.6葡萄糖溶液对Unbgl3A的酶活力影响(图6-B)。从图6-B中可以看出葡萄糖对Unbgl3A的抑制作用较强。浓度为15 mM时,Unbgl3A的酶活力降低了45 %,随后酶活力下降逐渐趋缓。
2.6.5 Unbgl3A底物特异性研究 在最适作用条件下,以对硝基苯基-β-D-吡喃葡萄糖苷、对硝基苯基-β-D-半乳糖苷、对硝基苯基-α-D-吡喃葡萄糖苷、对硝基苯基-β-D-木吡喃糖苷、对硝基苯基-β-D-纤维二糖糖苷和纤维二糖、乳糖、麦芽糖为底物测定重组Unbgl3A的酶活力,了解重组Unbgl3A的底物特异性。结果表明,p-NPG和纤维二糖是Unbgl3A的最适底物;Unbgl3A能很好水解以β(1-4)糖苷键连接的纤维二糖、p-NPG和p-NPC,而对其他以β(1-4)和α(1-4)糖苷键连接的低聚糖的水解作用比较弱(表1)。
2.6.6 Unbgl3A的转糖苷作用 将纯化的重组Unbgl3A分别与10 %葡萄糖和10 %纤维二糖在pH 7.0、50 ℃条件下反应48 h。同时分别加同等量的已灭活的重组Unbgl3A到10 %葡萄糖和10 %纤维二糖,作为对照。反应完成后煮沸20 min,离心取上清采用高效液相色谱进行产物检测分析。结果显示,重组Unbgl3A能够水解纤维二糖生成葡萄糖,终产物中检出微量低聚糖(如纤维三糖)(图7),以葡萄糖为受体则有很微量二糖产生(图8)。
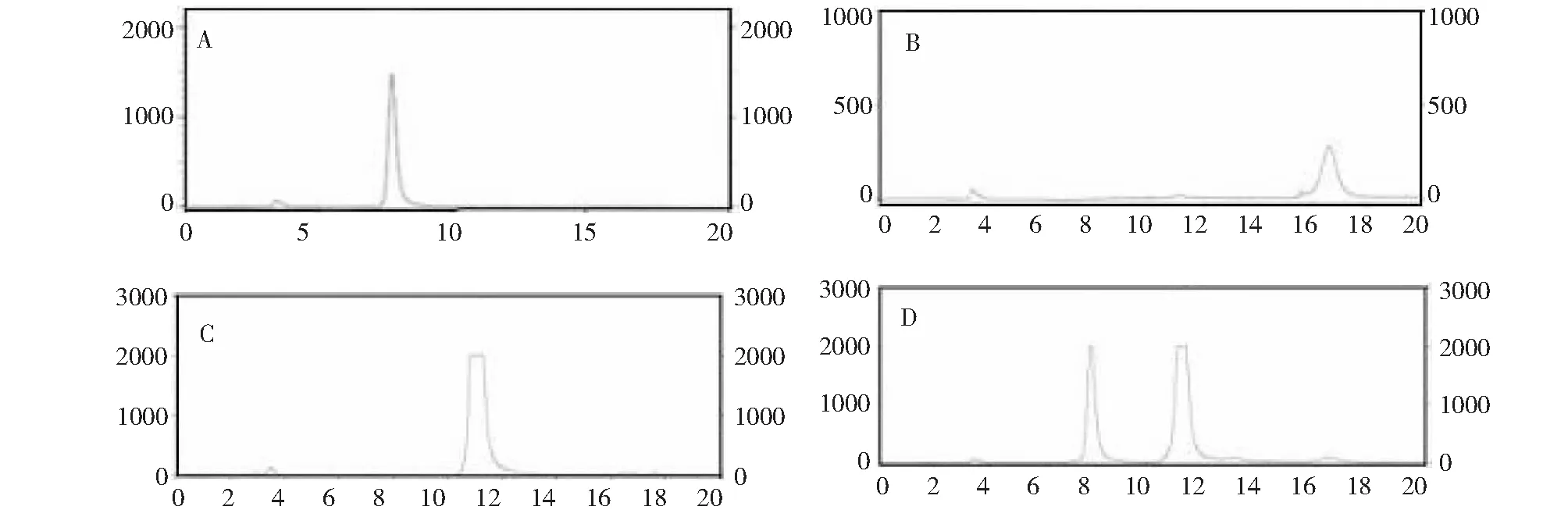
A: 葡萄糖标样液;B:纤维三糖标样;C:纤维二糖对照水解产物;D:Unbgl3A的纤维二糖水解产物A: Standard glucose; B: Standard cellotriose; C: Hydrolysis products of control; D: Hydrolysis products of cellobiose by Unbgl3A图7 纤维二糖水解产物高效液相色谱分析Fig.7 HPLC analysis of the hydrolysis products of cellobiose by Unbgl3A

A:对照转糖苷反应产物;B:Unbgl3A的转糖苷反应产物A: Transglycosylation products of control; B: Transglycosylation products by Unbgl3A图8 Unbgl3A的转糖苷反应产物高效液相色谱分析Fig.8 HPLC analysis of the transglycosylation products of Unbgl3A
3 讨 论
土壤中含有极其丰富的微生物,是工业酶类和小分子药物的重要来源。然而由于纯培养技术局限,仍然有99 %的微生物未能实现人工纯培养。这严重阻碍了人类对微生物资源的利用和开发。宏基因组技术以特定环境中微生物总DNA为研究对象,绕开了微生物纯培养,解决未培养微生物不易分离纯化的难题,是一条寻找新基因及新酶的新途径。Elisangela等[20]从桉树枯枝落叶的土壤宏基因组文库中获得β-葡糖苷酶Bg10,产物葡萄糖对该酶有激活作用;在50和100 mM葡萄糖中,Bg10活性分别增加了36.8 %和22 %。Bg10能够在1 h内完全水解40mM的纤维二糖,并且耐受乙醇至500 mM的浓度(86 %的活性),而乙醇浓度为1M仍然保留41 %的残余活性。Gruninger等[21]从奶牛瘤胃内含物的宏基因组文库中鉴定了一个多功能的GH3 家族β-葡萄糖苷酶Bgxa1,该酶能够水解pNPG、纤维二糖、pNPX(对硝基苯基-β-D-木吡喃糖苷)以及pNPAf(对硝基苯基-α-D-阿拉伯呋喃糖苷)。本研究团队采集广西南宁市蒲庙糖纸厂常年被废糖蜜侵染的土壤作为研究样品,成功构建了高糖土壤宏基因组文库,获得两个编码β-葡萄糖苷酶基因Unbgl3A和Unbgl3B[22]。本研究对其中的β-葡萄糖苷酶基因Unbgl3A进一步深入探索,结果表明该基因是一个新型的β-葡萄糖苷酶基因,与数据库中已知的β-葡萄糖苷酶基因相似性较低,而且该酶具有一些新特性,如:Unbgl3A耐受多种单糖和双糖并被多种单糖和双糖激活,15 %蔗糖可以提高酶活力170 %。Krisch等[23]从米黑根毛霉Rhizomucormiehei中得到的β-葡萄糖苷酶在15 %蔗糖中,酶活力提高到160 %,Chandra和Kalra[24]从桔绿木霉Trichodermacitrinoviride得到的β-葡萄糖苷酶则在蔗糖浓度为5 mM时酶活力被降低20 %。Jimenez等[25]同时做了不同浓度的阿拉伯糖、半乳糖、果糖、木糖和乳糖对来源于米黑根毛霉Rhizomucormiehei的β-葡萄糖苷酶的酶活力的影响实验,结果显示:只有蔗糖和果糖有激活作用,5 %果糖提高酶活力15 %。而本研究中5 %阿拉伯糖、半乳糖、果糖和乳糖分别使Unbgl3A酶活力提高35 %、20 %、10 %和10 %。Unbgl3A这种耐受多种高浓度单糖和双糖而且酶活力被多种单糖和双糖激活的特性推测这些单糖和双糖在反应中作为受体,接受p-NPG释放的葡萄糖。国内外许多研究表明不依赖微生物可培养性的宏基因组文库技术是获取新特异性酶的有效手段[26-28]。
4 结 论
本研究构建了约9.2万个克隆的高糖土壤宏基因组文库,通过活性筛选得到11个含有β-葡萄糖苷酶的克隆子,将其中一个克隆进行亚克隆,获得β-葡萄糖苷酶基因unbgl3A,其编码的蛋白质序列与已知的β-葡萄糖苷酶相似性低,具有一定的新颖性。该酶具有中温条件下稳定的特性,在50 ℃以下保存1 h,酶活力仍保持90 %的酶残余活力。Unbgl3A是一个耐受多种单糖和双糖并被多种单糖和双糖激活的β-葡萄糖苷酶,在低浓度下,乳糖、半乳糖、果糖、阿拉伯糖和蔗糖对Unbgl3A有激活作用,特别是蔗糖对它有显著的激活作用,15 %蔗糖可以使酶活力提高170 %。该酶具有一定的转糖苷功能。

