储藏时间对大豆分离蛋白结构及凝胶性质的影响
刘宝华,刘胜囡,田 翔,牛念念,李新宇,李 杨,江连洲,于文华
(1东北农业大学食品学院,哈尔滨 150030;2山东万得福实业集团有限公司,山东东营 257000)
大豆分离蛋白(Soy protein isolate,SPI)以低温变性脱脂豆粉为原料,经碱提酸沉等工序处理后得到的蛋白质[1]。蛋白质凝胶是溶液中的蛋白质分子通过有规则地交联而形成的占据原溶液空间的网状结构[2]。利用SPI的凝胶特性,可将其添加到火腿、肠等食品中,从而可改变产品质构特性,提高产品对水分、油类和风味物质等的保持能力[3]。在储藏过程中,SPI的品质会随着储藏时间的延长而逐渐发生改变,从而影响利用SPI生产的产品品质稳定性,进而极大程度地限制了商用SPI在食品领域内的应用。近年来,关于储藏时间对SPI结构及凝胶性质影响的研究较少,国内主要集中在储藏条件对SPI功能性质影响的研究上,如石彦国等[4-5]对贮藏的环境以及包装材料和氧气含量进行了研究;郭凤仙[6]研究了贮藏条件、原料及加工损失对蛋白贮藏稳定性的影响;Chun Liu等[7]研究了大豆蛋白在不同储藏条件下的功能性质变化;Vilene等[8]研究了储藏温度对不同水分活度大豆分离蛋白理化特性的影响。但目前国内外鲜有关于储藏时间对SPI结构及凝胶性质影响的研究报道。因此,本文模拟SPI的商业仓库储藏环境,重点研究储藏时间对SPI结构及凝胶性质的影响,解析SPI结构变化对其凝胶性质的影响,以期为解决储藏期内SPI凝胶性质改变提供科学依据。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白(蛋白质量分数89.21%),山东万得福实业集团有限公司;SDS-PAGE凝胶配置试剂盒,北京索宝来试剂公司;氢氧化钠、磷酸二氢钠、磷酸氢二钠,北京新光化工试剂厂;国产分析纯试剂。
1.2 仪器与设备
F-4500荧光分光光度计,日本日立公司;LD5-10型低速离心机,北京德世科技有限公司;K60型食品调理机,德国博朗;L-8800型氨基酸分析仪,日本日立公司;Healthcare SE260 电泳仪,美国GE公司;MAGNA-IR560傅里叶红外光谱,美国尼高丽公司;TA.XTPLUS质构仪,英国SMS公司。
1.3 方法
1.3.1大豆分离蛋白的储藏 将SPI采用PE膜真空袋(10cm×15cm,最大氧气通透率为48cm3/(m2·24h·atm),最大H2O 6.86g/(m2·24h·atm))包装,置于25℃恒温箱中储藏。储藏时间为150d,每隔30d对SPI性质进行分析。
1.3.2羰基含量的测定 参考Levine等[9]的方法对样品的羰基含量进行测定。将0.35mL样品溶液与1mL含有10mmol/L 2,4-二硝基苯肼的2mol/L HCl混合,20℃水浴保温2h。另取0.35mL样品溶液与1mL不含有10mmol/L 2,4-二硝基苯肼的2mol/L HCl混合,同样20℃水浴保温2h,作为空白。随后向每个离心管内加入0.45mL 40%三氯乙酸,剧烈摇匀后静置20min,10 000g离心20min后弃去上清液,随后用1.5mL乙醇-乙酸乙酯混合溶液(1∶ 1,v/v)洗涤沉淀,然后10 000g离心10min弃去洗涤液,重复洗涤沉淀3次。最后悬浮于1.0mL 0.1mol/L含6mol/L盐酸胍pH 7.0磷酸盐缓冲液中,37℃水浴20min,每间隔5min剧烈振摇1次。以空白为对照在367nm处作校正,以22 000mol/(L·cm)为消光系数计算每mg蛋白质羰基衍生物的摩尔数。
1.3.3表面疏水性的测定 表面疏水性采用ANS荧光探针法[10]进行测定。将样品溶于0.01 mol/L、pH 7.0磷酸盐缓冲溶液中,调节蛋白浓度分别为0.15、0.20、0.25、0.3、0.35、0.40、0.50mg/mL,取4.0mL上述蛋白溶液,加入20μL浓度为8.0mmol/L的ANS(1-苯胺基-8-萘磺酸)溶液(用0.01mol/L、pH 7.0的磷酸盐缓冲液配制得到),混匀后迅速测定其荧光强度。设定激发波长和发射波长分别为390nm和470nm,激发和发射狭缝宽均为5nm,以未加ANS溶液的相应浓度的蛋白溶液的荧光强度作空白。样品的荧光强度值扣除试剂空白值即为蛋白的相对荧光强度值。以相对荧光强度对蛋白质浓度作图,其初始斜率作为蛋白质的表面疏水性指数(H0)。
1.3.4氨基酸组成分析 准确称取30~50mg样品(精确至0.000 1g)至订制的水解管中,加入10mL 6mol/L HCl溶液,随后将水解管用氮气吹扫15min,用酒精喷灯封管,随后置于110℃烘箱中水解22~24h后取出,待冷却到室温后将样品过滤至50mL容量瓶中,并用纯水洗涤水解管和滤纸3次,收集合并洗涤液和滤液于容量瓶中,定容后准确量取1mL样品于60℃真空脱酸浓缩后,加入1mL柠檬酸钠缓冲液,用震荡混匀器混合均匀,经0.2~0.45μm滤膜过滤后用氨基酸自动分析仪测试。
1.3.5SDS-PAGE凝胶电泳 采用SDS-PAGE凝胶电泳对大豆分离蛋白样品中7S、11S含量进行测定,具体实验方案如下:取20μL样品加入20μL含β-巯基乙醇的4X上样缓冲溶液中,煮沸5min。分别配置浓度为12%(w/v)的分离胶和浓度为5%(w/v)的浓缩胶,样品添加量为10μL。电泳过程恒压,浓缩胶和分离胶的电压分别为80V和120V。染色液为0.1%考马斯亮蓝R-250(甲醇︰冰乙酸=4∶ 1∶ 5)的混合溶液,脱色液为(甲醇∶ 冰乙酸∶ 水=4∶ 1∶ 5)混合溶液。
1.3.6大豆分离蛋白凝胶的制备 将大豆分离蛋白与水(1∶ 4,w/v)倒入食品调理机中进行预处理,处理结束后将混合物在3 500r/min下离心13min,85℃恒温水浴锅中加热45min,冷却至室温后将其在4℃条件下冷藏8h以完全形成凝胶。冷藏结束后,制成厚度为30mm的凝胶块,用于质构测定。
1.3.7大豆分离蛋白凝胶质构性质的测定 大豆分离蛋白凝胶强度采用TA.XTPLUS质地分析仪进行测定,测定参数为穿刺模式、p/0.5 探头,测试前速率1 mm/s、测试速率2 mm/s、测试后速率10 mm/s、感应力5 g,压缩程度80%,测定温度为室温,每个样品重复3次测定,取其平均值作为最终结果。凝胶强度测试完毕后,调整TA.XTPLUS质地分析仪的分析程序,测定凝胶块的硬度,测定参数为TPA模式、测试前速率1 mm/s、测试速率5 mm/s、测试后速率5 mm/s、感应力5 g、测试前速度距离10 mm。
1.3.8红外光谱 依据Mantsch[11]的方法对不同储藏时间的样品进行红外光谱测试。称取样品2 mg,加入溴化钾100 mg,压片后进行测定。在25℃条件下,扫描波数谱段范围为4 000~400 cm-1,波数精度为0.01 cm-1,扫描次数为64次,谱图利用Peakfit Version软件进行处理。
1.4 数据统计方法
每组试验都进行3次平行试验,采用Origin 8.5和PeakFit 4.12软件分析数据并作图。利用SPSS Statistics 22软件对数据进行ANOVA差异显著性分析,P<0.05为显著性差异。
2 结果与分析
2.1 储藏时间对SPI样品羰基含量的影响
SPI中羰基含量的多少可以反映其被氧化的程度,由于SPI的羰基衍生物通常来源于赖氨酸(Lys)、精氨酸(Arg)和脯氨酸(Pro)等氨基酸残基的氧化,或来源于蛋白骨架断裂的产物(α-酰胺化反应),因此,SPI的蛋白质羰基含量增加通常表明其发生了氧化反应[12]。由图1可知,随着储藏时间的延长,SPI羰基含量逐渐升高,说明SPI在储藏过程中发生了氧化反应。在SPI的制取过程中,大豆细胞结构的破坏会使多不饱和脂肪酸易被脂肪氧合酶催化而产生脂质过氧化反应,进而生成自由基和活性次生氧化产物,可能会诱导SPI氧化[13]。工业上生产SPI所采用的原料为低变性脱脂豆粕,其中含有1%左右的残余脂质,工业化生产SPI的过程中存在高温加热过程,可能会导致这些油脂发生氧化生成脂质过氧化物,进而发生自由基链式反应,从而生成大量自由基,所生成的自由基可能攻击蛋白质使其氧化[14]。SPI的制备过程中会涉及原料与搅拌器以及喷雾干燥器等设备的接触,从而有可能向SPI中引入金属离子,并与过氧化物反应产生自由基进而导致蛋白质氧化[15]。也有可能是PE膜真空袋中存有微量氧气,在储藏过程中,诱导SPI发生了氧化反应。蛋白质的氧化可使其氨基酸侧链和蛋白质多聚肽骨架发生一系列变化,如蛋白质断裂、交联、伸展和构象的改变[16]。
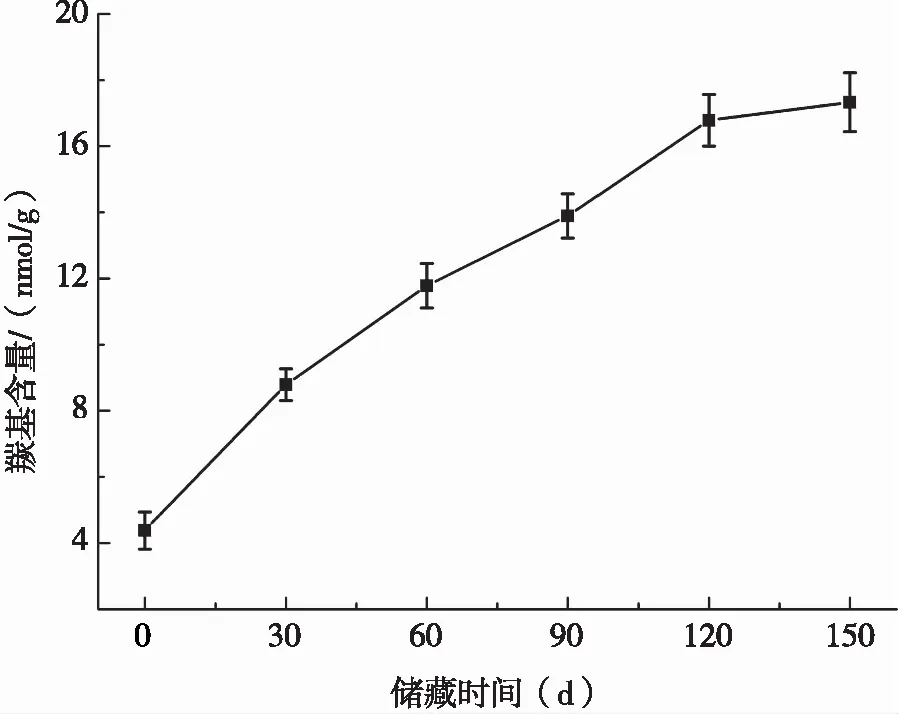
图1 储藏期内大豆分离蛋白羰基含量变化
2.2 储藏时间对SPI表面疏水性的影响
蛋白质的疏水作用是一种配位体间非共价键相互作用。Boatright等[17]发现,蛋白质发生氧化后会使其表面疏水性下降。黄友如[18]研究发现,蛋白质的表面疏水性会随着蛋白质氧化程度的加剧而逐渐下降。由图2可知,随着储藏期延长,SPI的表面疏水性逐渐降低,这可能是由于SPI发生氧化反应,较大程度地促进了聚集物的形成,从而使蛋白表面疏水性氨基酸逐渐包埋于分子内部,降低了大豆蛋白表面疏水性。吴伟[2]研究发现,脂质过氧化产物可以氧化SPI疏水侧链基团,进而使蛋白质部分去折叠,暴露出的疏水基团在疏水相互作用和氧化共价交联的共同作用下可生成氧化聚集体,从而降低蛋白质的表面疏水性。此外,储藏期内SPI表面疏水性的下降也有可能是由于亲水基团(羰基)形成,蛋白质聚集以及疏水性残基的暴露引起的结构修饰[19]。
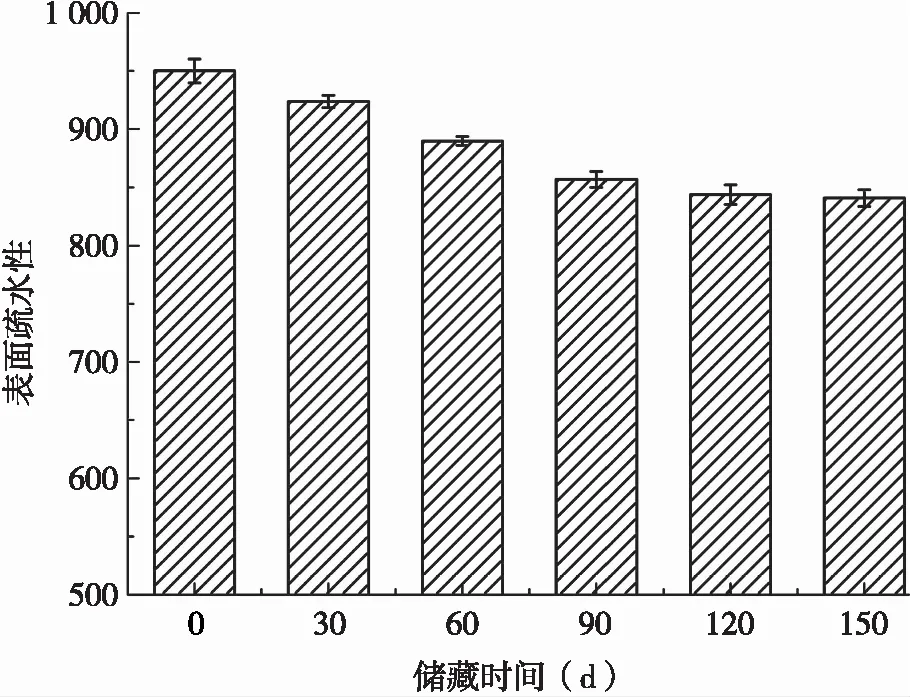
图2 储藏期内SPI表面疏水性变化
2.3 储藏时间对SPI氨基酸组成的影响
如表1所示,由于在预处理过程中采用了浓HCl水解样品,从而使色氨酸(Trp)被完全破坏,且天冬酰胺(Asn)和谷氨酰胺(Gln)的酰胺基被水解,因此表1中没有Trp、Asn和Gln的含量。在氧气及金属离子(Fe3+)的作用下,由于自由基传递反应的发生,使得蛋白质肽链中氨基酸残基损伤以及肽键断裂,从而使蛋白质发生氧化。一般参与氧化反应的有N-末端的α-氨基、Pro、Arg和Lys侧链以及半胱氨酸(Cys)。由表1可知,Cys、Arg和Lys的含量随着储藏时间的延长而逐渐降低,由此可推测,在储藏过程中发生了氧化反应使得Arg和Lys侧链被氧化生成羰基。吴伟[2]研究发现,经ROO·、HPODE和丙烯醛分别氧化后,大豆蛋白的游离氨基和有效赖氨酸含量显著下降(P<0.05)。Liu等[20]研究发现,蛋白质经ROO·氧化处理后,其Lys残基的ε-氨基可转变为羰基,再与蛋白质的氨基反应进一步生成西佛碱,从而使蛋白质的游离氨基和有效赖氨酸含量发生下降。相关性分析表明,酪氨酸(r=0.144,P<0.05)、半胱氨酸(r=0.877,P<0.05)、苯丙氨酸(r=0.480,P<0.05)、赖氨酸(r=0.956,P<0.05)、精氨酸(r=0.814,P<0.05)和脯氨酸(r=0.825,P<0.05)含量与表面疏水性呈正相关。
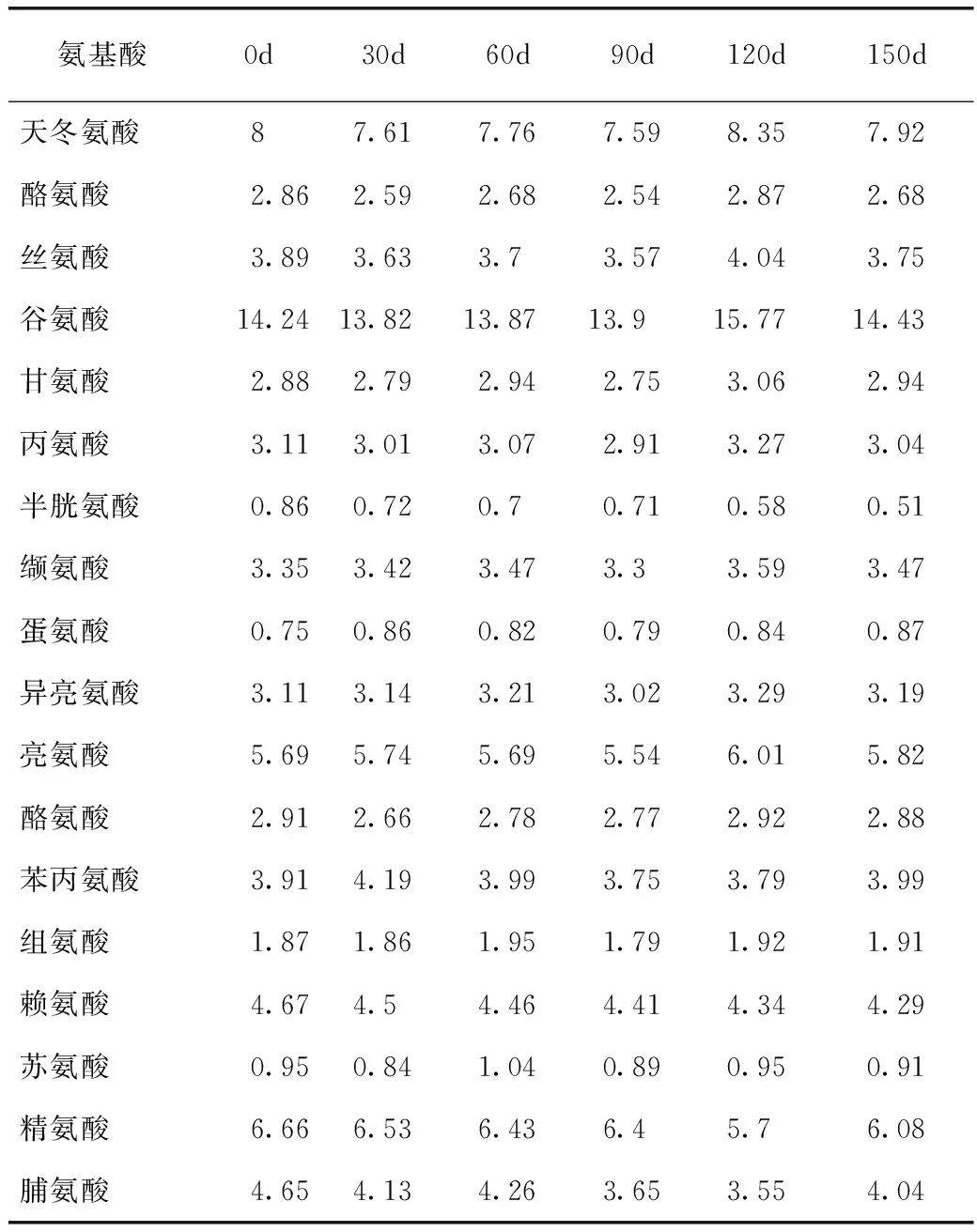
表1 储藏期内SPI氨基酸含量变化
2.4 SDS-PAGE凝胶电泳分析
由图3可知,储藏30 d后,7S和11S亚基条带颜色明显加深,条带变宽,而在30~150 d储藏过程中,7S和11S亚基条带并未发生显著变化,且在储藏过程中并没有新的蛋白质聚合物生产。自由基可通过夺氢、加氧、偶合以及裂解等反应直接诱导蛋白质发生氧化,从而使蛋白主肽链断裂、侧链基团氧化以及形成共价交联物[15]。而吴伟[2]通过对大豆蛋白进行AAPH、HPODE和MAD氧化,结果表明,随着AAPH、HPODE和MAD浓度的增大,大豆蛋白的亚基条带颜色呈现不同程度的变浅,并在分离胶顶部出现聚集体条带。由此推测,本试验在模拟仓储环境储藏下,SPI的氧化反应并不剧烈,肽链未出现显著断裂。
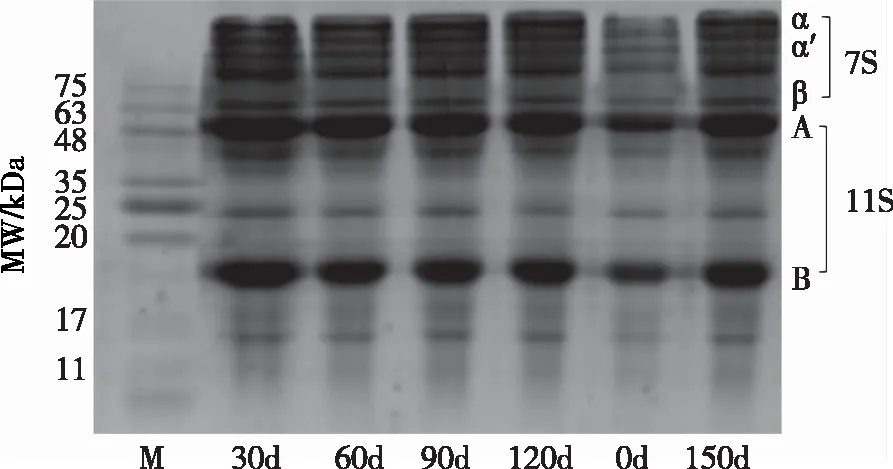
图3 储藏期内SPI的SDS-PAGE电泳
2.5 大豆分离蛋白红外光谱分析
FT-IR光谱的研究可以定量给出样品中蛋白质的二级结构。由图4、表2可知,在储藏初期,大豆蛋白的结构是以β-折叠为主,其含量为37.42%。储藏0~60 d时,无规则卷曲的含量逐渐下降,说明蛋白质趋向于一种有序的状态,而α-螺旋和β-折叠的含量总体呈现上升的趋势。由于α-螺旋和β-折叠埋藏在蛋白质分子内部,从而在0~60 d内蛋白质的表面疏水性会下降。储藏60~120 d时,无规则卷曲含量逐渐上升,α-螺旋和β-折叠的含量逐渐下降,蛋白质趋向于一种无序状态。当储藏时间达到150d时,α-螺旋含量下降至13.78%,β-折叠上升至42.48%,无规则卷曲含量下降至15.57%,从而推测该阶段蛋白质趋向于一种有序状态,但大量的α-螺旋和β-折叠包埋在分子内部导致蛋白表面疏水性呈下降趋势,从而分子间疏水作用力下降。吴伟[2]通过研究脂质过氧化产物对SPI结构的影响,发现蛋白质氧化会导致SPI的α-螺旋含量下降,并伴随着聚集体和共价交联物的生成。由此可推测,储藏期内SPI的二级结构逐渐发生改变。
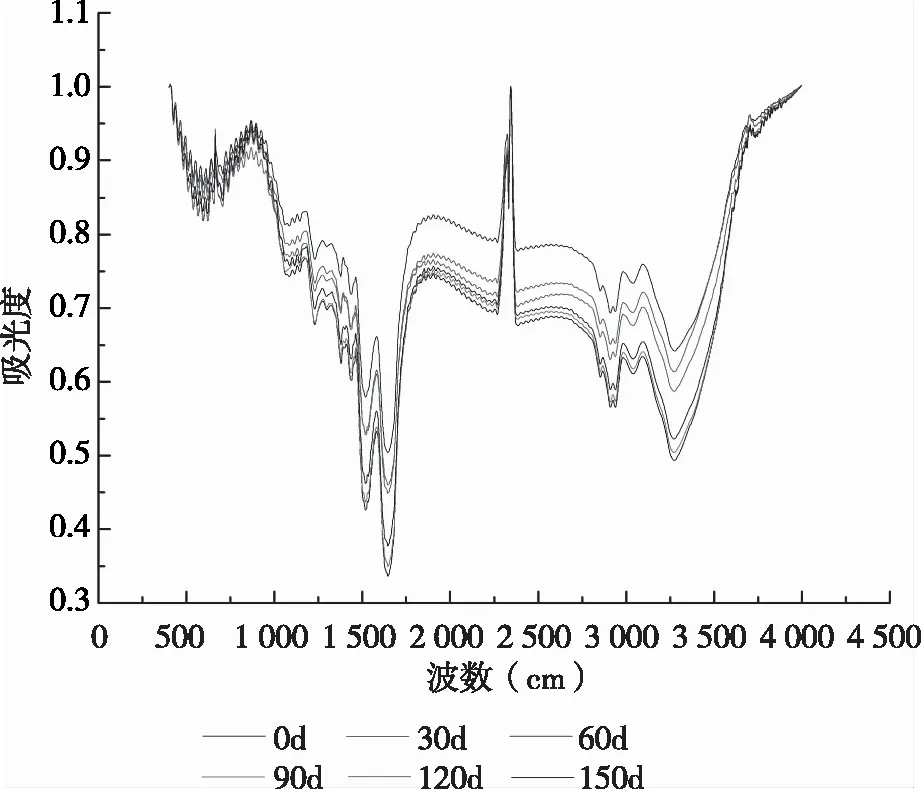
图4 储藏期内SPI的红外光谱

图5 储藏期内大豆分离蛋白酰胺Ⅰ带的拟合图谱
2.6 储藏期对SPI凝胶性质的影响
在大豆蛋白凝胶形成的过程中,7S的β亚基与11S的碱性亚基有选择地进行相互作用,并直接影响着大豆蛋白的凝胶性,11S蛋白质的酸性亚基对凝胶网状结构的形成具有重要作用。蛋白凝胶形成时,受热会使蛋白分子分散,憎水基团暴露并由氢键、二硫键等结合形成特殊的网状结构,因此大豆蛋白的结构决定了其凝胶的形成过程。由图6可知,在0~60 d时,SPI凝胶的凝胶强度及硬度逐渐下降,在60~120 d时,其凝胶强度及硬度又逐渐上升,在150 d时,下降至最低值。SPI凝胶的凝胶强度及硬度变化规律与其二级结构相似,由此可推测,储藏期内SPI二级结构的改变会进而影响其凝胶性质。由表1可知,随着储藏时间的延长,半胱氨酸的含量逐渐降低,而蛋白质氧化可以改变半胱氨酸的氧化还原状态,改变巯基和二硫键的数量和分布[21]。

表2 储藏期内SPI的二级结构含量
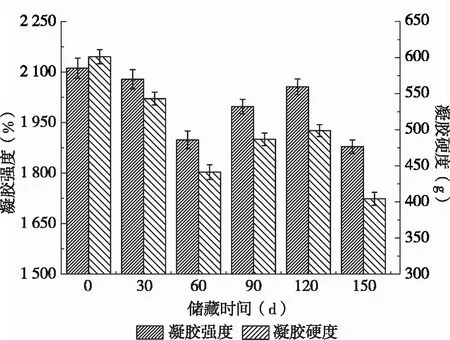
图6 储藏期内大豆分离蛋白的凝胶性质变化
吴伟等[22-23]研究发现,随着蛋白质氧化程度的加深,凝胶硬度逐渐下降,这是由于蛋白质氧化使得维持其凝胶硬度的主要作用力(二硫键)降低。这主要是由于蛋白质氧化导致二硫键向游离巯基转变,随着蛋白质氧化过程的持续,这种游离巯基被不断氧化,最终变为不可逆状态[2]。Ooizumi等[24]研究发现,蛋白质氧化聚集会破坏大豆蛋白结构的稳定性,进而降低大豆蛋白凝胶的强度和持水性,改变其微观结构。还可能是由于随着储藏时间的延长,-SH基团被脂肪氧合酶催化产生的脂质氢过氧化物部分氧化,进而使通过-SH/-S-S-交换反应形成的分子间二硫键数量降低[25],从而导致SPI凝胶强度及硬度下降。相关性分析表明,SPI凝胶强度与表面疏水性(r=0.592,P<0.05),凝胶硬度与表面疏水性(r=0.793,P<0.05)均呈正相关。
3 结论
将SPI采用PE膜真空袋包装,25℃储藏0、30、60、90、120、150d,研究储藏时间对SPI结构及凝胶性质的影响,结果发现,随着储藏时间的延长,SPI的羰基含量逐渐上升,表明SPI在储藏过程中发生了氧化反应;随着储藏时间的延长,SPI的表面疏水性下降,氨基酸含量发生改变,且红外光谱结果表明,储藏期内SPI的二级结构发生改变;储藏0~60d时,SPI凝胶强度及硬度随着储藏期的延长而逐渐减弱,60~120d时,凝胶强度及硬度逐渐增强,当储藏时间达到150d时,凝胶强度及硬度降至最小值,SPI凝胶性质的变化规律与其二级结构相似,且其凝胶强度及硬度的数值均与表面疏水性呈正相关。◇

